Redacción Farmacosalud.com
Según el profesor Plácido Navas, director del grupo de investigación de la coenzima Q10 en la Universidad Pablo de Olavide de Sevilla, perteneciente al Centro de Investigación Biomédica en Red de Enfermedades Raras (CIBERER), ubiquinol ha logrado una recuperación de “las funciones motrices” en modelos animales, mientras que en humanos -en concreto en pacientes pediátricos con deficiencia de CoQ10 y ataxia- ha demostrado “una mejora sustancial” de los síntomas en dos de los cinco niños estudiados. La Agencia Europea del Medicamento (EMA) ha designado Ubiquinol como medicamento huérfano para el tratamiento de la deficiencia primaria de coenzima Q10, una enfermedad rara grave que ocasiona alteraciones musculares, del sistema nervioso y del renal, y que puede llegar a causar fallos de otros órganos.
“El ubiquinol, forma reducida del coenzima Q10, es un lípido con dos grupos hidroxilos pero que necesita estar disuelto en lípidos como aceites vegetales. Se presenta en cápsulas de gel y se toma por vía digestiva”, explica Navas a www.farmacosalud.com. Los estudios sobre la posible aplicación de este medicamento huérfano para el tratamiento de la deficiencia primaria de coenzima Q10 han sido dirigidos por el grupo liderado por el profesor Navas. En la vertiente clínica ha colaborado el grupo de investigación del Hospital Sant Joan de Déu (Esplugues de Llobregat, en Barcelona) que lidera Rafael Artuch, también del CIBERER, y las empresas PharmaNord y Kaneka. Este medicamento huérfano está patrocinado por el Centro de Investigación Biomédica en Red (CIBER).
Una afección hereditaria causada por defectos en la biosíntesis del coenzima Q10
El síndrome de deficiencia primaria de coenzima Q10 es una enfermedad hereditaria causada por defectos en los genes encargados de la biosíntesis del coenzima Q10, una sustancia esencial en la producción de la energía y en el sistema de defensa antioxidante, que son procesos biológicos necesarios para que las células funcionen correctamente. El Ubiquinol es la forma reducida del coenzima Q10. Se espera que este fármaco complemente al coenzima Q10 presente de manera natural en el organismo, contribuyendo a que las células produzcan más energía y se alivien de este modo los síntomas de la enfermedad.

Profesor Plácido Navas
Fuente: CIBER
Ubiquinol ha sido estudiado, por un lado, en varios modelos de ratón que padecen una patología mimética del síndrome de deficiencia de coenzima Q10 humano. Se ha demostrado que el fármaco “llega a integrarse en los tejidos" y que los ratones "recuperan las funciones motrices”, señala el investigador, quien añade que “también se ha demostrado” que esos modelos animales “recuperan los niveles normales de marcadores bioquímicos que se usan para identificar la patología mitocondrial”. En cuanto a la investigación en humanos, ya se ha realizado un ensayo preclínico tratando con ubiquinol a cinco pacientes pediátricos con deficiencia de CoQ10 y ataxia. Según el experto, “los resultados han demostrado una mejora sustancial en dos de los pacientes de sus síntomas con el test ICARS (de International cooperative ataxia rating scale), que se usa para determinar el nivel del desorden, a corto plazo. Se han tratado con una concentración de 30mg/kg/día de ubiquinol, bastante menor que el tratamiento que tenían con la forma oxidada del coenzima Q10”.
El CoQ10 es un producto natural que se encuentra actualmente en el mercado internacional como complemento alimentario, pero en distintas formulaciones que en muchas ocasiones no son absorbibles en el organismo. "Nuestra investigación en los últimos 10 años ha consistido en encontrar la formulación más eficaz para recuperar los síntomas en pacientes. Ha sido un esfuerzo de colaboración de varios laboratorios y empresas. Queremos dar las gracias a las familias de enfermos que han colaborado con nosotros, sin las cuales no lo hubiéramos conseguido", apunta Navas, en unas declaraciones recogidas por el CIBER.
Varios medicamentos huérfanos patrocinados por el CIBER
La deficiencia primaria de coenzima Q10 provoca daños en órganos especialmente dependientes de la disponibilidad de energía como el cerebro, los músculos, el hígado o los riñones. Como consecuencia, se puede ocasionar debilidad muscular, fallo renal, ataxia, hipoacusia y epilepsia, entre otros signos clínicos. La ineficacia bioenergética lleva a la muerte de muchas células causando el colapso de los órganos. A largo plazo, esta enfermedad es debilitante y en ocasiones de desenlace fatal especialmente por fallo renal, limitaciones musculares y encefalopatía. Esta enfermedad tiene una prevalencia aproximada de 1 de cada 100.000 personas, lo que equivale a un total de unos 5.000 ciudadanos en toda la Unión Europea.
Ubiquinol es el quinto medicamento huérfano de la EMA que ha sido patrocinado por el CIBER. Estos medicamentos huérfanos están indicados para las siguientes enfermedades raras: Anemia de Fanconi tipo A, deficiencia en piruvato quinasa, adrenoleucodistrofia, deficiencia de adhesión leucocitaria tipo I y síndrome de deficiencia primaria de coenzima Q10. La designación como medicamento huérfano por parte de la EMA tiene ventajas como la de recibir una autorización de comercialización durante 10 años en los que no pueden comercializarse productos similares, el poder disponer de protocolos de asistencia y consejo científico gratuitos o con un coste reducido, y la exención de pagos para la designación. Además, las entidades que desarrollan medicamentos huérfanos tienen acceso a subvenciones específicas de la UE y de los programas de los estados miembros.
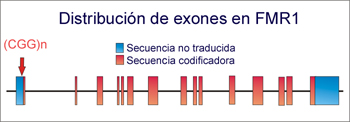
Distribución de exones en el gen FMR-1 y posición de las repeticiones del trinucleótido CGG (señalada por flecha). Cuando se supera el valor umbral, se produce la alteración que da lugar a la patología FXS
User: Octavio. CC BY-SA 3.0, https://commons.wikimedia.org/w/index.php?curid=439570
Fuente: Wikipedia
El rimonabant, posible tratamiento para el síndrome del cromosoma X frágil
En otro orden de cosas, un equipo científico liderado por Andrés Ozaita, investigador principal del Laboratorio de Neurofarmacología de la Universidad Pompeu Fabra (UPF, en Barcelona), en colaboración con investigadores de la Universidad del País Vasco, ha estudiado a rimonabant como posible fármaco para tratar el síndrome del cromosoma X frágil, obteniendo muy buenos resultados en ratones a dosis alejadas de potenciales efectos adversos. El síndrome del cromosoma X frágil (FXS, por sus siglas en inglés), es la causa más común de discapacidad intelectual heredada. Se debe a un fallo en el gen FMR1, localizado en el cromosoma X, que hace que el cuerpo produzca cantidades muy bajas de la proteína FMR1P, necesaria para que el cerebro funcione correctamente. Los niños que nacen con este síndrome presentan, entre sus múltiples síntomas, discapacidad intelectual, comportamiento hiperactivo, trastorno del espectro autista, retraso en el habla y el lenguaje y un tono muscular bajo. El FXS es una enfermedad rara que afecta a uno de cada 4.000 hombres y una de cada 8.000 mujeres.
Muchas de las afectaciones vinculadas al síndrome del cromosoma X frágil, como los problemas cognitivos o la alteración de plasticidad neuronal, dependen del sistema endocannabinoide, una red de receptores neuronales que regula procesos de recompensa, aprendizaje y memoria. Por este motivo, el equipo de Ozaita ha decidido utilizar el rimonabant, una molécula que bloquea el receptor principal del sistema endocannabinoide: el receptor para cannabinoides 1 (CB1). Se trata de un fármaco ya existente, pues fue desarrollado y aprobado por la Agencia Europea de Medicamentos en 2007 para tratar la obesidad bajo la premisa de que la inhibición de la actividad cannabinoide reduce el apetito. Desafortunadamente, el rimonabant tuvo que ser retirado del mercado dos años más tarde debido a efectos secundarios indeseados, como depresión o ansiedad. Estos efectos secundarios, sin embargo, son dependientes de la dosis de fármaco administrada, así que el estudio actual se basa en dosis 30 veces menores de rimonabant en comparación con aquellas que mostraban efectos contra la obesidad, lo que evitaría los efectos adversos observados a altas dosis.
En paralelo, uso de la molécula NESS0327
Además del rimonabant, el equipo ha utilizado la molécula NESS0327, otro antagonista de los receptores CB1 diferente al rimonabant, para demostrar que los beneficios observados con el rimonabant lo son mediante el bloqueo parcial de los receptores CB1. “No debemos descartar el uso de otras sustancias que tengan como diana los receptores CB1 para tratar el síndrome del cromosoma X frágil”, comenta Ozaita. “Algunos componentes específicos de la planta del cánnabis, como el cannabidiol, son posibles alternativas dado que se conoce su perfil farmacológico. Asimismo, en futuros estudios se debería barajar la posibilidad de iniciar el tratamiento mucho más temprano, durante el neurodesarrollo, con objeto de intentar mejorar el potencial terapéutico de las intervenciones farmacológicas”.
Según los resultados de este trabajo, parte de la tesis doctoral de Maria Gomis-González, el tratamiento con bajas dosis de rimonabant previene los fallos en la plasticidad sináptica de los ratones modelo de FXS correlacionando con la mejora cognitiva. Tal y como refleja el estudio, que aparece publicado en la revista 'Genes', y que amplía un estudio previo del grupo en 2013, los receptores CB1 son una diana muy importante a la hora de mejorar los síntomas asociados al síndrome del cromosoma X frágil, lo que amplía las posibilidades de desarrollo de nuevas moléculas dirigidas a este blanco.
Potent Presenters-Olivier Schwartz and the Electron Microscopy Core Facility, Institut
Fuente: UPF
La proteína NFAT5, posible protectora de alteraciones inmunológicas
Por último, cabe destacar que científicos del Departamento de Ciencias Experimentales y de la Salud de la UPF (DCEXS) han descubierto nuevas funciones de la proteína NFAT5 en la defensa inmunológica, como reguladora de la intensidad de procesos inflamatorios mediados por los linfocitos T. Desde hace años, NFAT5 es conocida por su papel activando los mecanismos de defensa celular en situaciones de estrés hiperosmótico, es decir, cuando la concentración salina de los tejidos aumenta. El presente estudio, que se publica en la revista 'Immunology & Cell Biology', revela que NFAT5 puede también atenuar respuestas inflamatorias patogénicas en linfocitos T independientemente de su función de respuesta a estrés. El trabajo, liderado por José Aramburu y Cristina López-Rodríguez, jefes del grupo de investigación en Proteínas NFAT5 y Respuesta Inmunitaria, ha sido desarrollado por las estudiantes de doctorado en Biomedicina del DCEXS María Alberdi y Sonia Tejedor en colaboración con el grupo de Ramón Merino (Universidad de Cantabria).
NFAT5 es una proteína fundamental para la adaptación de las células de mamífero en condiciones de elevada salinidad, como las que se dan en el interior del riñón. A pesar de pertenecer a la misma familia de proteínas que los factores NFATc y NF-κB, bien conocidos por su papel clave en funciones inmunológicas, la función de NFAT5 en el sistema inmunitario se ha mantenido mucho menos conocida. Los estudios con modelos de ratones deficientes en NFAT5 desarrollados anteriormente por López-Rodríguez han descubierto que, además de la función osmoprotectora, NFAT5 regula el desarrollo embrionario y no sólo influye en diversas funciones inmunológicas en situaciones de estrés salino, sino que también controla los umbrales de respuesta a patógenos y el desarrollo de los linfocitos T.
Los linfocitos T constituyen un tipo celular fundamental encargado de mantener el equilibrio entre la capacidad del organismo para combatir infecciones y tumores a la vez que evita respuestas excesivas que den lugar a alteraciones autoinmunes. El actual trabajo publicado en 'Immunology & Cell Biology' muestra cómo NFAT5 puede activar diferentes tipos de genes en linfocitos T en función del contexto de estrés o la presencia de estímulos inflamatorios y daño tisular y, por tanto, confiere elasticidad al sistema inmunitario para permitirle orientar el tipo de respuesta linfocitaria hacia diferentes direcciones.
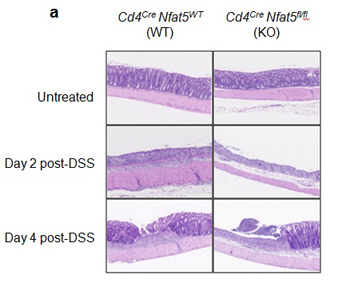
Histología de muestras de colon de ratones en condiciones basales o diversos días después de ser tratados con el agente inductor de colitis DSS (inflamatorio). Las preparaciones corresponden a ratones normales (WT) o ratones mutantes que no tenían NFAT5 en linfocitos T (KO)
Fuente: UPF
Actualmente se desconoce la implicación de NFAT5 en las enfermedades inmunológicas en humanos. Sin embargo, una investigación reciente llevada a cabo por el grupo John Chang en la Universidad de San Diego California, en el que colaboraron López-Rodríguez y Aramburu, identificó el primer paciente humano con una deficiencia parcial en NFAT5. Este paciente fue diagnosticado con diversas alteraciones inmunológicas, algunas de ellas similares a la patología observada en el modelo de ratón deficiente en NFAT5 del trabajo descrito. La investigación llevada a cabo por los investigadores de la UPF, que identifica la capacidad de NFAT5 para modular la intensidad de respuestas inmunitarias y distinguir situaciones de estrés de otros contextos inflamatorios, ilustra cómo el sistema inmunitario es capaz de percibir e integrar con precisión múltiples fuentes de información para mantener el funcionamiento del organismo ante una amplia diversidad de perturbaciones del entorno.




