Redacción Farmacosalud.com
La compañía Roche ha anunciado los resultados positivos del estudio de referencia fase III IMpower150 de Tecentriq® (Atezolizumab) y Avastin® (Bevacizumab) más quimioterapia (paclitaxel y carboplatino) en pacientes con cáncer de pulmón no microcítico (CPNM) avanzado que no han sido tratados previamente. El estudio ha mostrado que en los pacientes que recibieron esta combinación se redujeron en un 38% el riesgo de empeoramiento de la enfermedad o muerte (Supervivencia Libre de Progresión, SLP) en comparación con Avastin® más quimioterapia (Hazard Ratio [HR] = 0,62; p <0,0001; IC del 95%: 0,52-0,74; media de SLP = 8.3 vs. 6.8 meses). Es importante destacar que se observó una duplicación de la tasa establecida de SLP de 12 meses con la combinación de Tecentriq® y Avastin® más quimioterapia (37%) en comparación con Avastin® más quimioterapia (18%).
La tasa de reducción del tumor (tasa de respuesta global, TRG), un objetivo secundario del estudio, fue mayor en los pacientes tratados con Tecentriq® y Avastin® más quimioterapia en comparación con Avastin® más quimioterapia (64% frente a 48%). El perfil de seguridad de la combinación de Tecentriq® y Avastin® más quimioterapia coincide con el ya observado en estudios previos con ambos fármacos por separado, y no se identificaron nuevos eventos con dicha combinación. Estos resultados se han presentado este mes de diciembre en el Congreso de Inmuno-Oncología de la Sociedad Española de Oncología Médica (ESMO).

Fuente: Roche Farma / Planner Media
El análisis del objetivo coprincipal de SLP en el estudio IMpower150 se evaluó en dos grupos de pacientes: todos los pacientes randomizados sin una mutación genética ALK o EGFR (wild-type con intención de tratar, WT-ITT) y en un subgrupo de pacientes que tenían un biomarcador específico (firma de expresión genética T-efector "Teff", WT-Teff). El estudio alcanzó su objetivo coprincipal de SLP por protocolo de estudio para los dos grupos de pacientes evaluados. En el grupo WT-Teff la combinación de Tecentriq® y Avastin® más quimioterapia redujo el riesgo de empeoramiento de la enfermedad o muerte en un 49% en comparación con Avastin® más quimioterapia (HR = 0,51; p <0,0001 IC 95%: 0.38-0.68; media de SLP = 11.3 vs 6.8 meses). Aunque los resultados preliminares del objetivo coprincipal de supervivencia global (SG) son alentadores, aún no son definitivos. El próximo análisis de supervivencia está previsto para la primera mitad de 2018.
Acerca del estudio IMpower150
IMpower150 es un estudio fase III, abierto, multicéntrico, randomizado y controlado que evalúa la eficacia y seguridad de Tecentriq® (Atezolizumab) en combinación con quimioterapia (carboplatino y paclitaxel), con o sin Avastin® (Bevacizumab), en pacientes con CPNM no escamoso en estadio IV o recurrente metastásico que no habían sido tratados con quimioterapia para su enfermedad avanzada. Se incluyeron 1.202 pacientes de los cuales aquellos con mutaciones ALK y EGFR fueron excluidas del análisis principal con intención de tratar (IT). Los pacientes recibieron aleatoriamente (1: 1: 1):
• Tecentriq® más carboplatino y paclitaxel (Brazo A), o
• Tecentriq® y Avastin® más carboplatino y paclitaxel (Brazo B), o
• Avastin® más carboplatino y paclitaxel (Brazo C, brazo de control).
Durante la fase del tratamiento de inducción, los pacientes del brazo A recibieron Tecentriq® (Atezolizumab) administrado por vía intravenosa (1200 mg) en combinación con infusión intravenosa de carboplatino y paclitaxel en el día 1 de un ciclo de tratamiento de tres semanas durante 4 ó 6 ciclos. Después de la fase de inducción, los pacientes recibieron terapia de mantenimiento con Tecentriq® (Atezolizumab) (1200 mg cada tres semanas) hasta pérdida de beneficio clínico o progresión de enfermedad. Debido a la jerarquía de pruebas estadísticas pre-especificadas, el brazo A frente al brazo C aún no se ha probado oficialmente. El estudio IMpower150 fue diseñado para comparar oficialmente Tecentriq® más quimioterapia (brazo A) frente a Avastin® más quimioterapia (brazo C), solo si se demuestra que Tecentriq® y Avastin® más quimioterapia (brazo B) mejoran la SG en la población WT-ITT en comparación con Avastin® más quimioterapia (brazo C). Se espera que los resultados de SG estén en la primera mitad de 2018.
Los pacientes del brazo B recibieron tratamiento de inducción con Tecentriq® (1200 mg) y Avastin® administrado por vía intravenosa (15 mg/kg) en combinación con infusión intravenosa de carboplatino y paclitaxel en el día 1 de un ciclo de tratamiento de tres semanas durante 4 ó 6 ciclos. Después, los pacientes recibieron terapia de mantenimiento con Tecentriq® y Avastin® hasta progresión de la enfermedad (Avastin®) o pérdida de beneficio clínico/progresión de la enfermedad (Tecentriq®). En el brazo C, los pacientes recibieron tratamiento de inducción con Avastin® administrado por vía intravenosa (15 mg/kg) más infusión intravenosa de carboplatino y paclitaxel en el día 1 de un ciclo de tratamiento de tres semanas durante 4 ó 6 ciclos. Esto fue seguido por terapia de mantenimiento con Avastin® en monoterapia hasta progresión de la enfermedad. Los objetivos co-principales fueron la SLP, según lo determinado por el investigador que utilizó los Criterios de Evaluación de Respuesta en Tumores Sólidos Versión 1.1 (RECIST v1.1), y SG. A continuación, se incluye un resumen de los resultados de SLP y TRG en los brazos B vs C; datos adicionales, incluyendo resultados preliminares de SG y de SLP del brazo A vs brazo C.
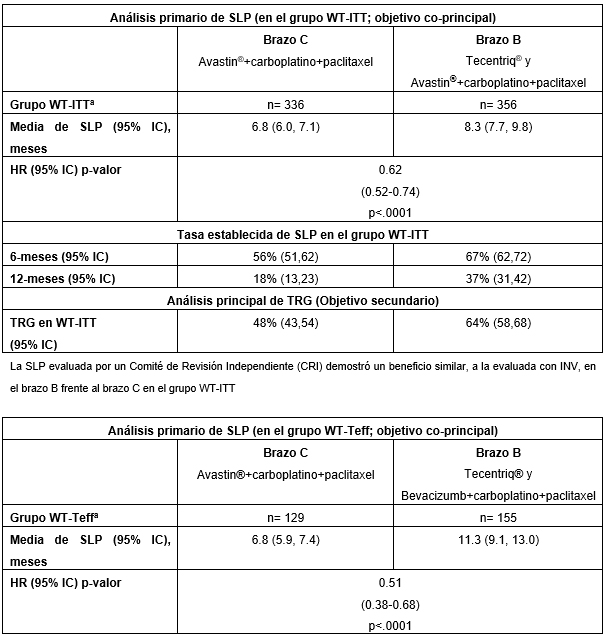
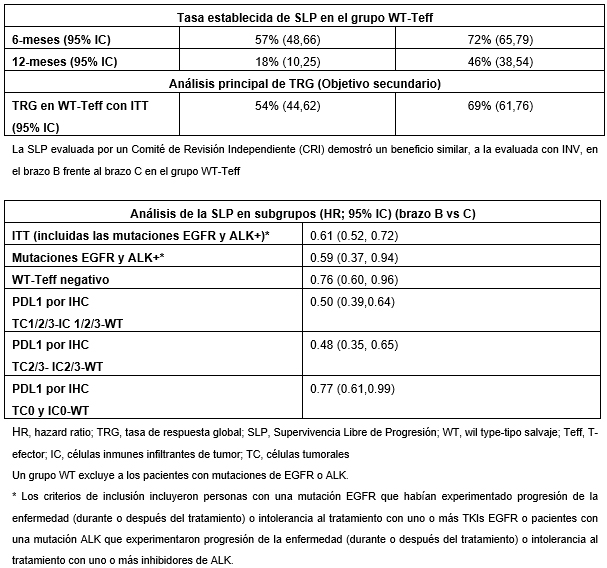
Fuente: Roche / Planner Media
El perfil de seguridad de la combinación de Tecentriq® y Avastin® más quimioterapia coincide con el ya observado en estudios previos con ambos fármacos por separado, y no se identificaron nuevos eventos con dicha combinación. Los efectos adversos graves relativos al tratamiento se observaron en el 25.4% de los pacientes que recibieron Tecentriq® y Avastin® más quimioterapia comparado al 19.3% en el grupo que recibió Avastin® más quimioterapia.
A pesar de los recientes avances en el tratamiento del CPNM, aún existe la necesidad de contar con nuevas opciones de tratamiento. El cáncer de pulmón es la principal causa de muerte por cáncer en todo el mundo[1]. Una enfermedad que provoca más de un millón y medio de fallecimientos al año. Esto supone más de 4.350 muertes diarias[2]. El cáncer de pulmón se clasifica básicamente en dos tipos: el microcítico o de célula pequeña y el no microcítico. Este segundo es el más común y representa el 85% de todos los casos[2].
Acerca de Tecentriq® (Atezolizumab)
Tecentriq® es un anticuerpo monoclonal en investigación concebido para unirse a una proteína denominada PD-L1. Se ha diseñado para unirse directamente al PD-L1 que se expresa en las células tumorales y en los linfocitos infiltrantes de tumores y bloquear su interacción con los receptores PD-1 y B7.1. Al inhibir el PD-L1, Tecentriq® permite la activación de los linfocitos T. Este anticuerpo monoclonal tiene el potencial de ser utilizado en combinación con inmunoterapias frente al cáncer, terapias dirigidas y diversas quimioterapias en una amplia gama de tumores. Actualmente, Roche tiene en marcha ocho estudios fase III en cáncer de pulmón, evaluando Tecentriq® solo en combinación con otros medicamentos.
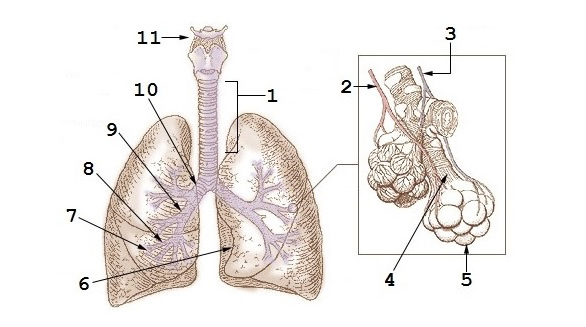
1:Tráquea 2:Arteria pulmonar 3:Vena pulmonar 4:Bronquiolo terminal 5:Alvéolos 6:Corte cardíaco 7:Bronquios terciarios o segmentados 8:Bronquios secundarios o lobales 9:Bronquio principal 10:Bifurcación traquial o carina 11:Laringe
Autor/a: An officer or employee of the United States Government, as described at File:Illu bronchi lungs.jpg, with modifications by User:Adrian J. Hunter - Based on File:Illu bronchi lungs.jpg which is public domain as described at that file's description page. Este archivo deriva de: Illu bronchi lungs.jpg The original PD image is modified by replacing the text labels with numerical labels, using the same numbering scheme as File:Diagrama de los pulmones.svg.
Fuente: Wikipedia
Tecentriq® ya está aprobado en Europa, Estados Unidos y más de 50 países para pacientes con CPNM metastásico previamente tratados y para pacientes con cáncer urotelial localmente avanzado o metastásico que no son candidatos a recibir quimioterapia con cisplatino, o cuya enfermedad ha progresado durante o tras recibir terapia con platinos.
Acerca de la combinación de atezolizumab y bevacizumab
Existe una sólida base científica que avala el uso de la combinación de Tecentriq® más Avastin®. Dicha combinación puede mejorar la capacidad del sistema inmune para combatir una amplia gama de tumores, incluyendo el tratamiento de primera línea en CPNM avanzado. En el caso de Avastin®, además de su acción antiangiogénica ya establecida, puede mejorar aún más la capacidad de Tecentriq® para restablecer la inmunidad contra el cáncer, inhibiendo la inmunosupresión relacionada con VEGF, promoviendo la infiltración tumoral de células T y activando las respuestas de células T frente a antígenos tumorales.
Referencias
1. Ferlay J et al. GLOBOCAN 2012 v1.0, Cancer Incidence and Mortality Worldwide. IARC CancerBase No. 11 [Internet]. Lyon France: International Agency for Research on Cancer; 2013. Available from: http://globocan.iarc.fr/Pages/fact_sheets_cancer.aspx . Accessed October 2017.
2. Barzi A, Pennell NA. Targeting angiogenesis in non-small cell lung cancer: agents in practice and clinical development. European J Clin Med Oncol 2010; 2(1):31–42.




