Redacción Farmacosalud.com
La compañía Roche ha presentado resultados prometedores del estudio fase II IMmotion150 que compara la inmunoterapia Atezolizumab más Avastin® (Bevacizumab) y Atezolizumab en monoterapia frente a sunitinib solo en pacientes con cáncer de células renales -un tipo de tumor de riñón- localmente avanzado o metastásico que no han sido tratados previamente. Los datos se han dado a conocer en el Simposio de Tumores Genitourinarios celebrado recientemente en Florida (Estados Unidos). El estudio fue diseñado para informar del desarrollo clínico adicional de esta combinación y sus resultados refuerzan el potencial de dicha combinación en este contexto.
El estudio ha mostrado que los pacientes con expresión del PD-L1 (ligando 1 de muerte celular programada) que fueron tratados con Atezolizumab más Avastin® alcanzaron una reducción del riesgo de progresión de la enfermedad o fallecimiento de un 36% (Supervivencia Libre de progresión, SLP) frente a los que recibieron sunitinib solo (media de SLP: 14.7 vs. 7.8 meses; HR= 0.64; 95% CI 0.38, 1.08). No se observó una ventaja de la SLP frente a sunitinib en el grupo de pacientes con intención de tratamiento (IT) (media de SLP: 11.7 vs 8.4 meses; HR= 1.00; 95% CI 0.69, 1.45). La mediana de Duración de la Respuesta (DR) no se ha alcanzado aún tras 20.7 meses de seguimiento en los brazos de tratamiento del estudio. Los efectos secundarios con Atezolizumab más Avastin® fueron similares a los ya observados en estudios previos con cada uno de los medicamentos.
La investigación, centrada en el tipo más común de tumor renal
El carcinoma de células renales es el tipo más común de cáncer de riñón y se produce cuando se desarrollan células anormales en los pequeños tubos (conocidos como túbulos renales) en los riñones. Cada año, alrededor de 338.000 personas en todo el mundo son diagnosticadas de cáncer de riñón, causando cerca de 145.000 fallecimientos[1]. Se trata de un tumor más frecuente en varones y en personas de 55 a 74 años de edad[2]. Actualmente existe una importante necesidad de contar con tratamientos más eficaces, teniendo en cuenta que solo cerca de uno de cada diez pacientes viven más de cinco años después del diagnóstico[2].

Fuente: Roche Farma / Planner Media
Atezolizumab es un anticuerpo monoclonal diseñado para actuar fijándose a una proteína llamada PD-L1 (ligando 1 de la proteína 1 de muerte celular programada), que se expresa en las células tumorales y en los linfocitos infiltrantes de tumores. PD-L1 interactúa con PD-1 y B7.1, dos proteínas de la superficie de los linfocitos T, causando la inhibición de estos. Al bloquear dicha interacción, Atezolizumab permite la activación de los linfocitos T, que recuperan así su capacidad de detectar y atacar eficazmente las células tumorales.
Roche también está evaluando la combinación de Atezolizumab más Avastin® frente a sunitinib en el estudio fase III (IMmotion151; NCT02420821) en pacientes que no han recibido tratamiento previo con carcinoma de células renales localmente avanzado o metastásico. Asimismo, a principios de año se puso en marcha un estudio con Atezolizumab como terapia adyuvante (después de la cirugía) en cáncer de células renales.
Acerca del estudio IMmotion150
IMmotion150 es un estudio internacional fase II, multicéntrico, abierto, randomizado que fue diseñado para evaluar la eficacia y seguridad de Atezolizumab en combinación con Avastin® (brazo A), Atezolizumab solo (brazo B) o sunitinib solo (brazo C) en 305 pacientes con cáncer de células renales localmente avanzado o metastásico que no han sido tratados previamente. Los pacientes del brazo A recibieron una administración intravenosa de 1200 mg de Atezolizumab cada 3 semanas (ciclos de 6 semanas) más 15 mg/kg de Avastin® por vía intravenosa hasta progresión de la enfermedad o falta de beneficio clínico. Los pacientes del brazo B recibieron Atezolizumab solo (hasta progresión de la enfermedad o falta de beneficio clínico), y los del brazo C recibieron 50 mg de sunitinib por vía oral diariamente durante 4 semanas, seguido de 2 semanas de descanso hasta progresión de la enfermedad.
Los objetivos primarios fueron evaluar la SLP según los criterios RECIST v.1.1 por un Centro de Evaluación Independiente (CEI) en todos los pacientes randomizados (intención de tratamiento) y en el subgrupo con expresión de PD-L1 (IC1/2/3). La expresión de PD-L1 en las células inmunitarias infiltrantes del tumor fue evaluada mediante una prueba inmunohistoquímica (IHC) de investigación basada en el anticuerpo SP142 desarrollada por Roche Tissue Diagnostics. Los objetivos secundarios incluyeron, según CEI, la tasa de respuesta completa (TRC) y la duración de la respuesta (DR), y, según el investigador, la SLP, la TRC, la DR, la seguridad, y la supervivencia global (SG). A continuación se incluye un resumen de los datos de eficacia de los brazos A, B y C del estudio IMmotion150.
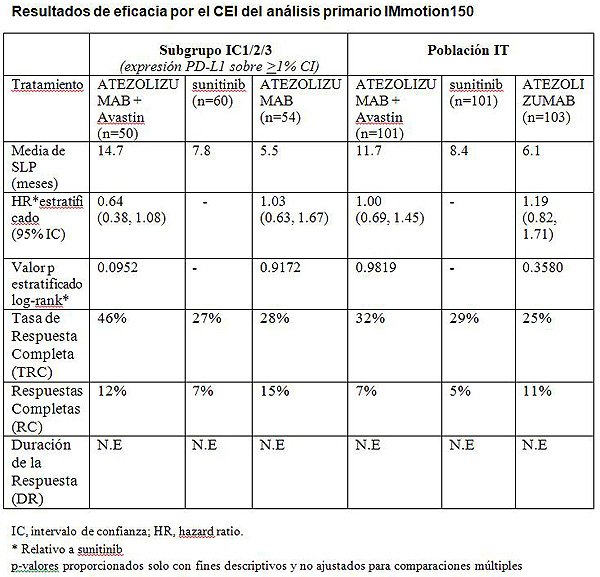
El estudio IMmotion150 es un ensayo clínico que permite cruzamiento. Más de las tres cuartas partes (78%) de los pacientes en los que la enfermedad progresó tras recibir sunitinib (Brazo C), cambiaron seguidamente a Atezolizumab más Avastin® (Brazo A). En el momento del análisis, los datos de SG no estaban maduros con información de solo un 35% de los eventos.
El perfil de seguridad en el brazo tratado con Atezolizumab más Avastin® fue consistente con el que ya se conocía de estos medicamentos por separado. No se identificaron nuevos signos de seguridad. La frecuencia de todos los efectos adversos relacionados con el tratamiento fue similar en todos los brazos. El efecto secundario más común se produjo en el 20% de los pacientes que recibieron Atezolizumab más Avastin® y con un incremento superior al 5% cuando se comparó a sunitinib incluido: artralgia (38%), proteinuria (36%), epistaxis (28%) y prurito (22%). Los efectos secundarios más frecuentes de grado 3-4 relacionados con el tratamiento fueron similares entre los pacientes tratados con Atezolizumab más Avastin® (63%) y sunitinib (69%). Los eventos de grado 3-4 relacionados con el tratamiento se produjeron en el 40% de los pacientes que habían recibido Atezolizumab más Avastin® y en el 57% de los que recibieron sunitinib. Uno de los pacientes que fue tratado con Atezolizumab más Avastin® experimentó una hemorragia intracraneal, que causó el fallecimiento. 15 de los 101 pacientes (15%) tratados con Atezolizumab más Avastin® tuvieron que suspender el tratamiento a causa de los eventos adversos.
Referencias
1. World Health Organization. GLOBOCAN 2012: Estimated cancer incidence, mortality and prevalence worldwide. Available at: http://globocan.iarc.fr/Pages/fact_sheets_population.aspx Last accessed January 2017.
2. SEER. Stat Fact Sheets: Kidney and Renal Pelvis Cancer. Available at: https://seer.cancer.gov/statfacts/html/kidrp.html Last accessed January 2017.




