Redacción Farmacosalud.com
En el VI Congreso GeSIDA ya se puso un primer acento en la problemática que envuelve a las personas coinfectadas por VIH (virus causante del sida) y el virus de la hepatitis C (VHC), como es el hecho de que algunos de esos pacientes, en concreto los diagnosticados más allá de los 50 años de edad, tengan un mayor riesgo de muerte que el resto de este tipo de enfermos. A la hora de administrar tratamientos, la cosa no acaba aquí: “un problema de esta coinfección son las interacciones entre los antirretrovirales y los fármacos anti-VHC. Estas interacciones son muy variables en función de los diferentes fármacos a utilizar”, revela el doctor Esteve Ribera, médico adjunto del Servicio de Enfermedades Infecciosas del Hospital Universitario Vall d’Hebron (Barcelona) e investigador del Vall d’Hebron Institut de Recerca (VHIR).
En esta entrevista, Ribera realiza un exhaustivo ejercicio de actualización sobre el abordaje terapéutico contra el VIH, y en este sentido comenta que la mayoría de guías de los tratamientos antirerretrovirales (TAR) “aconsejan recomendar el inicio del TAR a todos los pacientes, independientemente de su cifra de linfocitos CD4 y su carga viral”. Por lo que respecta a los casos -muy puntuales- de personas que han logrado borrar el VIH de su organismo, el experto prefiere lanzar un aviso de prudencia porque “en la mayoría de casos el virus acaba replicando de nuevo”. “Hoy por hoy la infección por el VIH es incurable. Es muy controlable con el tratamiento, pero la erradicación del virus no es posible y si se suspende el tratamiento el virus vuelve a multiplicarse incontroladamente”, agrega.
Autor/a: Scott Bauer
Fuente: www.public-domain-image.com
-¿Cuál es el papel de la biterapia y el presente y futuro de los llamados LDRs (Less Drugs Regimens)?
Desde el inicio del llamado tratamiento antirretroviral (TAR) de gran eficacia o de gran actividad (TARGE, TARGA, en ingles HAART) en 1996, el tratamiento estándar consiste en la combinación de 3 fármacos: 2 análogos de nucleós(t)idos y un tercer fármaco. Los fármacos entonces disponibles eran relativamente poco potentes. Además, tenían unas características farmacocinéticas desfavorables y una barrera genética baja. Dos fármacos no eran suficientes para proporcionar una eficacia adecuada.
La aparición de los nuevos inhibidores de la proteasa potenciados (IP/r) cambió las perspectivas terapéuticas. Se pensó lo impensable hasta entonces y se pusieron en marcha una serie de estudios basados en el tratamiento con un solo fármaco: la monoterapia con IP/r. Tuvieron un notable éxito en pacientes en los que, con un tratamiento estándar, se había logrado la supresión virológica. La eficacia es algo inferior a la del tratamiento estándar, pero las viremias se controlan fácilmente si se reintroducen los fármacos que se suspendieron. Existen todavía una serie de incertidumbres que los últimos estudios disponibles no han solucionado y que hacen que la monoterapia con IP/r se esté abandonando, aunque sigue teniendo sus defensores.
En los últimos años se están realizando numerosos estudios bien diseñados para valorar el papel de diversos tratamientos con 2 fármacos (biterapias), uno de los cuales es habitualmente un IP/r, con diferentes posibilidades del segundo fármaco. Las biterapias sin análogos de nucleósidos han sido muy estudiadas como estrategia para reducir toxicidad y cambiar el paradigma del TAR. Prácticamente todos los estudios han demostrado que esta estrategia ofrece más problemas que ventajas en pacientes que inician su primer tratamiento (naïve), con menor eficacia y/o más resistencias que el tratamiento triple, especialmente en pacientes con cargas virales elevadas y CD4 bajos. Nuevos regímenes en estudio ofrecen nuevas perspectivas y también estamos pendientes de conocer sus posibilidades en pacientes que ya han conseguido tener una carga viral indetectable con un tratamiento estándar.
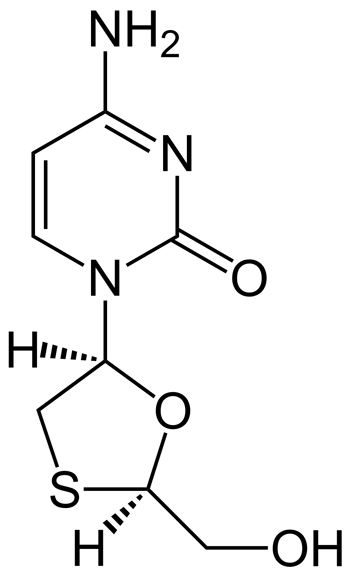
Fórmula estructural de lamivudina
Autor/a de la imagen: Jü
Fuente: Wikipedia
Enormemente interesantes han sido los resultados de biterapia con un IP/r y lamivudina. Concretamente tenemos datos de las combinaciones con lamivudina de atazanavir/r y de lopinavir/r en 4 estudios aleatorizados (1 en naïve y 3 en pacientes ya indetectables con el TAR previo). En los 4 estudios se demuestra que la eficacia de la biterapia es igual a la de la terapia triple (no inferioridad), sin que con la biterapia se produzcan más fallos virológicos, ni aparezcan más resistencias que con la terapia triple, evitándose la toxicidad de ciertos análogos de nucleós(t)idos. Lamivudina en un análogo de nucleósidos con una excelente tolerabilidad, que se administra una vez al día y que ya está disponible como fármaco genérico. Parece aportar al tratamiento lo que le faltaba a la monoterapia, siendo una opción con excelentes perspectivas terapéuticas.
Otra posibilidad de reducir el número de fármacos es la utilización de IP no potenciados. Atazanavir es el único IP que nos permite administrarlo sin potenciar. Es una estrategia para reducir toxicidad en paciente con carga viral suprimida que ha demostrado su eficacia y seguridad en estudios aleatorizados y en cohortes (‘vida real’). No se producen más fallos virológicos ni se desarrollan más resistencias que con IP/r.
El tratamiento de la infección por VIH es de por vida y es muy importante disponer de diferentes opciones terapéuticas que nos permitan adaptarlo a las necesidades de cada paciente, maximizando la eficacia y minimizando los riesgos.
-¿Existe consenso de cuándo hay que iniciar un tratamiento antirretroviral?
El momento óptimo de iniciar el tratamiento antirretroviral (TAR) ha cambiado considerablemente con el tiempo en función de los fármacos disponibles. Los fármacos de los primeros tratamientos eficaces eran muy tóxicos e incómodos de administrar, resultando casi imposible la adecuada adherencia a largo plazo. Los beneficios sólo eran evidentes cuando se iniciaba TAR con una cifra baja de linfocitos CD4 (<200/mm3). Afortunadamente los TAR han mejorado enormemente y ahora tenemos combinaciones de TAR muy eficaces, muy bien toleradas y muy cómodas de administrar y adaptables a la situación de la mayoría de pacientes. En este contexto se ha observado que la máxima eficacia a largo plazo -aproximándose la esperanza de vida de los pacientes con infección por VIH a la de la población general- sólo se consigue cuando el TAR se inicia muy tempranamente, con inmunidad preservada.
Cada vez es más unánime el consenso sobre la necesidad de iniciar TAR en todos los pacientes con infección por el VIH que estén preparados para ello. La mayoría de guías de TAR en el mundo occidental, entre ellas las españolas (GESIDA/PNS), aconsejan recomendar el inicio del TAR a todos los pacientes, independientemente de su cifra de linfocitos CD4 y su carga viral.
Representación del virus de la hepatitis C
Autor/a de la imagen: PhD Dre at en.wikipedia
Fuente: Wikipedia / LobStoR
-Hay pacientes con comorbilidades. Pacientes con VIH y que además tienen tuberculosis o una hepatitis crónica. ¿Qué estrategia debe instaurarse en estos casos?
Las comorbilidades complican el tratamiento, dado que se asocian numerosos fármacos (para la comorbilidad para el VIH), con más toxicidades y más dificultades para el correcto cumplimiento de los tratamientos.
Para la mayoría de enfermedades oportunistas (ej. neumonía por P. jirovecii, candidiasis, etc, etc.) que pueden presentar los pacientes con un mal control o un desconocimiento previo de la infección por el VIH, debe iniciarse al tratamiento de la enfermedad oportunista, ver que se tolera correctamente dicho tratamiento y ver que la situación clínica permite iniciar el TAR, evitando las incompatibilidades, interacciones farmacocinéticas relevantes y también demoras excesivas.
La tuberculosis y la hepatitis C son dos coinfecciones particulares. El tratamiento de la tuberculosis está muy estandarizado y ello proporciona una eficacia terapéutica elevadísima. Se trata de una estrategia de inducción-mantenimiento, con una primera fase de 2 meses con 3-4 fármacos, seguida de 4 o más meses de biterapia con rifampicina e isoniacida. En los pacientes con infección por VIH se recomienda el tratamiento estándar de la tuberculosis. A menos que la inmunodepresión sea muy grave, el TAR suele iniciarse al finalizar el tratamiento de inducción de la tuberculosis (2 meses). La rifampicina es un potente inductor enzimático de diferentes sistemas metabólicos del organismo, de manera que disminuyen mucho las concentraciones plasmáticas de diferentes fármacos. El TAR de elección en esta situación es la combinación de efavirenz/tenofovir/emtricitabina en una pastilla única, que facilita el tratamiento y se administra a dosis estándar. Si no puede utilizarse efavirenz, se recomienda una pauta con raltegravir que generalmente también puede administrarse a dosis estándar. Otras pautas ya son más complejas y deben individualizarse cuidadosamente. En algunos casos es preciso no administrar rifampicina y el tratamiento se complica considerablemente.
La hepatitis C es también muy peculiar. Actualmente están siendo comercializados y son progresivamente disponibles muchos fármacos de acción directa frente al virus de la hepatitis C (VHC), con combinaciones extraordinariamente eficaces para curar la infección en casi todos los casos, tanto en pacientes monoinfectados, como en coinfectados VHC-VIH. Con estos nuevos fármacos la duración del tratamiento es bastante menor que con los anteriores. Un problema de esta coinfección son las interacciones entre los antirretrovirales y los fármacos anti-VHC. Estas interacciones son muy variables en función de los diferentes fármacos a utilizar. De los antirretrovirales, los que más interacciones presentan son los IP/r. Los que menos problemas dan son los inhibidores de la integrasa raltegravir y dolutegravir asociados a análogos de nucleósidos. Los no análogos de nucleósidos de segunda generación (rilpivirina y etravirina) tienen muchas menos interacciones que los de primera generación (efavirenz y nevirapina). De los fármacos anti-VHC, las mayores interacciones las presentan los inhibidores de la proteasa del VHC, siendo menos problemáticos otros grupos terapéuticos. Siempre es preciso individualizar cuidadosamente los tratamientos de ambas infecciones en función de las posibilidades terapéuticas de las mismas, eligiendo fármacos que puedan asociarse sin problemas de interacciones relevantes durante el tiempo en que coexistan ambos tratamientos.
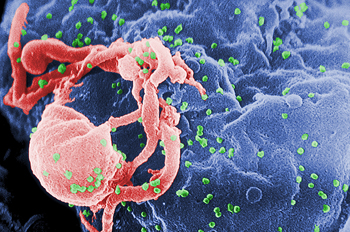
Viriones de VIH-1 (en verde) ensamblándose en la superficie de un linfocito
Autor/a de la imagen: C. Goldsmith Content Providers: CDC/ C. Goldsmith, P. Feorino, E. L. Palmer, W. R. McManus
Fuente: Cargado por Optigan13 / Wikipedia
-Dos hombres infectados con el virus del sida (VIH) -uno de ellos durante 30 años- se habrían curado de manera espontánea mediante la integración del retrovirus degradado y neutralizado en su ADN. ¿Cómo se explican estos casos?
Hoy por hoy la infección por el VIH es incurable. Es muy controlable con el tratamiento, per la erradicación del virus no es posible y si se suspende el tratamiento el virus vuelve a multiplicarse incontroladamente. Se está hablando mucho de algunas situaciones aisladas como los de la pregunta, pero en la mayoría de casos el virus acaba replicando de nuevo. El caso más conocido es el llamado paciente Berlín. Se realizó un trasplante de médula ósea por una leucemia y las células que se le inyectaron tenían una característica muy peculiar. Carecían del receptor fisiológico CCR5 (alterado por la delección genómica delta32) que utiliza el tipo de VIH (R5) que tenía el paciente. El paciente superó su enfermedad, la quimioterapia intensiva a la que fue sometido eliminó muchas células portadoras de virus, las del donante no se infectaron y se erradicó el VIH. Esto no ha podido reproducirse en otros pacientes, aunque se está trabajando en un banco de cordones umbilicales con la delección delta 32, con posibilidad de utilizarlos en pacientes determinados, pacientes con infección por VIH que requieran trasplante de células. Otros posibles casos ofrecen todavía muchísimas dudas y por el momento deben considerarse utópicos.
-En una fase consolidada de control de la enfermedad, ¿cuál sería su mensaje a clínicos y pacientes?
La gran mayoría de pacientes que visitamos en nuestras consultas se encuentran en esta fase, con una situación virológica (carga viral indetectable) e inmunológica controladas. En este escenario clínico, numerosas pautas de tratamiento han demostrado su eficacia y seguridad. El mensaje es que este tratamiento debe durar indefinidamente y por tanto es importante que pueda adaptarse con relativa facilidad a la vida del paciente y que se tolere bien, evitando incluso algunas toxicidades llamadas ‘de bajo nivel’, que el paciente podría tolerar si no hay más remedio, pero que deberían evitarse para favorecer así la larga durabilidad del TAR y la calidad de vida del paciente. En este sentido, es fundamental la relación médico-enfermo para conocer perfectamente la situación y las preferencias individuales de cada paciente y adecuar el tratamiento en función de ello.




