Dr. José Ignacio Prieto Romo / Redacción Farmacosalud.com
El síndrome de apneas-hipopneas del sueño (SAHS) consiste en la aparición de episodios recurrentes de limitación del paso del aire durante el sueño como consecuencia de una alteración anatómico-funcional de la vía aérea superior (VAS) que conduce a su colapso, provocando descensos de la saturación de oxihemoglobina (SaO2) y microdespertares que dan lugar a un sueño no reparador, somnolencia diurna excesiva, y trastornos neuropsiquiátricos, respiratorios y cardíacos[1].
El SAHS es una enfermedad muy frecuente que afecta al 4-6% de los hombres y al 2-4% de las mujeres en las edades medias de la vida, aumentando la prevalencia claramente con la edad (sobre todo en las mujeres postmenopáusicas). De igual forma, el SAHS también se manifiesta en edad infantil (en este caso afecta por igual a ambos sexos), con una incidencia de entre el 1-3% de los niños, asociándose sobre todo a hipertrofia adenoamigdalar o presencia de vegetaciones (facies adenoidea), y no tanto por el tamaño de dicha hipertrofia, sino por la relación de este tamaño con el de la vía aérea superior (VAS). La obesidad, tanto en edad infantil como en el paciente adulto, es, también, un factor de riesgo muy importante para padecer SAHS (el 60-90% de los pacientes de SAHS son obesos), así como el cuello ancho y corto (distancia hiodes-mandíbula menor de 4 cms), y factores genéticos (tiene componente hereditario y agregación familiar), así como las dismorfias o alteraciones anatómicas cráneo-faciales (justifica su mayor incidencia en pacientes con Síndrome de Down, acromegalia, etc) y otorrinolaringológicas (ORL).

Dr. José Ignacio Prieto Romo
Fuente: Dr. Prieto Romo / SEMERGEN
Elevado infradiagnóstico
“Son, igualmente, factores de riesgo para padecer SAHS el consumo de tabaco, alcohol y los fármacos depresores del Sistema Nervioso Central (SNC), especialmente en horas vespertinas o antes de irse a dormir, así como la posición en decúbito supino, mientras se duerme. Por todo ello, el ‘morfotipo típico’ de un paciente con SAHS sería un varón (aunque se iguala con la mujer en la postmenopausia), de mediana edad (mayor de 40 años), obesidad central (Índice de Masa Corporal mayor del 35%, con aumento de perímetro abdominal) y cuello ancho (mayor de 45 cms)”, especifica el Dr. José Ignacio Prieto Romo, médico de Familia del Centro de Salud de Navalmoral de la Mata (Cáceres), y miembro del Grupo Nacional de Respiratorio de la Sociedad Española de Médicos de Atención Primaria (SEMERGEN), del GRAP (Grupo Nacional de Respiratorio de Atención Primaria) y del IPCRG (International Primary Care Respiratory Group).
Al SAHS también se le conoce popularmente como apnea del sueño. En España existen entre 1.200.000 y 2.150.000 personas con apnea relevante y un elevado infradiagnóstico[2]. A pesar de la alta prevalencia del SAHS, esta afección está infradiagnosticada (más del 75% de los casos) e infratratada (sólo recibe tratamiento el 10% del total de casos susceptibles de recibirlo). De ahí que esta enfermedad constituya “un problema de salud pública de primera magnitud, suponiendo, además, un mayor uso de recursos sanitarios por parte de los pacientes no tratados (por no hablar de gastos indirectos en términos de absentismo laboral), por lo que el papel del Médico de Atención Primaria (MAP) es fundamental en la sospecha del cuadro, la utilización correcta de los criterios de derivación y el control de los pacientes que reciben tratamiento”, argumenta el Dr. Prieto Romo.
Todo ello obliga a los MAP a reconocer bien los síntomas-guía y morbilidades asociadas que pudiesen motivar la generación de una sospecha clínica, así como a conocer los posibles métodos diagnósticos que permitan identificar a los pacientes afectos y, dentro de ellos, saber cuáles serían subsidiarios de recibir tratamiento. “Por eso -prosigue el facultativo-, es muy importante mejorar la formación de los MAP y su actualización a este respecto, y dotarles al mismo tiempo de mayor personal y medios que redunden en un mayor tiempo de atención al paciente, así como poner a su disposición herramientas diagnósticas no hospitalarias como la Poligrafía Respiratoria Domiciliaria (PRD), la Presión Nasal Domiciliaria (PND) o sistemas simplificados de diagnóstico como el Apnea LinK que disminuyan las listas de espera en las Unidades de Sueño (donde se realizan las Polisomnografías -PSG-), además de potenciar la interacción y coordinación entre MAP y Neumología. Si a esto le sumamos la sobrecarga asistencial que tiene actualmente el sistema sanitario, con la masificación de las consultas y, por ende, el poco tiempo que tiene asignado cada médico a la atención individual de cada uno de sus pacientes, se agrava el problema y la persistencia del mismo”.
Colapso total (apnea) o parcial (hipopnea)
Según el médico de Familia del Centro de Salud de Navalmoral de la Mata, no es que haya diferentes subtipos de SAHS, sino que la enfermedad ha cambiado de denominación. Antiguamente se llamaba OSAS (Obstructive Sleep Apnoea Syndrome), que fue descrito por Guilleminault por primera vez en 1976. Hacía sólo referencia a las apneas obstructivas, y de ahí su denominación. Actualmente ha pasado a denominarse SAHS (Síndrome de Apnea-Hipopnea del Sueño) porque tiene en cuenta el colapso total (Apnea) de la Vía Aérea Superior (VAS) o parcial (Hipopnea). Esas disfunciones provocan descensos en la saturación de oxihemoglobina y microdespertares múltiples que dan lugar a un sueño no reparador, que es, a la vez, el causante de una Somnolencia Diurna Excesiva (SDE) y el cansancio que padecen estos pacientes, junto a trastornos neuropsiquiátricos, respiratorios, metabólicos y cardiovasculares.

Autor/a: George Hodan
Fuente: www.publicdomainpictures.net
Estos episodios se miden con el Índice de Alteración Respiratoria (IAR), que se define como el número de Apneas, Hipopneas y Esfuerzos Respiratorios Asociados a Microdespertares (ERAM), por hora de sueño. El espectro de la obstrucción de la Vía Aérea Superior (VAS) depende del calibre de dicha vía. Así, de menor a mayor graduación, según el grado de colapsabilidad de su vía aérea, un individuo puede ser: asintomático (sin SAHS y con VAS normal), o pasar a tener algún síntoma (por disminución del calibre normal de su VAS) debido, por ejemplo, a un SRAVAS (Síndrome de Reactividad Aumentada de la Vía Aérea Superior), y podría ser, todavía, más sintomático si padece ya obstrucciones parciales de la vía respiratoria o Hipopneas, que es la reducción discernible (mayor del 30% y menor del 90%) de la amplitud de la señal respiratoria, de más de 10 segundos de duración, acompañada de desaturaciones de Oxígeno iguales o mayores al 3%, y/o un microdespertar en el Electroencefalograma (EEG).
Por último, si la ausencia o reducción de la señal respiratoria es mayor del 90%, con una duración mayor de 10 segundos, se produciría una obstrucción completa, que es lo que se denomina Apnea, y ello, obviamente, redunda en que el paciente tenga, aún, más síntomas. El SRAVAS no se consideraría todavía SAHS, para lo cual se requiere presencia de Hipopneas y de Apneas. Además, es preciso distinguir entre Apnea obstructiva, que es la ausencia o disminución, mayor del 90%, de la señal respiratoria, mayor de 10 segundos, ‘con esfuerzo respiratorio’ detectado por bandas toracoabdominales, y Apnea central, en la que hay los mismos parámetros, pero ‘sin’ esfuerzo respiratorio, detectado por bandas toracoabdominales.
La Apnea mixta sería aquella que comienza con un componente central y acaba en uno obstructivo. Por último, se habla de Hipopnea cuando se produce una disminución de entre el 30% y el 90% de la amplitud de la señal respiratoria, mayor de 10 segundos de duración, acompañada de una desaturación igual o mayor al 3%, y de ahí el cambio de nomenclatura, más apropiada sobre la antigua, pues engloba a todos estos eventos respiratorios y no sólo los obstructivos.
Una patología comúnmente asociada a EPOC y otras afecciones
“Por otro lado, el SAHS suele asociarse comúnmente a otras patologías, como el Síndrome de Hipoventilación y Obesidad (SHO) o Síndrome de Picwick y también a la Enfermedad Pulmonar Obstructiva Crónica (EPOC). La coexistencia de EPOC y SAHS en el mismo paciente se denomina Síndrome de Overlap, solapamiento o superposición, desde la descripción inicial del gran neumólogo escocés David Flenley, y también se ha denominado OLDOSA (Obstructive Lung Disease and Obstructive Sleep Apnea) cuando la EPOC se asocia con Apnea Obstructiva del Sueño (OSA)”, detalla Prieto Romo. Estos pacientes presentan una hipoxemia mucho más importante que la que se da en EPOC y SAHS por separado, con, también, mayor hipercapnia. Se quejan de una mala calidad del sueño, dificultad para conciliar el mismo, aumento de sintomatología nocturna (tos y disnea) y aparición de síntomas diurnos (SDE, cefalea, astenia), teniendo una rápida tendencia a desarrollar hipertensión pulmonar, y mayor incidencia de fibrilación auricular, agudizaciones y mortalidad.

Ejemplos de CPAP
Autor/a de la imagen: Rachel Tayse
Fuente: Flickr / Creative Commons
Su tratamiento es el propio de ambas entidades (optimización del tratamiento broncodilatador e individualizado de la EPOC junto a las normas higiénico-dietéticas y la Ventilación No Invasiva (VNI) con Presión Positiva de forma Continua -CPAP- del SAHS, que en algunos pacientes puede ser insuficiente para corregir los eventos nocturnos o la hipoxemia, por lo que requerirán VNI en modo BiPAP (con dos niveles) y/o suplementación con oxigenoterapia aplicada a la mascarilla nasal, si fuese preciso. “No es necesario decir que al infradiagnóstico del SAHS se le suma el de la propia EPOC, por lo que ambas enfermedades están infradiagnosticadas y, por consiguiente, infratratadas”, sostiene el miembro del Grupo Nacional de Respiratorio de SEMERGEN.
Entre los factores de riesgo para padecer SAHS, destacan:
• Edad mayor de 40 años: la prevalencia aumenta con la edad, llegando a triplicarse en ancianos.
• El género: mayor incidencia en el varón. La relación hombre / mujer en las edades medias de la vida es de 2 a 1, tendiendo a igualarse a partir de la menopausia.
• La obesidad y distribución de la grasa corporal.
• Consumo de alcohol y tabaco.
• Uso de fármacos como sedantes, hipnóticos y barbitúricos.
• La posición en decúbito supino (favorece el ronquido y la apnea).
• Factores genéticos (hay una predisposición familiar y una mayor incidencia en pacientes con Síndrome de Down)
• Malformaciones faciales y/o alteraciones anatómicas (como poliposis, desviación del tabique nasal, amígdalas hipertróficas, retrognatia, hipertrofia de úvula).
• Alteraciones endocrinas (como Hipotiroidismo, Acromegalia o Postmenopausia).
“En el SAHS infantil, más que SDE (Somnolencia Diurna Excesiva), suele darse lo que se denomina sueño inquieto con cama revuelta. Otra peculiaridad del SAHS infantil es que se asocia a la presencia de vegetaciones (facies adenoidea) e hipertrofia amigdalar y cursa con dificultades en el aprendizaje, con disminución del rendimiento escolar, trastornos de la conducta y retraso en el crecimiento, tanto en estatura como en el aspecto ponderal (afectación exclusiva del SAHS infantil)", señala el Dr. Prieto Romo.

Autor/a: Felix
Fuente: rawpixel.com (free photo)
Anamnesis detallada
Las pausas respiratorias de los pacientes de SAHS son fácilmente identificables por la pareja del paciente, ya que duermen juntos. Por lo tanto, el testimonio de la pareja puede ser muy importante para establecer una sospecha diagnóstica de SAHS. No obstante, ¿qué ocurre cuando el paciente duerme solo... es más difícil llegar a un diagnóstico de sospecha? “Siempre que sea posible, hay que realizar la anamnesis en presencia de la compañera o compañero de dormitorio, para así poder interrogar por los ronquidos y las apneas presenciadas; pero, como en la mayoría de las patologías, la historia clínica es la base del diagnóstico inicial. Conocer los factores de riesgo para el desarrollo del síndrome de apnea-hipopnea del sueño por parte de la población en general y de los profesionales de la salud en particular podría facilitar su detección precoz, favoreciendo con ello la rápida instauración de un tratamiento eficaz”, apunta el experto. Es fundamental una anamnesis detallada donde se recoja:
• La edad (en función de la edad hay un aumento de prevalencia).
• Los antecedentes familiares (los familiares de primer grado tienen mayor riesgo de padecerlo).
• Los antecedentes personales (antecedentes de eventos cardiovasculares, accidentes de tráfico, etc).
• Los hábitos de sueño (horario, siestas, higiene del sueño, posición al dormir). Algunos pacientes sólo tienen SAHS en decúbito supino y, todos, lo agravan con esta posición, por lo que es preferible evitarla (a veces, como remedio casero, se cosían pelotas de tenis u objetos similares en la espalda del pijama del paciente para dificultar la permanencia en esta posición y disminuir los ronquidos).
• El tabaquismo (los fumadores tienen mayor riesgo de desarrollar roncopatía, por fenómenos de irritación e inflamación de VAS).
• Presencia de otras enfermedades asociadas como la EPOC (daría lugar a un Síndrome de Overlap o solapamiento, si coexistiera con el Síndrome de Apnea Hipopnea del Sueño)
• Ingesta de alcohol (su consumo, sobre todo en horario vespertino, precipita y/o agrava un SAHS existente -por la depresión de la actividad de la musculatura dilatadora faríngea-, además de prolongar la duración de las apneas y hacer que las desaturaciones sean más severas)
• Consumo de fármacos (las benzodiacepinas disminuyen la respuesta ventilatoria a la hipoxia y la hipercapnia durante el sueño así como durante la vigilia, por lo que es preferible evitar su empleo en pacientes con SAHS y, sobre todo, antes de ir a dormir).
Autor/a de la imagen: Enric Arandes
Fuente: E. Arandes / www.farmacosalud.com
A la hora de establecer un diagnóstico de sospecha de SAHS, un médico de Atención Primaria “debe interrogar por la presencia de signos y síntomas-guía. No existe ningún síntoma específico o patognomónico del SAHS, pero los tres síntomas-guía (ronquidos, apneas y Somnolencia Diurna Excesiva) son muy sugerentes de padecerlo”, indica el miembro del GRAP y del IPCRG.
• Los Ronquidos se dan casi en el 100% de los pacientes, pero, por ello, habrá que diferenciar entre roncador simple y patológico.
• La Somnolencia Diurna Excesiva (SDE) es la tendencia a dormirse involuntariamente, en situaciones inapropiadas. Suele ser el signo diurno más frecuente e importante por el que se consulta.
• Las Apneas presenciadas son el síntoma más específico y sugestivo de padecer la enfermedad (por ello, es muy importante la presencia de la pareja o compañero/a de habitación en la anamnesis).
Cuestionario STOP-BANG
Otros posibles síntomas sugerentes serían también la nicturia, la cefalea matutina, la hipertensión arterial y la dificultad para concentrarse. En Atención Primaria sería, asimismo, muy importante y factible aplicar el cuestionario STOP-BANG, que está basado en 8 parámetros fáciles de contestar. Se llama así por responder a las iniciales, a modo de acrónimo, respectivamente, de las letras S de Snore (ronquidos), T de Tired (cansancio), O de Observed (apneas observadas), P de Pressure (refiriéndose a Blood Presure o tensión arterial), B de Body Max Index (índice de masa corporal), A de Age (edad), N de Neck circunference (diámetro del cuello) y G de Gender (sexo del paciente). Este cuestionario cuantifica el riesgo de padecer Síndrome de Apnea Obstructiva del Sueño y determina:
-Bajo riesgo de padecerlo si sólo se responde afirmativamente a 0-2 preguntas.
-Riesgo intermedio, si se responde que sí a entre 3 y 4 preguntas.
-Alto riesgo, si la respuesta positiva se da en entre 5 y 8 preguntas.
Exploración física básica

Autor/a: HeavyWeightGeek
Fuente: Flickr / Creative Commons
No es el único test (hay, también, por ejemplo, el Cuestionario de Berlín), pero sí el más eficaz, con una sensibilidad del 93 al 100% y con una especificidad del 43% para clasificar a los pacientes en alto, medio o bajo riesgo de padecer SAHS, y facilitar, así, su posible derivación a atención especializada.
De acuerdo con el Dr. Prieto Romo, ante un paciente con sospecha clínica de SAHS, la exploración física básica debe incluir los siguientes puntos:
• Datos antropométricos: talla, peso e IMC.
-El sobrepeso y la obesidad son el principal factor de riesgo para el desarrollo de SAHS, siendo el perímetro abdominal un importante predictor de la enfermedad, mientras que la pérdida ponderal disminuye la gravedad del SAHS, pudiendo ser, inclusive, curativa en algunos pacientes.
-Perímetro del cuello (un cuello corto y ancho, con diámetro superior a 44,5 o 45 cms, se asocia a SAHS).
• Auscultación cardiopulmonar: el SAHS es frecuente causa de arritmias cardiacas, como la fibrilación auricular o el Síndrome de Braditaquiarritmia (bradicardia en los episodios apneicos, seguida de taquicardia producida por la activación simpática durante los microdespertares, para superarlos).
• Tensión arterial: el SAHS es causa frecuente de HTA de nuevo diagnóstico y/o refractaria al tratamiento.
• Exploración de la Vía Aérea Superior, prestando especial atención a la:
-Calidad de la mordida, lo que permite detectar una mala oclusión dentaria.
-Evaluación de retromicrognatia: se evalúa la arcada mandibular en relación al volumen facial, situando al paciente de perfil.
-Exploración nasal, a ser posible con rinoscopio: valoración de desviación septal, obstrucción nasal e hipertrofia de cornetes.
-Evaluación del paladar blando: utilizando un depresor lingual, se valora el grado de hipertrofia amigdalar (de 0 a 4), el tamaño de la úvula, la implantación del paladar y el volumen global de la lengua. La escala anestésica de Mallampati evalúa en cuatro grados la capacidad de visión que se tiene de la orofaringe (paladar blando, fauces, úvula y pilares amigdalares). Hay que realizarla con una buena iluminación de la cavidad oral, en máxima apertura de ésta y con el paciente sentado, sin fonar. Así, se puede clasificar en:
§ Grado I: Visualización directa de paladar blando, fauces, úvula y pilares
§ Grado II: Visualización directa de paladar blando, fauces y úvula.
§ Grado III: Visualización directa de paladar blando y base de la úvula.
§ Grado IV: Visualización sólo de paladar duro.
-Distancia hioides-mandíbula (para valoración del cuello corto): consiste en colocar los cuatro últimos dedos de la mano del explorador (con la palma extendida y hacia abajo) entre el hioides y el mentón. Si lo sobrepasan, podremos inferir que se trata de un cuello corto.
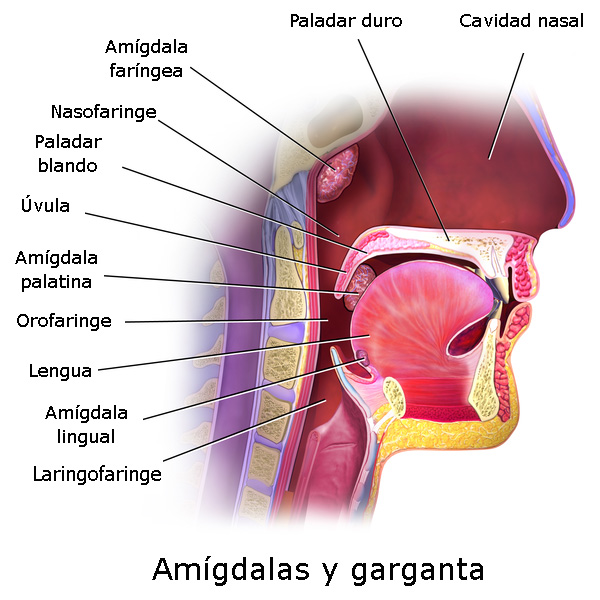
Anatomía de la boca y faringe
Autor/a de la imagen: Modificado de Blausen - WIKIMEDIA COMMONS. File:Blausen 0861 Tonsils&Throat Anatomy2.png
Fuente: Wikipedia
Presión Nasal Domiciliaria -PND-
El PND, un dispositivo muy simple para establecer el diagnóstico y la gravedad de la enfermedad en los pacientes con sospecha de apneas de sueño, podría ser usado en Atención Primaria con un menor coste para el sistema sanitario (…) La nueva herramienta mide solamente la presión en la nariz determinando la cantidad de aire que entra y sale del aparato respiratorio. Esta medida, a su vez, sirve para que, de una forma automática, por el propio software de la solución, se pueda establecer el número y duración de las apneas durante el sueño. Se trata de un dispositivo muy simple que el propio paciente puede colocarse en su domicilio para el registro nocturno[3].
Prieto Romo lo corrobora: “Un estudio multicéntrico español, liderado por el Centro de Investigación Biomédica en Red de Enfermedades Respiratorias (CIBERES), dependiente del Instituto de Salud Carlos III, y los Hospitales San Pedro de Alcántara de Cáceres y Txagoritxu de Vitoria, concluía que un dispositivo muy simple (Presión Nasal Domiciliaria -PND-), indicado para establecer el diagnóstico y la gravedad de la enfermedad en los pacientes con sospecha de apneas de sueño, podría ser usado en Atención Primaria con un menor coste para el sistema sanitario. La investigación dio lugar a la publicación de dos artículos en la revista científica Sleep. ‘Estos artículos demostraban que, por una parte, para la misma eficacia diagnóstica el coste era sensiblemente inferior al de la polisomnografía y, por otra, que la decisión del tratamiento más adecuado era superponible al realizado mediante la polisomnografía en el hospital. Por tanto, estos hallazgos abren la posibilidad de diagnosticar y tratar a los pacientes con sospecha de apneas de sueño en Atención Primaria, algo que hasta el momento estaba vetado por la falta de una herramienta adecuada, efectiva y de fácil uso’, afirmaban los Drs. Juan Fernando Masa y Joaquín Durán, coordinadores del estudio”.
“Debido a que la Atención Primaria no podía contribuir al diagnóstico, al menos en los casos menos complicados -subraya el Dr. Prieto Romo-, la obligada atención hospitalaria se enlentecía. Todo ello acaba encareciendo el procedimiento de diagnóstico y tratamiento de la enfermedad. El método diagnóstico estándar es la Polisomnografía, que registra variables neurológicas para poder identificar las fases del sueño y respiratorias, y demostrar las apneas y sus repercusiones. Esta prueba requiere personal experto y vigilancia durante toda la noche. Consecuentemente, el coste es elevado y el volumen de pacientes que pueden ser diagnosticados es muy inferior al necesario. Por tanto, el acceso al diagnóstico es difícil, con largas listas de espera”.

Autor/a: Wikicanadashawn
Fuente: Wikimedia Commons
“En la última década se han hecho grandes esfuerzos en investigación para intentar simplificar el diagnóstico. El nuevo dispositivo mide solamente la presión en la nariz (PND), determinando la cantidad de aire que entra y sale del aparato respiratorio. Esta medida, a su vez, sirve para que, de una forma automática, por el propio software del dispositivo, se pueda establecer el número y duración de las apneas durante el sueño. Se trata de un dispositivo muy simple que el propio paciente puede colocarse en su domicilio para el registro nocturno, si bien los autores piensan que será preciso ratificar los resultados en el propio ámbito de Atención Primaria y, de hecho, me consta que ese proceso ya se está realizando en la provincia de Cáceres con buenos resultados. Todo ello ha motivado una propuesta de cambios en el algoritmo diagnóstico y terapéutico de SAHS. Estos hallazgos abren la posibilidad de agilizar y abaratar el diagnóstico de una enfermedad que afecta a muchos millones de pacientes en todo el mundo”, afirma el especialista.
Criterios de derivación
Los pacientes identificados en Atención Primaria con sospecha de SAHS deben ser remitidos a la Unidad de Sueño según unos criterios de derivación de forma preferente, urgente u ordinaria[4]. El médico de familia debe interrogar por el tiempo de evolución del proceso, su repercusión socio-laboral y el grado de somnolencia para valorar si se realiza derivación normal o preferente. Hay que priorizar aquellos pacientes que presenten alguna de las siguientes circunstancias: somnolencia diurna grave o incapacitante, HTA refractaria o de alto riesgo, cardiopatía isquémica, arritmias cardiacas, accidentes cerebrovasculares, insuficiencia respiratoria y profesiones de riesgo (conductores que ejercen más de 2 horas al día, trabajadores de maquinaria peligrosa, etc). “Dentro de ese grupo, se podría priorizar a pacientes con obesidad mórbida en preoperatorio para cirugía bariátrica y a diabéticos tipo 2, por su alto riesgo cardiovascular”, comenta el galeno.
Los enfermos que presenten ronquidos habituales y se acompañen de apneas observadas y despertares recurrentes, con sensación de asfixia o somnolencia diurna excesiva, deberán ser remitidos a una Unidad de Trastornos Respiratorios del Sueño. Según Prieto Romo, “no está indicado derivar los casos de roncopatía simple, obesidad aislada o HTA bien controlada, sin otro síntoma acompañante. En cuanto al diagnóstico definitivo desde Atención Primaria, se están dando pasos de gigante con la PRD y la PND, pero con la supervisión y diagnóstico definitivo e instauración de tratamiento por parte del servicio de Neumología de referencia”.
La PSG, prueba Gold Standard para casos dudosos o difíciles
La polisomnografía es un estudio del sueño en el que el paciente, mientras duerme, permanece conectado a un equipo de monitorización. “La Polisomnografía (PSG) es el método diagnóstico más completo en el estudio del Síndrome de Apnea Hipopnea del Sueño, siendo, por ello, la prueba Gold Standard. Sin embargo, se trata de una prueba costosa, compleja y no siempre accesible. En la actualidad, las principales indicaciones de la polisomnografía son los casos dudosos o difíciles, aquellos con enfermedades crónicas que cursan con hipoventilación y en pacientes con somnolencia diurna, en los que se sospecha de una enfermedad de origen no respiratorio”, explica.
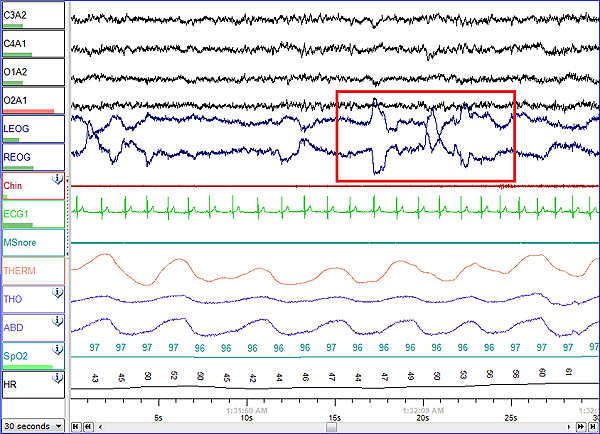
Registro polisomnográfico del sueño REM
Autor/a de la imagen: NascarEd
Fuente: Wikipedia
La Poligrafía Respiratoria Domiciliaria (PRD) es, en la actualidad, el método diagnóstico de primera elección en pacientes con alta probabilidad clínica, así como en casos con baja sospecha clínica en los que se puede descartar la enfermedad. En pacientes con alta sospecha clínica de presentar un SAHS, ante un resultado negativo en la PRD se debe realizar un estudio polisomnográfico (PSG). Otros procedimientos diagnósticos susceptibles de ser aplicados serían:
-Los Estudios de Sueño Simplificados que evalúan 3 o 4 variables cardiorrespiratorias, y los supersimplificados, que evalúan sólo 1 o 2, como la Presión Nasal Domiciliaria (PND), de la que ya se ha hablado con anterioridad.
-La Pulsioximetría nocturna puede, a veces, servir como método de sospecha o screening, aunque es poco utilizada por su baja especificidad (puede dar falsos positivos en pacientes con EPOC u otras enfermedades respiratorias, y falsos negativos en pacientes SAHS con despertares, pero sin desaturaciones).
En cuanto a las novedades o avances vinculados al abordaje diagnóstico del SAHS en Atención Primaria, el Dr. reitera que se han propuesto “cambios en el algoritmo diagnóstico y terapéutico de SAHS según sospecha clínica de SAHS, concurrencia de otros trastornos del sueño o comorbilidades complicadas (IC -insuficiencia cardíaca-, ACV -accidente cerebrovascular-, EPOC grave, o SHO -Síndrome de Hipoventilación y Obesidad-, Depresión o Insomnio) y probabilidad PRETEST (baja, media o alta de padecerlo), según la cual se utilizará PSG, PRD o PND como método diagnóstico, y atendiendo a la valoración del IAH (Índice Apneas Hipopneas), se confirmará SAHS o se descartará (investigando otras causas, en este caso) y se instaurará o no tratamiento con CPAP dependiendo de la intensidad del SAHS. Se trata de una propuesta reciente de los autores del estudio sobre PND, capitaneados por el jefe de Sección de Neumología del Complejo Hospitalario Universitario de Cáceres y del grupo CIBER de Enfermedades Respiratorias, ISCIII Madrid (el Dr. Juan Fernando Masa Jiménez), y por el F.E.A. en Neumología de dicho Hospital, el Dr. Jaime Corral Peñafiel (Unidad Multidisciplinar del Sueño de Cáceres. CIBER de Enfermedades Respiratorias, ISCIII Madrid)".
“Es muy importante anotar TODO en la historia del paciente con SAHS”
“En definitiva, y como conclusión -refiere Prieto Romo-, el Síndrome de Apnea Hipopnea del Sueño es considerado un problema de salud pública de primera magnitud, asociado a un mayor uso de recursos sanitarios por parte de los pacientes no tratados. Así, el papel del médico de Atención Primaria es fundamental en la sospecha del cuadro, la divulgación y conocimiento de la enfermedad y la utilización correcta de los criterios de derivación, debiendo tener una buena coordinación con atención especializada (atención secundaria u hospitalaria). También debe, como no, implicarse en el seguimiento de la enfermedad y en el control de los pacientes ya tratados, vigilando su cumplimiento terapéutico”. Así pues, desde Atención Primaria se puede:
• Realizar seguimiento del cumplimiento del tratamiento higiénico-dietético y de la evolución de la sintomatología.
• Detectar la aparición de posibles complicaciones.
• Derivar a O.R.L. si existe alteración anatómica.
En pacientes con el tratamiento de elección para el SAHS, como es la CPAP nasal -que viene de las siglas ‘Continuous, Pressure, Airway, Positive’-, cada 6 meses habrá que revisar:
- Cumplimiento terapéutico de la CPAP nasal.
-Tolerancia al dispositivo (aparición y características de efectos secundarios), intentando corregir los posibles efectos indeseables del tratamiento.
“¿Y por qué el Médico de Atención Primaria (MAP) es tan importante para el Síndrome de Apnea Hipopnea del Sueño? Porque el 80% de la población pasa, cada año, alguna vez por su MAP; porque el 25% de la población está en riesgo de padecer un SAHS; porque el 90% de los pacientes con SAHS permanecen sin diagnóstico (cuando sólo se necesitan, a veces, 3 preguntas), y porque el 70-80% de los pacientes derivados a una Unidad del Sueño proceden de Atención Primaria”, señala el facultativo. Por tanto -agrega Prieto Romo-, el MAP debe ser pieza clave en la estructura multidisciplinar de las Unidades del Sueño por su:
• Accesibilidad al paciente
• Su continuidad asistencial
• Su conocimiento del entorno social, laboral y personal de dicho paciente
• Y porque los hospitales no pueden abordar solos el SAHS.
“¡Ojo!”, exclama el miembro de SEMERGEN, “es muy importante anotar TODO en la historia del paciente con SAHS (tanto la sospecha clínica, como las advertencias y las recomendaciones aportadas), pues el no hacerlo puede tener implicaciones legales (sobre todo si se producen accidentes laborales y de tráfico por esta causa)”, advierte.
Referencias
1. CONSENSO NACIONAL SOBRE EL SÍNDROME DE APNEAS-HIPOPNEAS DEL SUEÑO (SAHS). Definición y concepto, fisiopatología, clínica y exploración del SAHS. Archivos de Bronconeumología. Vol. 41. Núm. S4. Páginas 12-29 (Diciembre 2005). DOI: 10.1016/S0210-5705(09)71003-9. https://archbronconeumol.org/es-definicion-concepto-fisiopatologia-clinica-exploracion-articulo-13084322
2. www.farmacosalud.com. ‘La apnea del sueño registra un elevado infradiagnóstico de casi el 80%’. Declaraciones del Dr. Carlos Egea (SEPAR). Septiembre 2015. http://farmacosalud.com/la-apnea-del-sueno-registra-un-elevado-infradiagnostico-de-casi-el-80/
3. CIBER ISCIII. ‘Un dispositivo muy simple para el diagnóstico de apneas del sueño posibilita su uso en atención primaria’. Febrero de 2015. Difusión online: https://www.ciberisciii.es/noticias/un-dispositivo-muy-simple-para-el-diagnostico-de-apneas-del-sueno-posibilita-su-uso-en-atencion-primaria
4. Alonso Álvarez ML, Terán Santos J. Diagnóstico precoz, seguimiento y control del paciente con síndrome de apneas-hipopneas durante el sueño. Vigilia-Sueño. Vol. 18. Núm. S1. Páginas 32-39 (Septiembre 2007). Difusión online Elsevier https://www.elsevier.es/es-revista-vigilia-sueno-270-articulo-diagnostico-precoz-seguimiento-control-del-13109172





