Redacción Farmacosalud.com
Investigadores del Centro Nacional de Investigaciones Oncológicas (CNIO) han descubierto que la proteína MIDKINE tiene un papel esencial en la metástasis en melanoma (cáncer de piel), hasta el punto de que su activación determina la capacidad del tumor para diseminarse por el organismo. Pero cuando MIDKINE se inhibe, la metástasis también se bloquea, según han podido comprobar en modelos animales. Los investigadores han conseguido bloquear esta proteína mediante inactivación genética y ahora ya están estudiando el desarrollo de una aproximación farmacológica. “Tenemos un compuesto, generado en el CNIO, con el que somos capaces de bloquear MIDKINE y con ello detener el proceso de diseminación tumoral”, explica a www.farmacosalud.com la doctora Marisol Soengas, directora del Grupo de Melanoma en el CNIO. Soengas confía en que con el paso del tiempo se pueda llegar a ‘paralizar’ a MIDKINE en humanos: “La aplicabilidad en humanos es teóricamente posible, pero todavía queda mucho recorrido para llegar a ese punto”.

Doctora Marisol Soengas
Fuente: CNIO
Así pues, lo que se está intentando es lograr una aproximación farmacológica que permita bloquear esta proteína de forma eficiente en pacientes humanos que tienen melanoma. MIDKINE, que se expresa en muy bajos niveles en individuos adultos sanos, se ha encontrado en cáncer de piel, si bien se ha descubierto que también está activa en otros sistemas tumorales, por lo que el posible éxito de su inhibición farmacológica podría tener aplicación terapéutica en otras patologías cancerosas.
El bloqueo de MIDKINE no es capaz de atacar el tumor primario
Ahora bien: ¿bloqueando a MIDKINE, y bloqueando la metástasis, se puede revertir el melanoma, es decir, ‘atacarlo’ hasta hacerlo desaparecer? “Eso creemos que va a ser más difícil -responde Soengas-. Nosotros hemos visto que el efecto de bloqueo de MIDKINE inhibe la capacidad de metástasis, pero no es capaz de atacar el tumor primario”. Con todo, los científicos del CNIO ya están estudiando combinaciones de fármacos que permitan compaginar estrategias, tanto de terapia dirigida como de inmunoterapia, con el fin de intentar abarcar todas las posibilidades terapéuticas posibles.
En el melanoma cutáneo, el cáncer de piel más agresivo, es especialmente importante la detección precoz: con poco más de un milímetro de grosor, el tumor puede empezar a diseminarse, enviando sus células a colonizar otros órganos. Cuando esto ocurre el pronóstico es, por lo general, malo. Se ha mejorado mucho en el tratamiento, particularmente con inmunoterapia, pero la mortalidad del melanoma sigue siendo muy elevada.
Los ratones bioluminiscentes MetAlert, una herramienta vital
Los avances relativos a la inhibición de MIDKINE, publicados en la prestigiosa revista científica ‘Nature’, han partido de unos modelos de ratón con melanoma llamados MetAlert, modelos en los que se puede ver -sin operación quirúrgica ni intervenciones adicionales- cómo el melanoma actúa en todo el organismo, desde antes incluso de que ocurran las metástasis. Estos MetAlert, que son unos ratones bioluminiscentes, permiten visualizar in vivo cómo los melanomas actúan a distancia antes de formar las metástasis, y cómo estas señales se reactivan cuando la cirugía no es eficiente. “Los ratones MetAlert son muy novedosos porque son los primeros que permitan esta capacidad de visualización temprana de las metástasis. Constituyen una herramienta para identificar rutas de señalización, que luego estudiamos en muestras de pacientes humanos. Es entonces cuando validamos nuestros resultados y definimos la relevancia fisiológica de los hallazgos”, comenta Soengas.
La estrategia MetAlert ha partido de un trabajo muy innovador del grupo de Sagrario Ortega en el CNIO, que logró mediante modificaciones genéticas ratones que emiten luz (bioluminiscencia) cuando hay una activación patogénica de los vasos linfáticos. “Estos ratones bioluminiscentes son idóneos para la investigación del melanoma”, indica Ortega, “porque la generación de vasos linfáticos, o linfangiogénesis, es uno de los pasos iniciales en la diseminación de este cáncer”.
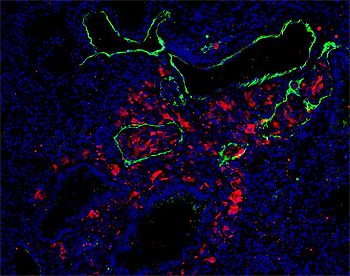
Células de melanoma metastásico (rojo) en vasos linfáticos en pulmón (verde)
Fuente: CNIO
Difusión: CNIO y Asociación Española Contra el Cáncer (AECC)
El valor de MetAlert reside en que orienta a los investigadores a la hora de buscar genes y moléculas que intervienen en la progresión tumoral, desde las etapas más tempranas. También permite estudiar las recaídas tras cirugía, o la respuesta a fármacos anticancerígenos. Hasta ahora, las técnicas disponibles para animales vivos requerían sondas o marcadores que tenían que inyectarse en el entorno tumoral, o se basaban en la detección de células tumorales cuando éstas estaban ya asentadas en otros órganos, es decir, una vez ya iniciada la formación de la metástasis. Tal y como destaca David Olmeda, primer autor del trabajo, “una de las grandes complicaciones en el seguimiento de los melanomas ha sido precisamente la falta de sensibilidad de las técnicas habituales”.
El trabajo publicado en ‘Nature’ detalla cómo, con MetAlert, los investigadores han detectado los mecanismos que el cáncer de piel activa muy tempranamente para crear sus propias autovías de diseminación, en parte a través de los vasos linfáticos. Hace ya tiempo que se sospechaba que los melanomas, antes de diseminarse, preparan el terreno en los órganos que van a colonizar. Se creía que este proceso ocurría primero activando la vasculatura linfática en el tumor y luego en ganglios linfáticos adyacentes, los ganglios centinela, para posteriormente llegar a órganos distantes. Sin embargo, eliminar los ganglios centinela no impide las metástasis en otros órganos, lo que indica que algo no encaja en ese modelo.
El grupo de Melanoma del CNIO ha descubierto el porqué. Con los modelos MetAlert han demostrado que estos tumores, cuando son agresivos, actúan a distancia mucho antes de lo que se creía, y lo hacen sin necesidad de recurrir a las proteínas que se consideraban esenciales para activar la linfangiogénesis en el tumor. “Estos resultados indican un cambio de paradigma en el estudio de la metástasis en melanoma”, señala Soengas a través de un comunicado del CNIO. A raíz de lo observado, el grupo decidió realizar un mapa completo de todas las proteínas que secretan tanto los melanomas agresivos como los que no lo son. Los resultados no se hicieron esperar: “Encontramos muchas proteínas que se secretan específicamente por melanomas que actúan a distancia, pero en este trabajo nos enfocamos en una en particular, MIDKINE, por su novedad y potencial como diana terapéutica”, explica Olmeda.
Creación de ratones MetAlert avatar
De nuevo recurriendo a los ratones MetAlert, el grupo de Melanoma del CNIO ha demostrado que la activación de MIDKINE determina la capacidad del tumor para diseminarse. Además, han descrito toda una cadena de señales que median este proceso. Para ello, el grupo de Melanoma del CNIO creó ratones MetAlert avatar, en los que se integraron muestras de tumores humanos en la piel de los animales. Además, generaron otras variantes MetAlert que reproducen mutaciones características de los melanomas en humanos. El trabajo incluyó también estudios muy sofisticados de microscopía in vivo realizados en colaboración con el Mount Sinai Icahn School of Medicine, en Nueva York.
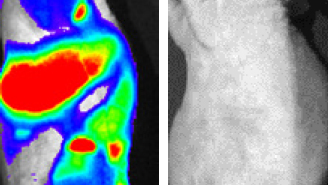
Ratón MetAlert muestra un melanoma agresivo antes de que ocurra la metástasis (con luminiscencia; izquierda) frente un ratón con melanoma no agresivo (sin luminiscencia; derecha)
Fuente: CNIO
Difusión: CNIO y Asociación Española Contra el Cáncer (AECC)
Una vez desarrollados los estudios en modelos de ratón, los investigadores se preguntaron cómo de importante era MIDKINE en pacientes con melanoma. En colaboración con especialistas en dermatología y patología del Hospital 12 de Octubre, en Madrid, y del Hospital Clinic, en Barcelona, analizaron la expresión de MIDKINE en lesiones benignas (lunares) y en melanomas en distintos estadíos de desarrollo. Este experimento demostró que los pacientes con altos niveles de esta proteína en los ganglios linfáticos tienen un peor pronóstico, un dato que abre la vía a utilizar MIDKINE como posible biomarcador de agresividad.
Según Soengas, “MIDKINE no es la única diana, por supuesto, pero como el melanoma es el cáncer con el mayor número de mutaciones descritas, encontrar una proteína que pueda servir para bloquear la metástasis es un paso importante”. Los investigadores predicen que el hallazgo de MIDKINE es sólo el principio. “Estas técnicas de visualización de metástasis abren nuevas vías de investigación a nuevos mecanismos tumorales y a otros estudios preclínicos -coinciden en remarcar Soengas, Ortega y Olmeda-, y tienen una enorme utilidad para la investigación porque pueden adaptarse a distintos tipos de cáncer, no solo al melanoma”.
Agradecimientos al Hospital 12 de Octubre y al Hospital Clínic
El trabajo ha sido financiado por el Ministerio de Economía, Industria y Competitividad, L’Oréal Paris USA–Melanoma Research Alliance, la Worldwide Cancer Research, la Asociación Española Contra el Cáncer, la Fundación Mutua Madrileña, la Fundación ‘La Caixa’, Immutrain Marie Skłodowska-Curie ITN y proyectos del National Cancer Institute de los EEUU. “Para conseguir un estudio de este calibre, en el que se parte de unos modelos de ratón, procediendo después a un estudio funcional en modelos celulares, para luego llegar a una validación en muestras de pacientes, se requiere una infraestructura muy compleja. Nosotros, en este sentido, agradecemos la colaboración del Hospital 12 de Octubre de Madrid y el Hospital Clínic de Barcelona, porque son los que nos han proporcionado toda una serie clínica de pacientes con un seguimiento a más de 12 años, que es lo que nos permite validar la potencialidad de la proteína MIDKINE como posible biomarcador”, subraya Soengas.
Artículo de referencia:
'Whole-body imaging of lymphovascular niches identifies pre-metastatic roles of midkine'. David Olmeda, Daniela Cerezo-Wallis, Erica Riveiro-Falkenbach, Paula C. Pennacchi, Marta Contreras-Alcalde, Nuria Ibarz, Metehan Cifdaloz, Xavier Catena, Tonantzin G. Calvo, Estela Cañón, Direna Alonso, Javier Suarez, Lisa Osterloh, Chandrani Monda, Julie Di Martino, Osvaldo Graña, Francisca Mulero, Diego Megías, Marta Cañamero, David Lora, Inés Martinez-Corral, J. Javier Bravo Cordero, Javier Muñoz, Susana Puig, Pablo Ortiz-Romero, José L Rodriguez-Peralto, Sagrario Ortega, María S. Soengas (Nature 2017). DOI: 10.1038/nature22977




