
Dr. Antonio López-Serrano
Fuente: Dr. López-Serrano
LOS PACIENTES CON EII, ¿TIENEN UN MAYOR RIESGO DE CCR QUE LA POBLACIÓN GENERAL?
Los pacientes con Enfermedad Inflamatoria Intestinal (EII) tienen un mayor riesgo de cáncer colorrectal (CCR) que la población general, riesgo que ha ido disminuyendo en las últimas décadas. En series de hace 20 años, el riesgo era del 2% anual a los 10 años de evolución de la enfermedad; ahora es del 1%. A los 20 años era de un 8%; ahora es de un 2%. Y a partir de los 20 años de evolución era de casi el 20%, siendo ahora del 5%1-3 (Figura 1). Este descenso progresivo en la incidencia de CCR ha ocurrido de forma similar tanto en la Colitis Ulcerosa (CU) como en la Enfermedad de Crohn (EC)4.
En la actualidad, aproximadamente el 1,2% de los pacientes con CCR tienen asociada una EII. Estos pacientes tienen en general un peor pronóstico: son 15 años de media más jóvenes que los pacientes con CCR esporádico, siendo la supervivencia a los 5 años en los pacientes menores de 65 años 14 puntos inferior5.
¿ES DISTINTA LA PATOGENIA DEL CCR EN LOS PACIENTES CON EII?
Si bien es verdad que, a nivel molecular, en el CCR asociado a colitis nos encontramos con alteraciones típicas del CCR esporádico, existen algunas diferencias respecto al momento y frecuencia de estas alteraciones, como por ejemplo la pérdida de la función del gen P53, que ocurre de forma muy temprana, o bien la mutación del gen APC, que ocurre más tardíamente. Estos hechos justifican que no tengamos en muchos casos la típica progresión de adenoma a carcinoma y sí podemos encontrarnos con una secuencia directa de displasia a carcinoma6.
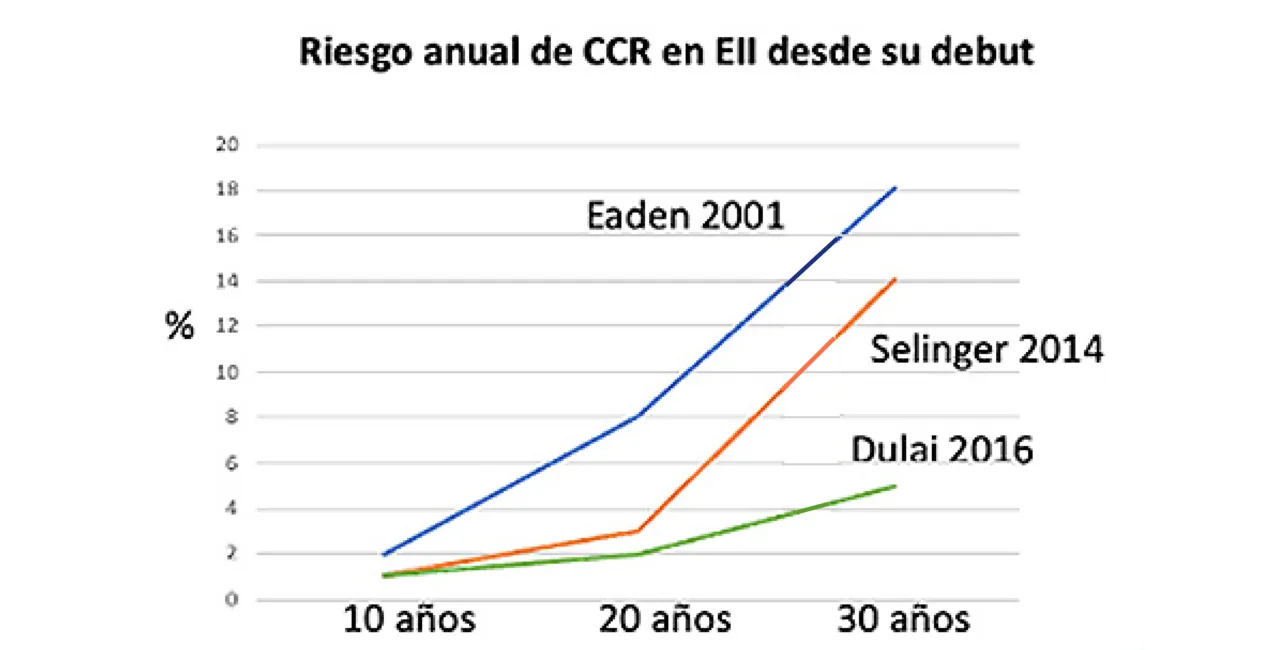
Figura 1
Adaptada de 1-3
¿QUÉ FACTORES AUMENTAN EL RIESGO DE CCR EN EII?
Entre los factores de riesgo de CCR que puede presentar un paciente con EII podemos diferenciar los propios de la población general (edad avanzada, sexo masculino, familiares de primer grado), incluyendo factores asociados a los estilos de vida (obesidad, sedentarismo, tabaquismo y alcoholismo) y otros factores específicos de la EII, como Colangitis Esclerosante Primaria (CEP), afectación colónica extensa, EII de larga duración, inflamación crónica activa (endoscópica o histológica), alteraciones anatómicas (colon acortado, con estenosis o pseudopólipos -éstos no son factor de riesgo en series recientes-)7 y antecedentes de displasia de colon6.
¿QUÉ FACTORES DISMINUYEN EL RIESGO DE CCR EN EII?
Los factores que pueden disminuir el riesgo de CCR y que podrían justificar el descenso en su incidencia de las últimas décadas son la quimioprevención por los tratamientos aplicados (5-ASA, tiopurinas, AINEs, ácido ursodesoxicólico, estatinas), los programas de vigilancia endoscópica y la realización de una proctocolectomía.
Parece que el cribado endoscópico en EII es útil, pues según distintos estudios, la vigilancia endoscópica se asocia a una menor incidencia de cáncer de intervalo, de cáncer avanzado y una menor mortalidad por CCR8-10. Por ello, distintas sociedades científicas, entre ellas GETECCU, han confeccionado guías muy similares que nos indican cuándo iniciar el cribado y con qué periodicidad11.
¿CUÁNDO REALIZAR UN CRIBADO DE DISPLASIA EN EII?
En general, los pacientes que se han de someter a cribado de displasias son aquellos con una colitis extensa o bien a partir de los ocho años de evolución de la enfermedad o de forma inmediata en los pacientes afectados además de CEP11. Además, los pacientes se clasificarán en tres grupos de riesgo (alto, medio o bajo) en función de sus antecedentes personales y familiares y de los hallazgos endoscópicos, para así someterse a intervalos de seguimiento anuales, trienales o quinquenales, respectivamente (Figura 2).
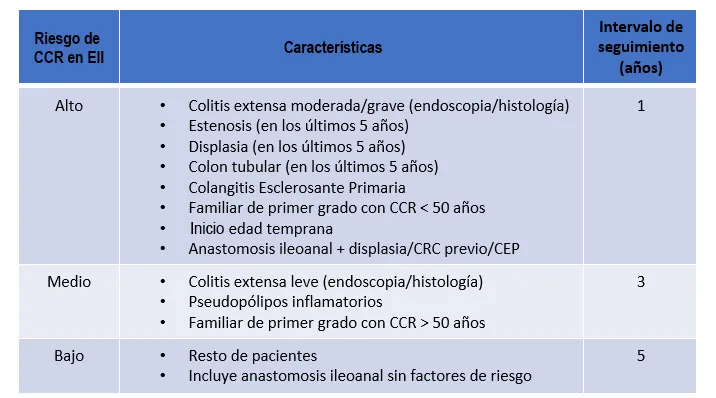
Figura 2
Extraída de 11
¿SE CUMPLEN LAS GUÍAS DE CRIBADO DE DISPLASIA EN EII?
Se ha podido comprobar que la adherencia a los programas de cribado suele ser baja incluso en los pacientes de alto riesgo. Recientemente, un estudio retrospectivo español en el que participaron 25 hospitales y un total de 1.031 pacientes incluidos, demuestra que el 90% de los pacientes diana son incluidos en programas de cribado, aunque finalmente sólo el 27% siguen las guías de forma adecuada, adherencia mucho menor que la recomendada para el cribado de CCR en la población general de riesgo medio, del 40-45%12. Además, la adherencia era incluso peor en los grupos de alto riesgo de CCR. A los pacientes con un adecuado seguimiento se les detectaron un mayor número de lesiones avanzadas y de forma más temprana que al resto.
¿CÓMO REALIZAR EL CRIBADO DE DISPLASIAS EN LA EII?
1) Preparación del paciente.
Para realizar la colonoscopia de forma adecuada, sin restos fecales, es muy importante insistir en una dieta líquida desde 24 h antes de la endoscopia y que la enfermedad no se encuentre activa13.
2) Técnica endoscópica de detección de lesiones.
Aunque no existen muchos estudios publicados con un diseño adecuado, en el año 2015 el consenso SCENIC consideró que, frente a la endoscopia con luz blanca y toma de biopsias aleatorias, la cromoendoscopia con colorantes (azul de metileno al 0,1% o índigo carmín al 0,1-0,5%) y con biopsias dirigidas era la mejor técnica de detección de displasias14. Posteriormente, algunos estudios han sugerido que la endoscopia de alta definición podría ser complementaria o incluso una alternativa a la cromoendoscopia con colorantes15,16.
Desde hace ya algunos años disponemos de técnicas de cromoendoscopia virtual, sin el uso de colorantes, que permiten mejorar la visibilidad de las estructuras superficiales y la morfología de los vasos sanguíneos. Hablamos fundamentalmente de Narrow Band Imaging (NBI; Olympus, Japan), iSCAN (Pentax, Japan) y Flexible Imaging Color Enhancement (FICE; Fujinon, Japan), aunque existen otras como Autofluorescencia (AFI), Blue laser image (BLI; Fujifilm, Japan) y Linked color imaging (LCI; Fujifilm, Japan)17. Son pocos los estudios bien diseñados que comparen estas técnicas. Lo que nos vienen a decir las últimas guías internacionales de la ESGE es que se pueden usar estas técnicas, ya que no existe evidencia en contra de su uso18.
Fuente: Archivo
En general, estas técnicas endoscópicas se caracterizan por precisar menores tiempos de exploración19,20. Nuestro grupo publicó un estudio en el que comparamos la cromoendoscopia con índigo carmín y la cromoendoscopia virtual con iSCAN y pudimos comprobar que ambas técnicas detectaban displasias de forma similar, displasias que se detectaron en el 11% de los pacientes incluidos21. Y también comprobamos que con iSCAN la técnica era más rápida, unos 5 minutos menos de mediana, independientemente del número o resecciones que se realizaran. El factor de riesgo de displasia más importante detectado en el estudio fue la localización de las lesiones en el colon derecho. Pero incluso la endoscopia de alta definición sin aplicar cromoendoscopia virtual puede ser una técnica adecuada, como demuestra un estudio reciente en el que se detectan el mismo número de displasias y con tiempos de exploración equiparables entre ambas técnicas22.
3) Caracterización de las lesiones y experiencia del endoscopista.
Independientemente de la técnica de detección utilizada, las lesiones deben describirse morfológicamente utilizando la clasificación de Paris modificada y una descripción del patrón de criptas de Kudo23,24.
Clásicamente se ha propuesto que deben de ser endoscopistas expertos los que practiquen las endoscopias de cribado18, aunque no queda claro quién puede considerarse experto en este contexto25. En todo caso, sí parece que debemos de tener acceso a endoscopistas con experiencia en técnicas de resección complejas, tanto de resección mucosa como de disección submucosa endoscópicas. Nosotros hemos participado en un estudio prospectivo nacional con 350 pacientes sometidos a cribado de displasias con cromoendoscopia con colorantes, analizándose un total de 637 lesiones resecadas26. Las tasas de detección de lesiones eran similares entre endoscopistas expertos y no expertos, hecho que indica que la cromoendoscopia con colorantes por sí misma no es una técnica excesivamente compleja.

Autor/a: George Hodan
Fuente: www.publicdomainpictures.net
Recientemente, como alternativa a la descripción del patrón de criptas de Kudo, un grupo de expertos ha establecido la clasificación FACILE para predecir la probabilidad de displasia que incluye una adecuada valoración del patrón de criptas y del patrón vascular27. Los autores demuestran que se puede conseguir mediante un aprendizaje muy sencillo. Esta clasificación permite predecir la histología neoplásica fijándonos en 4 características de las lesiones: morfología (polipoidea o no), superficie (regular o irregular), arquitectura vascular (regular o irregular) y signos de presencia o no de inflamación en la lesión.
Como técnica alternativa, la endocitoscopia se ha utilizado para la evaluación histológica in vivo, lo que sugiere su futura aplicabilidad en estos pacientes28.
¿PUEDE LA INTELIGENCIA ARTIFICIAL AYUDAR A DETECTAR DISPLASIAS EN LOS PACIENTES CON EII DE LARGA EVOLUCIÓN?
Los sistemas de diagnóstico asistidos por ordenador (también llamados sistemas CADe -computer-assisted diagnosis-) se han empezado a usar para detectar displasias en pacientes con EII29. Nosotros hemos presentado en el Congreso Europeo ESGE Days 2022 un estudio preliminar en el que aplicamos la inteligencia artificial mediante el sistema DiscoveryTM (Pentax, Japan) y la cromoendoscopia virtual con iSCAN en 50 pacientes con CU30. Detectamos un total de 73 lesiones, el 64% en el colon derecho; 10 de ellas fueron displásicas, y no hubo diferencias entre ambas técnicas para la detección de las mismas. Futuros estudios con un mayor número de pacientes incluidos nos ayudarán a dilucidar si precisamos o no de estos sistemas avanzados de detección de lesiones en los pacientes con EII colónica de larga evolución.
¿CÓMO HAN DE RESECARSE LAS LESIONES DETECTADAS?
Cuando las lesiones detectadas son polipoideas (Paris tipo 0-Ip ó 0-Is) utilizaremos las técnicas de resección habituales. Pero en caso de lesiones planas o deprimidas (Paris 0-IIa, 0-IIb ó 0-IIc), la actitud a tomar va a depender del aspecto de la lesión y de la probabilidad que se tenga de poder realizar una resección completa, recomendándose realizar técnicas de mucosectomía o, si son mayores de 20 mm, de disección submucosa, con el objetivo de realizar resecciones en bloque, no siempre fáciles por la posibilidad de presencia de fibrosis submucosa en este tipo de pacientes31. A pesar de ello, la disección submucosa parece una técnica segura, siendo igual de resolutiva y segura que aplicada en otros pacientes sin EII32.
¿QUÉ SEGUIMIENTO SE HA DE REALIZAR TRAS RESECAR DISPLASIAS?
Cuando las lesiones displásicas son resecadas, las distintas guías recomiendan seguimientos endoscópicos similares como el que se muestra en la Figura 3, aunque con dudas ante la presencia de displasias de alto grado multifocales o si el paciente está afectado además de CEP. En todo caso, si la displasia no es resecable, la indicación de colectomía es indiscutible.
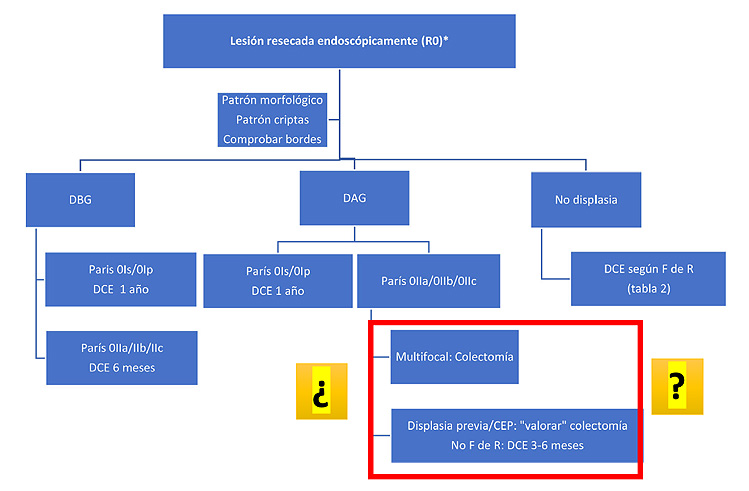
Figura 3. DAG: displasia de alto grado; DBG: displasia de bajo grado; DCE: cromoendoscopia con colorante; CEP: colangitis esclerosante primaria; F de R: factores de riesgo
Extraída de 11
Bibliografía
1. Eaden JA, Abrams KR, Mayberry JF. The risk of colorectal cancer in ulcerative colitis: a meta-analysis. Gut. 2001;48:526-35.
2. Selinger CP, Andrews JM, Titman A, Norton I, Jones DB, McDonald C, et al. Long-term follow-up reveals low incidence of colorectal cancer, but frequent need for resection, among Australian patients with inflammatory bowel disease. Clin Gastroenterol Hepatol. 2014;12:644-50.
3. Dulai PS, Sandborn WJ, Gupta S. Colorectal Cancer and Dysplasia in Inflammatory Bowel Disease: A Review of Disease Epidemiology, Pathophysiology, and Management. Cancer Prev Res (Phila). 2016;9:887-894.
4. Lutgens MW, van Oijen MG, van der Heijden GJ, Vleggaar FP, Siersema PD, Oldenburg B. Declining risk of colorectal cancer in inflammatory bowel disease: an updated meta-analysis of population-based cohort studies. Inflamm Bowel Dis. 2013;19:789-99.
5. Bogach J, Pond G, Eskicioglu C, Seow H. Age-Related Survival Differences in Patients With Inflammatory Bowel Disease-Associated Colorectal Cancer: A Population-Based Cohort Study. Inflamm Bowel Dis. 2019;25:1957-1965.
6. Beaugerie L, Itzkowitz SH. Cancers complicating inflammatory bowel disease. N Engl J Med. 2015;372:1441-52.
7. Mahmoud R, Shah SC, Ten Hove JR, Torres J, Mooiweer E, Castaneda D, et al. No Association Between Pseudopolyps and Colorectal Neoplasia in Patients With Inflammatory Bowel Diseases. Gastroenterology. 2019;156:1333-1344.
8. Burke KE, Nayor J, Campbell EJ, Ananthakrishnan AN, Khalili H, Richter JM. Interval Colorectal cancer in inflammatory bowel disease: the role of guideline adherence. Digest Dis Sci. 2020;65:111-118.
9. Ananthakrishnan AN, Cagan A, Cai T, et al. Colonoscopy is associated with a reduced risk for colon cancer and mortality in patients with inflammatory bowel diseases. Clin Gastroenterol Hepatol. 2015;13:322-329.
10. Bye WA, Ma C, Nguyen TM, Parker CE, Jairath V, East JE. Strategies for detecting colorectal cancer in patients with inflammatory bowel disease: A Cochrane systematic review and meta-analysis. Am J Gastroenterol. 2018;113:1801-180
11. Sicilia B, Vicente R, Arias L, Echarri A, Zabana Y, Mañosa M, et al. Recommendations of the Spanish Working Group on Crohn's disease and Ulcerative Colitis (Grupo Español de Trabajo en Enfermedad de Crohn y Colitis Ulcerosa - GETECCU) on dysplasia screening in inflammatory bowel disease patients. Gastroenterol Hepatol. 2021;44:435-447.
12. Ballester MP, Mesonero F, Flórez-Diez P, Gómez C, Fuentes-Valenzuela E, Martín N, et al. Adherence to endoscopic surveillance for advanced lesions and colorectal cancer in inflammatory bowel disease: an AEG and GETECCU collaborative cohort study. Aliment Pharmacol Ther. 2022;55:1402-1413.
13. Megna B, Weiss J, Ley D, Saha S, Pfau P, Grimes I, et al. Clear liquid diet before bowel preparation predicts successful chromoendoscopy in patients with inflammatory bowel disease. Gastrointest Endosc. 2019;89:373-379.
14. Laine L, Kaltenbach T, Barkun A, McQuaid KR, Subramanian V, Soetikno R; SCENIC Guideline Development Panel. SCENIC international consensus statement on surveillance and management of dysplasia in inflammatory bowel disease. Gastrointest Endosc. 2015;81:489-501.
15. Iannone A, Ruospo M, Wong G, Principi M, Barone M, Strippoli GFM, et al. Chromoendoscopy for Surveillance in Ulcerative Colitis and Crohn's Disease: A Systematic Review of Randomized Trials. Clin Gastroenterol Hepatol. 2017;15:1684-1697.
16. Alexandersson B, Hamad Y, Andreasson A, Rubio CA, Ando Y, Tanaka K, et al. High-Definition Chromoendoscopy Superior to High-Definition White-Light Endoscopy in Surveillance of Inflammatory Bowel Diseases in a Randomized Trial. Clin Gastroenterol Hepatol. 2020;18:2101-2107.
17. Murthy SK, Feuerstein JD, Nguyen GC, Velayos FS. AGA Clinical Practice Update on Endoscopic Surveillance and Management of Colorectal Dysplasia in Inflammatory Bowel Diseases: Expert Review. Gastroenterology. 2021;161:1043-1051.
18. Bisschops R, East JE, Hassan C, Hazewinkel Y, Kamiński MF, Neumann H, et al. Advanced imaging for detection and differentiation of colorectal neoplasia: European Society of Gastrointestinal Endoscopy (ESGE) Guideline - Update 2019. Endoscopy. 2019;51:1155-1179.
19. Bisschops R, Bessissow T, Joseph JA, Baert F, Ferrante M, Ballet V, et al. Chromoendoscopy versus narrow band imaging in UC: a prospective randomised controlled trial. Gut. 2018;67:1087–94.
20. Iacucci M, Kaplan GG, Panaccione R, Akinola O, Lethebe BC, Lowerison M, et al. A Randomized Trial Comparing High Definition Colonoscopy Alone With High Definition Dye Spraying and Electronic Virtual Chromoendoscopy for Detection of Colonic Neoplastic Lesions During IBD Surveillance Colonoscopy. Am J Gastroenterol. 2018;113:225-234.
21. López-Serrano A, Suárez MJ, Besó P, Algarra A, Latorre P, Barrachina MM, et al. Virtual chromoendoscopy with iSCAN as an alternative method to dye-spray chromoendoscopy for dysplasia detection in long-standing colonic inflammatory bowel disease: a case-control study. Scand J Gastroenterol. 2021;56:820-828.
22. Kandiah K, Subramaniam S, Thayalasekaran S, Chedgy FJ, Longcroft-Wheaton G, Fogg C, et al. Multicentre randomised controlled trial on virtual chromoendoscopy in the detection of neoplasia during colitis surveillance high-definition colonoscopy (the VIRTUOSO trial). Gut. 2021;70:1684-1690.
23. The Paris endoscopic classification of superficial neoplastic lesions: esophagus, stomach, and colon: November 30 to December 1, 2002. Gastrointest Endosc. 2003 Dec;58(6 Suppl):S3-43.
24. Kudo S, Rubio CA, Teixeira CR, Kashida H, Kogure E. Pit pattern in colorectal neoplasia: endoscopic magnifying view. Endoscopy. 2001 Apr;33(4):367-73.
25. Dekker E, Houwen BBSL, Puig I, Bustamante-Balén M, Coron E, Dobru DE, et al. Curriculum for optical diagnosis training in Europe: European Society of Gastrointestinal Endoscopy (ESGE) Position Statement. Endoscopy. 2020;52:899-923.
26. Carballal S, Maisterra S, López-Serrano A, Gimeno-García AZ, Vera MI, Marín-Garbriel JC, et al. Real-life chromoendoscopy for neoplasia detection and characterisation in long-standing IBD. Gut. 2018;67:70-78.
27. Iacucci M, McQuaid K, Gui XS, Iwao Y, Lethebe BC, Lowerison M, et al. A multimodal (FACILE) classification for optical diagnosis of inflammatory bowel disease associated neoplasia. Endoscopy. 2019;51:133-141.
28. Misawa M, Kudo SE, Ogata N. Two cases of colitis-associated neoplasia observed with endocytoscopy. Dig Endosc. 2019;31 Suppl 1:43-44.
29. Maeda Y, Kudo SE, Ogata N, Misawa M, Mori Y, Mori K, et al. Can artificial intelligence help to detect dysplasia in patients with ulcerative colitis? Endoscopy. 2021;53:E273-E274.
30. López-Serrano A, Díaz R, Besó P, Algarra A, Santonja FL, MAchancoses A, et al. Effect of an artificial intelligence system in the detection of displasias during colonoscopy in patients with long-standing ulcerative colitis. Preliminary results. Endoscopy. 2022;54:S17-S18
31. Alkandari A, Thayalasekaran S, Bhandari M, Przybysz A, Bugajski M, Bassett P, et al. Endoscopic Resections in Inflammatory Bowel Disease: A Multicentre European Outcomes Study. J Crohns Colitis. 2019;13:1394-1400.
32. Ngamruengphong S, Aihara H, Friedland S, Nishimura M, Faleck D, Benias P, et al. Endoscopic submucosal dissection for colorectal dysplasia in inflammatory bowel disease: a US multicenter study. Endosc Int Open. 2022;10:E354-E360.




