Redacción Farmacosalud.com
El fármaco trastuzumab deruxtecán ha sido recomendado para su aprobación en la Unión Europea (UE) como monoterapia para el tratamiento en pacientes con cáncer de mama HER2 positivo no resecable y/o metastásico que han recibido uno o más regímenes previos anti-HER2. Trastuzumab deruxtecán es un anticuerpo conjugado (ADC, del inglés antibody drug conjugate) dirigido específicamente a HER2 que está siendo desarrollado y comercializado conjuntamente por Daiichi Sankyo y AstraZeneca.
El Comité de Medicamentos de Uso Humano (CHMP) de la Agencia Europea de Medicamentos (EMA) ha basado su opinión positiva en los resultados del ensayo clínico de fase 3 DESTINY-Breast03 publicados en ‘The New England Journal of Medicine’. En este ensayo, el ADC redujo el riesgo de progresión de la enfermedad o muerte en un 72% frente a trastuzumab emtansina (T-DM1) (Hazard ratio [HR] = 0,28; intervalo de confianza [IC] del 95%: 0,22-0,37; p<0,0001) en pacientes con tumor mamario HER2 positivo no resecable y/o metastásico previamente tratados con trastuzumab y un taxano.
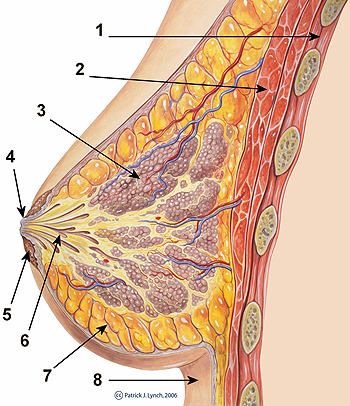
Sección representativa de la anatomía del pecho. 1. Caja torácica; 2. Músculos pectorales; 3. Lóbulos; 4. Superficie del pezón; 5. Aureola; 6. Conducto de leche; 7. Tejido adiposo; 8. Piel
Autor/a de la imagen: Patrick J. Lynch, medical illustrator
Patrick J. Lynch. Reworked by Morgoth666 to add numbered legend arrows
Fuente: Wikimedia Commons
1 de cada 5 casos de cáncer de mama son HER2 positivo
Aún no se ha alcanzado la mediana de supervivencia libre de progresión (SLP) en los pacientes tratados con este ADC (IC del 95%: 18,5-NE) frente a los 6,8 meses de T-DM1 (IC del 95%: 5,6-8,2) según un comité ‘ciego’ de revisión central independiente (BICR, por sus siglas en inglés "blinded independent central review"). La recomendación será revisada a continuación por la Comisión Europea, que tiene la autoridad para conceder las autorizaciones de comercialización para los medicamentos en la UE.
En Europa, se diagnostican anualmente alrededor de 530.000 casos de cáncer de mama1. Aproximadamente, 1 de cada 5 casos de cáncer de mama son considerados HER2 positivo2. Pese al tratamiento inicial con trastuzumab, pertuzumab y un taxano, los pacientes aquejados de tumor mamario metastásico HER2 positivo manifiestan una progresión de la afección frecuentemente3,4. Se necesitan más opciones de tratamiento para retrasar aún más la progresión y prolongar la supervivencia3,5,6.
No se han identificado nuevos problemas de seguridad
Resultados adicionales del ensayo de fase 3 DESTINY-Breast03 mostraron que en el análisis del criterio de valoración secundario de la SLP evaluado por los investigadores, los pacientes tratados con este ADC consiguieron una mejora en la SLP de 25,1 meses (IC del 95%: 22,1-NE) en comparación con los 7,2 meses (IC del 95%: 6,8-8,3) de T-DM1 (HR=0,26; IC del 95%: 0,20-0,35). Se observó una marcada tendencia hacia la mejora de la supervivencia global (SG) con este ADC (HR=0,56; IC del 95%: 0,36-0,86; p=0,007172); sin embargo, este análisis aún no es maduro y no es estadísticamente significativo. Casi todos los pacientes tratados con este ADC seguían con vida al cabo de un año (94,1%; IC del 95%: 90,3-96,4) en comparación con el 85,9% de los pacientes tratados con T-DM1 (IC del 95%: 80,9-89,7). La tasa de respuesta objetiva (TRO) confirmada en el grupo de este ADC fue más del doble que en el grupo de T-DM1 (79,7% [n=208; IC del 95%: 74,3-84,4] frente al 34,2% [n=90; IC del 95%: 28,5-40,3]).
El perfil de seguridad de los acontecimientos adversos más frecuentes en DESTINY-Breast03 fue consistente con el observado en ensayos clínicos previos, ya que no se han identificado nuevos problemas de seguridad. Los acontecimientos adversos relacionados con el fármaco más frecuentes de grado 3 o superior en el grupo de este ADC fueron neutropenia (19,1%), trombocitopenia (7,0%), leucopenia (6,6%), náuseas (6,6%), anemia (5,8%), fatiga (5,1%), vómitos (1,6%), elevación de alanina aminotransferasa (1,6%), pérdida de apetito (1,2%), elevación de aspartato aminotransferasa (0,8%), diarrea (0,4%) y alopecia (0,4%).
En general, el 10,5% de los pacientes tuvo enfermedad pulmonar intersticial (EPI) o neumonitis relacionada con el tratamiento según determinó un comité independiente de adjudicación. La mayoría de los casos de EPI (9,7%) fueron de bajo grado (grado 1 (2,7%) o grado 2 (7,0%)) con dos casos notificados de grado 3 (0,8%). No se dio ningún caso de EPI ni neumonitis de grado 4 ni de grado 5.
Referencias
1. Globocan 2020. Europe Fact Sheets. Available at: https://gco.iarc.fr/today/data/factsheets/populations/908-europe-fact-sheets.pdf. Último acceso: Junio 2022.
2. Ahn S, et al. HER2 status in breast cancer: changes in guidelines and complicating factors for interpretation. J Pathol Transl Med. 2020; 54(1): 34-44.
3. Barok M, et al. Trastuzumab emtansine: mechanism of action and drug resistance. Breast Cancer Res. 2014; 16(2):209.
4. Nader-Marta G, et al. How we treat patients with metastatic HER2-positive breast cancer. ESMO Open. 2022; 7:1.
5. Mounsey L, et al. Changing Natural History of HER2-Positive Breast Cancer Metastatic to the Brain in the Era of New Targeted Therapies. Clin Breast Cancer. 2018; 18(1):29-37.
6. Martinez-S Sáez O, et al. Current and Future Management of HER2-Positive Metastatic Breast Cancer. JCO Oncol Pract. 2021. 10.1200/OP.21.00172.




