Redacción Farmacosalud.com
Varios han sido los avances presentados en el Congreso de la American Society of Clinical Oncology (Sociedad Americana de Oncología Clínica, ASCO) de este 2022:
Trastuzumab deruxtecan, opción para el cáncer de mama avanzado con bajo HER2
Investigadores del Hospital Clínic-IDIBAPS, el Instituto Catalán de Oncología (ICO) y del Vall d'Hebron Instituto de Oncología (VHIO), que forma parte del Campus Vall d'Hebron (Barcelona), han participado en un estudio internacional que demuestra la eficacia de un nuevo fármaco para el cáncer de mama metastásico con una baja expresión de HER21. El tratamiento logra doblar la supervivencia sin progresión de la enfermedad en las pacientes con este tipo de tumor, respecto a los tratamientos estándar. El artículo ha sido publicado en el ‘New England Journal of Medicine’ (NEJM). El trastuzumab deruxtecan es un nuevo medicamento que conjuga un anticuerpo monoclonal (el trastuzumab) con un quimioterápico (el deruxtecan) y ha sido aprobado recientemente para el tratamiento del cáncer de mama metastásico HER2+ por la Agencia del medicamento de Estados Unidos (FDA) y de Europa (EMA). Ahora, esta terapia puede dirigirse también a células tumorales que expresen niveles bajos de HER2 y transportar la carga citotóxica a estas células tumorales pero también a las células vecinas sin expresión del HER2, un efecto conocido como ‘bystander’.

(de izq. a dcha): los Drs. Maria Vidal, Miguel Gil, Cristina Saura y Aleix Prat, coautores del estudio
Autor/a de la imagen. Francisco Avia
Fuente: Hospital Clínic / ICO / VHIO / IDIBAPS
Los niveles de HER2, una proteína que se encuentra en el exterior de las células tumorales, se determinan de forma rutinaria para decidir cuál es la estrategia de tratamiento adecuada para el tumor mamario. En el caso de los tumores metastásicos HER2 negativos, se ha visto que el 55% no tienen amplificación del gen HER2 (por tanto, hasta ahora son considerados como HER2-negativos) pero el 70% de éstos expresan niveles bajos de la proteína HER2 (HER2-low, definido como "1+" o "2+"). Estos tumores HER2-low son un grupo muy heterogéneo que incluye otros dos subtipos en función de si las células tumorales expresan o no receptores hormonales (RH): RH positivo o RH negativo.
"Hasta ahora, las pacientes con tumores HER2-negativos no se beneficiaban de tratamientos contra el HER2 como el trastuzumab, un anticuerpo que ha cambiado la evolución del cáncer de mama HER2-positivo", explica el Dr. Aleix Prat, miembro del comité directivo responsable del ensayo clínico, oncólogo del Hospital Clínic, jefe del grupo Genómica traslacional y terapias dirigidas en tumores sólidos del IDIBAPS y Prof. de la Universidad de Barcelona (UB). "Ahora, gracias a este nuevo fármaco inmunoconjugado, que combina 7-8 moléculas de una quimioterapia muy potente con el anticuerpo trastuzumab, se prolonga la supervivencia de las pacientes", añade. La supervivencia libre de progresión fue de cerca de 10 meses cuando se utilizó el trastuzumab deruxtecan y de 5,1 meses con la quimioterapia habitual. La supervivencia media fue de 23,4 meses frente a cerca de 17 meses haciendo la misma comparativa.
Patritumab deruxtecán, prometedor en cáncer de mama o pulmón metastásicos
Los nuevos datos de patritumab deruxtecán (HER3-DXd) de Daiichi Sankyo muestran respuestas clínicamente significativas y duraderas en dos ensayos clínicos en fases iniciales en pacientes con cáncer de mama metastásico con expresión de HER3 o cáncer de pulmón no microcítico (CPNM) avanzado sin mutaciones activadoras de EGFR. Este anticuerpo conjugado (ADC) dirigido a HER3 tiene el potencial de ser el primero de su clase.

Autor/a de la imagen: Enric Arandes / www.farmacosalud.com
Fuente: E. Arandes / www.farmacosalud.com
Los resultados de un pooled análisis (análisis combinado) del primer ensayo clínico de fase I/II en humanos, de tres partes, en el que se evalúa este ADC (n=182), mostraron respuestas clínicamente significativas y duraderas tras una mediana de seguimiento de 31,9 meses (rango, 15-56) en pacientes con tres subtipos diferentes de tumor mamamrio metastásico con expresión de HER3, que incluyen cáncer de mama RH positivo/HER2 negativo, triple negativo y HER2 positivo. Las respuestas se observaron en diferentes niveles de expresión de HER3. Se observó una tasa de respuesta objetiva (TRO) del 30,1% (IC 95%: 21,8-39,4) con este ADC en una cohorte de 113 pacientes con cáncer de mama metastásico con expresión alta y baja de HER3, RH positivo/HER2 negativo, por un comité ciego de revisión central independiente (BICR, por sus siglas en inglés). Se observaron respuestas parciales (RP) en el 30,1% de los pacientes y estabilización de la enfermedad en el 50,4%. La mediana de duración de la respuesta (DR) no se había alcanzado todavía a los 7,2 meses (IC 95%: 5,3-NE). La mediana de supervivencia libre de progresión (SLP) fue de 7,4 meses (IC 95%: 4,7-8,4) y la mediana de supervivencia global (SG) de 14,6 meses (IC 95%: 11,3-19,5).
En la cohorte de 53 pacientes con cáncer de mama metastásico triple negativo (CMTN) con expresión alta de HER3, se observó una TRO del 22,6% (IC 95%: 12,3-36,2) con este ADC en 53 pacientes, evaluada mediante BICR. Se observaron RP en el 22,6% de los pacientes y estabilización de la enfermedad en el 56,6%. La mediana de duración de la respuesta fue de 5,9 meses (IC 95%: 3,0-8,4). La mediana de SLP fue de 5,5 meses (IC 95%: 3,9-6,8) y la correspondiente a la SG de 14,6 meses (IC 95%: 11,2-17,2). Se observó una TRO del 42,9% (IC 95%: 17,7-71,1) con este ADC en una cohorte de 14 pacientes con cáncer de mama metastásico HER2 positivo con expresión alta de HER3, evaluada mediante BICR. Se observaron RP en el 42,9% de los pacientes y estabilización de la enfermedad en el 50%. La mediana de DR fue de 8,3 meses (IC 95%: 2,8-26,4). La mediana de SLP fue de 11,0 meses (IC 95%: 4,4-16,4) y la correspondiente a la SG no se había alcanzado todavía a los 19,5 meses (IC 95%: 12,2-NE).
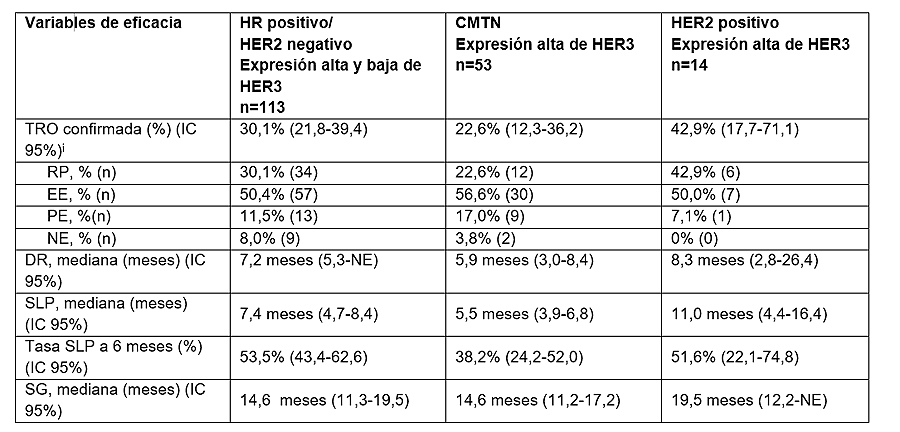
Resumen de los resultados del ensayo clínico de fase I/II en cáncer de mama con expresión de HER3
BICR, blinded independent central review (revisión central ciega independiente); DR, duración de la respuesta; HER, receptor del factor de crecimiento epidérmico humano; HR, receptores hormonales; NE, no evaluable; TRO, tasa de respuesta objetiva; SG, supervivencia global; PE, progresión de la enfermedad; SLP, supervivencia libre de progresión; RP, respuesta parcial; RECIST, Response Evaluation Criteria In Solid Tumors (Criterios de evaluación de la respuesta en tumores sólidos); EE, estabilización de la enfermedad; CMTN, cáncer de mama triple negativo
i Intervalo de confianza binomial exacto del 5% (según el método de Clopper-Pearson).
Difusión: Daiichi Sankyo
Por otra parte, los primeros resultados preliminares de una de las cohortes de un ensayo clínico de fase I en curso mostraron respuestas duraderas con este ADC tras una mediana de seguimiento de 19,7 meses (rango, 13,8-29,2) en pacientes con CPNM avanzado o metastásico sin mutaciones de EFGR comunes (EX19del, L858R, L861Q o G719X). Se observó una TRO del 28,6% (IC 95%: 11,3-52,2) con este ADC en 21 pacientes con CPNM avanzado o diseminado con mutaciones accionables de EGFR identificadas, evaluada mediante BICR. Se observaron 6 RP y 10 casos de estabilización de la enfermedad en estos pacientes. Se observó una tasa de control de la enfermedad (TCE) del 76,2% (IC 95%: 52,8-91,8) y la mediana de DR no se había alcanzado todavía a los 9,4 meses (IC 95%: 4,2-NE). La mediana de SLP era de 10,8 meses (IC 95%: 2,8-16,0). Se observaron respuestas con este ADC en pacientes que presentaban diversos tipos de mutaciones accionables, incluyendo mutaciones de KRAS/NRAS, fusiones de los genes ALK y ROS1 y la inserción en el exón 20 de EGFR (EGFR Ex20ins), entre otras.
En los pacientes con CPNM sin mutaciones accionables se observó una TRO del 26,9% (IC 95%: 11,6-47,8) con este ADC en 26 pacientes, evaluada mediante BICR. Se observó una respuesta completa (RC), seis RP y 12 casos de estabilización de la enfermedad. La mediana de DR fue de 9,6 meses (IC 95%: 1,6-NE) y la TCE, del 73,1% (IC 95%: 52,2-88,4).

Fuente: Archivo
Nivolumab + ipilimumab + ‘quimio’ en tumor pulmonar
Bristol Myers Squibb comunica los resultados de seguimiento a tres años del ensayo de fase 3 CheckMate -9LA, en el que demuestra beneficios duraderos en supervivencia global con nivolumab (Opdivo) más ipilimumab (Yervoy) con dos ciclos de quimioterapia en comparación con cuatro ciclos de quimioterapia en pacientes con cáncer de pulmón no microcítico metastásico (CPNMm) no tratados previamente.
Con un seguimiento mínimo de tres años (36,1 meses), nivolumab más ipilimumab con dos ciclos de quimioterapia siguió mostrando una mejora mantenida de la supervivencia global (SG), el objetivo principal del ensayo. Un 27% de los pacientes tratados con nivolumab más ipilimumab con dos ciclos de quimioterapia estaban vivos, en comparación con el 19% de los pacientes tratados con quimioterapia a los tres años (cociente de riesgo [CR] 0,74; Intervalo de confianza [IC] del 95 %: 0,62 a 0,87).
Bendamustina-Rituximab + ibrutinib en linfoma de células del manto (LCM)
Janssen Pharmaceutical Companies of Johnson & Johnson anuncian los resultados principales del estudio SHINE de fase 3 (Resumen N.º 7502), que demuestran que la combinación de ibrutinib oral una vez al día y bendamustina-rituximab (BR) y mantenimiento con rituximab redujo significativamente el riesgo de progresión de la enfermedad o muerte en un 25% en comparación con placebo más BR y mantenimiento con rituximab en pacientes con linfoma de células del manto (LCM) mayores de 65 años sin tratamiento previo no candidatos a trasplante.
Autor/a: Enric Arandes
Fuente: E. Arandes / www.farmacosalud.com
Este estudio es uno de los mayores ensayos clínicos realizados jamás en el LCM en primera línea y el primero de un inhibidor de la tirosina quinasa de Bruton (BTKi)2. “SHINE es un estudio que analizó el tratamiento de primera línea en pacientes de edad avanzada con LCM, que se enfrentan a malos resultados porque normalmente no toleran la terapia intensiva”, señala el Dr. Martin Dreyling, del servicio de Medicina III del Hospital LMU de Munich (Alemania). “Los resultados demuestran el potencial de esta combinación de ibrutinib como tratamiento de primera línea para estos pacientes”, agrega.
Breyanzi, con respuestas completas en linfoma de células B
Por su parte, Bristol Myers Squibb da a conocer resultados del análisis principal de PILOT, un estudio multicéntrico de fase 2 que evalúa el uso de Breyanzi (lisocabtagene maraleucel, liso-cel) en adultos con linfoma de células B grandes (LCBG) en recaída o refractario, considerados no candidatos a recibir quimioterapia de alta dosis ni trasplante de células madre hematopoyéticas (TCMH), después del tratamiento de primera línea.
El estudio PILOT incluyó a una amplia población de adultos con LCBG en recaída o refractario después del tratamiento de primera línea que no eran considerados candidatos para trasplante por su edad, estado general y/o función orgánica y comorbilidades, e independientemente del tiempo hasta la recaída después del tratamiento de primera línea. Con una mediana de seguimiento de 12,3 meses, la mayoría de los pacientes tratados con liso-cel (n=61) presentó una reducción de la enfermedad, con respuesta al tratamiento en un 80% de los pacientes (tasa de respuesta global; IC del 95%: 68,2 – 89,4), alcanzándose una respuesta completa en el 54% de los casos (RC; 95% IC:40,8-66,9). Las respuestas a liso-cel fueron duraderas, con una mediana de duración de la respuesta de 12,1 meses (IC del 95%: 6,2-No alcanzada) a los 15,5 meses de mediana de seguimiento. En los pacientes que alcanzaron una respuesta completa, la mediana de duración de la respuesta fue de 21,7 meses (IC del 95%: 12,7–No alcanzada).
Ciltacabtagén autoleucel y teclistamab en mieloma múltiple

Autor/a de la imagen: E. Arandes / www.farmacosalud.com
Fuente: www.farmacosalud.com
Janssen of Johnson & Johnson, asimismo, ha hecho públicos resultados actualizados del estudio CARTITUDE-1 de fase 1b/2 que evalúa el perfil de eficacia y seguridad de CARVYKTI® (Ciltacabtagén autoleucel; cilta-cel), una terapia de células T con receptor de antígeno quimérico (CAR-T) que incluye dos anticuerpos de dominio único frente al antígeno de maduración de células B (BCMA). El estudio incluyó a pacientes con mieloma múltiple en recaída o refractario, que habían recibido al menos tres líneas de tratamiento, que incluían un agente inmunomodulador (IMiD), un inhibidor del proteasoma (IP) y un anticuerpo anti-CD38 o que eran doblemente refractarios a un IMiD y a un IP y que habían recibido un IP, un IMiD y un anti-CD38 como parte de la terapia anterior.
Los pacientes expuestos a las tres clases terapéuticas suelen experimentar peores resultados, tal y como se muestra en un estudio reciente que indica que estos pacientes tienen una mediana de supervivencia global (SG) de 9,3 meses3. Los nuevos resultados de CARTITUDE-1 mostraron que, tras un seguimiento de casi 28 meses (27,7), en los 97 pacientes tratados con cilta-cel, la tasa de respuesta global (TRG) siguió siendo del 98% [intervalo de confianza (IC) del 95%; 92,7–99,7], alcanzando un 83% (IC del 95%; 73,4-89,4) de los pacientes tratados con cilta-cel una respuesta completa estricta (RCe). Las respuestas fueron duraderas, y la mediana de la SG y de la supervivencia libre de progresión (SLP) no se habían alcanzado en la mediana del seguimiento publicada. Las tasas de SLP y SG a 28 meses de seguimiento fueron del 55% (IC del 95%; 44,0 a 64,6) y del 70% (IC del 95%; 60,1 a 78,6), respectivamente4.
A todo esto, se han presentado resultados actualizados del perfil de eficacia y seguridad del estudio MajesTEC-1 de fase 1/2 de teclistamab5. Teclistamab es un anticuerpo biespecífico en investigación, listo para usar, redireccionador de linfocitos T, frente al antígeno de maduración de los linfocitos B (BCMA), que se está estudiando en pacientes con mieloma múltiple en recaída o refractario (MMRR).
El estudio MajesTEC-1 de fase 1/2, abierto y de múltiples cohortes, investiga el perfil de seguridad y eficacia de teclistamab en pacientes con MMRR que han recibido al menos tres líneas de tratamiento previo, incluido un fármaco inmunomodulador, un inhibidor del proteasoma y un anticuerpo anti-CD38. Desde marzo de 2022, 165 pacientes han recibido tratamiento con teclistamab a la dosis recomendada en la fase 2 (RP2D) por vía subcutánea (SC) de 1,5 mg/kg precedida de dosis escalonadas de 0,06 y 0,3 mg/kg en la fase 1 (NCT03145181) y en la fase 2 (NCT04557098) del estudio. Con una mediana de seguimiento de 14,1 meses (rango de 0,26 a 24,4), se observó una tasa de respuesta global (TRG) del 63% (intervalo de confianza [IC] del 95%, rango de 55,2 a 70,4) en pacientes con mieloma múltiple previamente tratados con tres grupos farmacológicos, con una respuesta completa (RC) o mejor alcanzada en el 39,4% de los pacientes5.
Aunque los datos de duración de la respuesta no son maduros, la mediana de duración de la respuesta en este momento es de 18,4 meses, y no se ha alcanzado en los pacientes que consiguieron una RC o mejor (IC del 95 por ciento; 14.9 no estimable). Esto sugiere que las respuestas a teclistamab fueron duraderas y se profundizaron con el tiempo. La supervivencia libre de progresión (SLP) media fue de 11,3 meses (IC del 95%: 8,8–17,1)5.
Scemblix®, con eficacia en leucemia mieloide crónica

Autor/a: Enric Arandes
Fuente: E. Arandes / www.farmacosalud.com
Novartis anuncia los datos de seguimiento a largo plazo del estudio ASCEMBL de Fase III en pacientes con leucemia mieloide crónica con cromosoma Filadelfia positivo en fase crónica (LMC Ph+ en FC) tratados previamente con dos o más inhibidores de la tirosina quinasa (ITC). En este análisis, el porcentaje de pacientes en el grupo de Scemblix® (asciminib) (n=157) que logró una respuesta molecular mayor (RMM) a las 96 semanas fue más del doble que en el grupo de Bosulif® (bosutinib) (n=76) (37,6% frente a 15,8% [p = 0,001]), un aumento significativo con respecto a los análisis anteriores6,7.
Además, la probabilidad de mantener la RMM durante al menos 72 semanas en los pacientes tratados con Scemblix fue del 96,7% (IC del 95%, 87,4%–99,2%), lo que refleja la durabilidad a largo plazo de la eficacia6.
Referencias
1. Modi S, Jacot W, Yamashita T, Sohn J, Vidal M, Tokunaga E, et al. Trastuzumab Deruxtecan in Previously Treated HER2-Low Advanced Breast Cancer. NEJM. 2022. DOI: 10.1056/NEJMoa2203690.
2. Wang M., et al. Primary results from the double-blind, placebo-controlled, phase III SHINE study of ibrutinib in combination with bendamustine-rituximab (BR) and R maintenance as a first-line treatment for older patients with mantle cell lymphoma (MCL). 2021 American Society of Clinical Oncology Annual Meeting. June 3-7, 2022.
3. Gandhi UH, Cornell RF, Lakshman A, et al. Outcomes of patients with multiple myeloma refractory to CD38-targeted monoclonal antibody therapy. Leukemia 2019; 33: 2266–75.
4. Usmani, S. Phase 1b/2 study of ciltacabtagene autoleucel, a BCMA-directed CAR-T cell therapy, in patients with relapsed/refractory multiple myeloma (CARTITUDE-1): Two years post-LPI. Abstract #8028 [Poster]. Presented at the 2022 American Society of Clinical Oncology Annual Meeting.
5. Nooka A et al. Teclistamab, a B-cell maturation antigen (BCMA) x CD3 bispecific antibody, in patients with relapsed/refractory multiple myeloma (RRMM): Updated efficacy and safety results from MajesTEC-1. 2022 ASCO Annual Meeting – American Society of Clinical Oncology. June 2022.
6. Cortes JE, et al. Oral presentation at ASCO 2022; June 3-7, 2022. Chicago, IL and virtual. Abstract 7004.
7. Rea D, et al. A Phase 3, Open-Label, Randomized Study of Asciminib, a STAMP Inhibitor, vs Bosutinib in CML After≥ 2 Prior TKIs. Blood. 2022. DOI: 10.1182/blood.2020009984. PMID: 34407542.




