1. Introducción
El tumor vesical (TV) es la quinta neoplasia más frecuente a nivel mundial, con más de 54.000 nuevos casos anuales en países como Estados Unidos1. Se trata de una de las neoplasias con mayor heterogeneicidad genética, asociada a unos elevados costes económicos y un impacto en la calidad de vida de los pacientes dada la necesidad de un seguimiento invasivo estricto por su alta tendencia a la recurrencia y progresión2. Tanto las guías de la European Association of Urology (EAU) como de la American Urological Association (AUA) sugieren que el seguimiento de los pacientes con tumor vesical no músculo infiltrante (TVNMI) se base en el uso combinado de la cistoscopia, citología y pruebas de imagen para valorar el tracto urinario superior3,4. No obstante, la cistoscopia es un proceso invasivo que conlleva el riesgo de disuria, polaquiuria y hematuria macroscópica hasta en un 50%, 37% y 19%, respectivamente5, mientras que la citología demuestra una muy baja sensibilidad, especialmente en tumores no músculo infiltrantes de bajo riesgo6,7.
Dr. Fernando Lozano Palacio
Fuente: Dr. Lozano Palacio
Por estos motivos, en los últimos años existe un crecimiento exponencial en la investigación de biomarcadores para el estudio de la hematuria, el diagnóstico y el seguimiento del TV. Han sido diversos los biomarcadores utilizados en dichos escenarios; aquellos basados en el estudio de material genético (tanto DNA como RNA) parecen los más prometedores dado que son capaces de identificar la huella genética tumoral. De entre todos estos, aquellos basados en la epigenética, cambios heredables en la expresión génica que no son secundarios a una alteración en la secuencia del DNA8, parecen cumplir las características necesarias de reproductibilidad y fiabilidad para poder ser trasladados a la práctica clínica. Las alteraciones epigenéticas se dividen en metilaciones de DNA, alteraciones en las histonas e inactivaciones en los microRNA (miRNA). De todas ellas, las más estudiadas son las metilaciones del DNA. Inicialmente se identificaron las hipometiliaciones del DNA en tumores humanos9 y, posteriormente, la identificación de hipermetilaciones de los genes supresores tumorales10.
El campo de la investigación de los biomarcadores en el TV se centra en lograr un test seguro para el paciente, no invasivo, apoyado en una adecuada estrategia coste-efectiva de seguimiento que pueda mejorar la sensibilidad de los métodos actualmente establecidos como gold estándar en el seguimiento del TV no músculo infiltrante.
El test Bladder EpiCheck® (Nucleix Ltd, distribuido por Palex Medical) [BE] es un nuevo marcador urinario basado en la detección de cambios en la metilación del DNA de 15 loci genómicos que presentan una elevada prevalencia en las células del TV. Para ello se utilizan diez mililitros de orina; posteriormente es extraído el DNA genómico de las células mediante centrifugación y digerido, utilizando enzimas específicas sensibles a DNA metilado que se adhieren a aquellos sitios del genoma que no presentan metilación, dejando intactas las secuencias metiladas. Posteriormente, el estado de metilación de los 15 biomarcadores es valorado mediante PCR (polymerase chain reaction) en tiempo real y analizado utilizando un software específico, que posteriormente ofrece un valor numérico denominado EpiScoreTM. Después, dentro de un rango de 0-100, valores por encima de 60 son transformados en un resultado cualitativo de “positivo” para carcinoma urotelial.
El objetivo de este artículo es analizar la literatura existente en el uso de este biomarcador urinario genético en el escenario del seguimiento del TV no músculo infiltrante.
2. Adquisición de la evidencia
Este artículo es una revisión narrativa. Se ha realizado una búsqueda en las principales bases de datos, Medline (http://www.ncbi.nlm.nih.gov), Embase (http://www.embase.com) y Cochrane library (http://www.cochrane.org) el 31/01/2021, utilizando las combinaciones de palabras clave de “urinary biomaker”, “surveillance” y “Bladder EpiCheck®”. Dentro de los parámetros de búsqueda no se ha incluido restricción de lenguaje y se han seleccionado sólo artículos originales y comunicaciones a congresos internacionales. Respecto a la población de estudio, se han seleccionado sólo artículos en pacientes adultos que estén en seguimiento por tumor vesical no músculo infiltrante de cualquier grado (carcinoma in situ – CIS, carcinoma papilar no invasivo Ta, carcinoma invasor del tejido conectivo subepitelial - T1; sin afectación ganglionar clínica- cN0, ni metástasis a distancia - cM0) de acuerdo con el sistema de estadiaje TNM (tumor – nodes – metastasis). Dos artículos11,12 incluían solamente en el estudio pacientes con una resección transuretral (RTU) en los últimos doce meses.
Los objetivos primarios fueron sensibilidad y especificidad del BE en el seguimiento. Ambos fueron comparados con el gold estándar establecido por las EAU Guidelines, es decir, cistoscopia y citología y, en caso de positividad, los resultados histológicos. Otros valores ofrecidos por los estudios son el Episcore de los pacientes, variable cuantitativa continua. En esta revisión, hemos excluido el trabajo de Boisser R y Breda A, dado que valora el seguimiento en tumores de vías altas (Boisser R and Breda A et al. Clinicaltrials.gov).
Con estos parámetros se han encontrado nueve trabajos originales con 1993 pacientes.
Todos los estudios fueron prospectivos, simple ciegos, con un brazo único de cohortes, cinco de ellos multicéntricos11–15 y cuatro unicéntricos16–19.
3. Resultados
Los resultados obtenidos en los diversos estudios se encuentran resumidos en la Tabla 1.
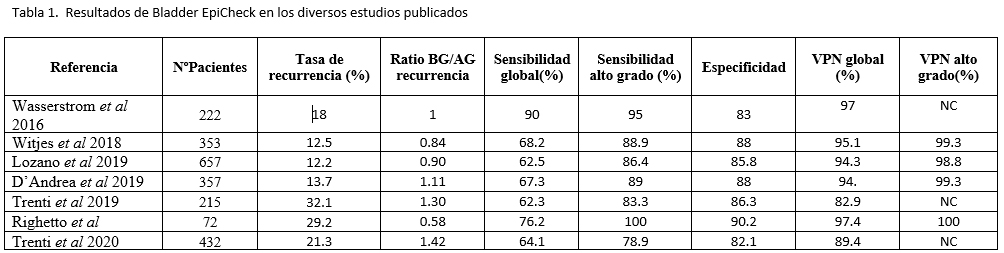
NC: no conocido; VPN: valor predictivo negativo; BG: bajo grado; AG: alto grado
El primer trabajo publicado de validación sobre el uso de BE es una comunicación de 2016 de Wasserstrom et al16 en la que se exponen los primeros resultados en una cohorte de 222 pacientes con el biomarcador, presentando una sensibilidad global del 90%, una especificidad global del 83% y un valor predictivo negativo (VPN) del 97%. El trabajo enfatiza que la sensibilidad de BE cambia en función del grado y el estadio tumoral a medida que estos aumentan (81%, 100%, 100%, 91%, en Ta, T1, T2 y CIS, respectivamente, 84% en bajo grado, y 95% en tumores de alto grado).
Posteriormente se publica el artículo de Witjes et al11 en el que se analizan en un estudio multicéntrico a 353 pacientes durante su primer año de seguimiento post resección transuretral de tumor vesical no músculo infiltrante. Similar a los resultados del estudio previo, la sensibilidad global se situó en el 68.2% (91.7% para las recidivas de alto grado (AG)) y la especificidad global en el 88%. Los autores destacan el VPN del biomarcador, que se sitúa en el 95.1% y, si se excluyen las recidivas de bajo grado, llega al 99.3%.
Lozano et al15 presentan un año después una ampliación de dicho estudio en el que, pese a aumentar la cohorte hasta 657 pacientes, los valores de sensibilidad (62.5% y 86.4% en los casos de alto grado), especificidad (85.8%) y el VPN (94.3% y 98.8% si seleccionamos las recidivas de AG) se mantuvieron estables.
D’Andrea et al12 publica un estudio multicéntrico, con 357 pacientes. BE presenta una sensibilidad global del 67.3% y una especificidad del 88%. En caso de recidivas de alto grado, estos valores son del 88.9% y 88% respectivamente. Asimismo, en un análisis multivariante realizado en el estudio, BE se correlaciona de manera independiente con la presencia de una recidiva (OR 18.1) y de recidiva de AG (OR 78.3). Con los resultados obtenidos, generan dos nomogramas multivariados para la predicción de la presencia de tumores vesicales de cualquier grado o estadio, respectivamente. Igualmente, los autores realizan una aproximación para valorar la utilidad en la toma de decisiones en la práctica clínica diaria con BE.
En todos los estudios se evaluó la sensibilidad global y se discriminó entre las neoplasias de bajo y alto grado. Otros parámetros estadísticos evaluados en la mayoría de los estudios fueron los valores predictivos positivo y negativo (VPP y VPN) y el área bajo la curva (AUC), utilizando la variable continua del Episcore.
Trenti et al publican dos artículos sobre el uso de BE en el seguimiento del TVNMI. El primero13, en 2019, recoge los resultados de 215 pacientes, con una sensibilidad global del 62.3% (83.3% en AG). La especificidad de BE fue del 86.3%. El VPP fue del 68.2% y el VPN total fue del 82.9% (el VPN en alto grado se puede calcular en base a los datos reportados=126/131=96.2%). El área debajo de la curva (AUC) fue del 0.785. En el mismo artículo, los autores evalúan la posibilidad de combinar BE con la citología de orina. La citología en este trabajo presenta una sensibilidad global del 33% que se incrementa hasta el 67% cuando se combinan ambos tests. Por el contrario, los autores no encontraron mejoría en el VPN y VPP de ambas pruebas al combinarlas. Particularmente, la sensibilidad para los casos de TVNMI de bajo grado varía entre el 8% de la citología al 46% de BE, mientras que la combinación resulta en una sensibilidad del 56%. En cambio, la sensibilidad de los TVNMI de alto grado era del 67% a nivel de citología y del 83% para BE (utilizados como única técnica), mientras que la combinación de ambos resulta en una sensibilidad del 90%. Los autores no encontraron una ventaja significativa en la combinación de ambos tests a nivel de VPN y VPP. En su segundo trabajo, Trenti et al14 presentan un estudio comparativo de dos biomarcadores, BE y Xpert Bladder Cancer Monitor test (XBCMT). En el diseño del estudio, los autores, aparte del seguimiento establecido por las EAU Guidelines, comparan la utilidad de ambos marcadores para el mismo paciente en este escenario. Se trata de un estudio con 432 pacientes, en los que obtienen un resultado de sensibilidad global del 64.13% para BE y del 66.3% para XBCMT. La sensibilidad para alto grado se incrementa hasta el 78.95% en ambos biomarcadores.
La especificidad, tal y como ocurre en el resto de trabajos, es más elevada en el caso de la citología de orina (98.82%) respecto a BE (82.06%) y XBCMT (76.47%). El VPP de BE fue del 49.17% y de XBCMT del 43.26%. El VPN fue del 89.42% para BE y del 89.35% para XBCMT. El AUC fue del 73.8% para BE y del 81% para XBCMT. Posteriormente, evalúan la combinación de ambos tests, considerando positivo si así lo indica alguno de los dos. Con ello, logran obtener una sensibilidad del 92.11% para alto grado y un AUC del 83%.
Por otro lado, Righetto et al19 comunican un poster en 2019 con 75 pacientes (aunque sólo 54 son en contexto de seguimiento), en los que indican una especificidad, una sensibilidad de alto grado y un VPN en alto grado del 100%.
Analizando los diversos trabajos, la sensibilidad de la citología es inferior en todos ellos a la sensibilidad de BE, con porcentajes de entre el 27%14 y el 38%16. Esto se acentúa en los tumores de bajo grado, con unos porcentajes de entre 0-13%, mejorando significativamente los valores de BE en el alto grado (100% de sensibilidad). Otro punto a remarcar es que el VPN de BE es superior al VPN de la citología en todos los estudios. De ahí que varios estudios apunten a la opción de complementar el valor de la citología con los resultados de BE.
Al margen de estos trabajos, Pierconti et al han publicado recientemente dos artículos en los que se explora el binomio BE y citología de orina17,20. El primero de ellos17, con 375 pacientes, todos ellos con antecedentes de tumor vesical no músculo infiltrante de alto riesgo, valora de manera retrospectiva el valor de Episcore y su correlación con los hallazgos en la citología de orina, utilizando el Paris System for Reporting Urinary Cytology21. Reportan que el 90% de los pacientes con una citología negativa presentan un Episcore <60. Por otro lado, aquellos con citología positiva para alto grado o sospechosa para alto grado se correlacionan de manera significativa con un Episcore >60 (OR de 0.05-0.03 95% CI). En la segunda publicación20, en una población de 374 pacientes con antecedentes de tumor de alto grado seguidos durante un año, correlacionaron los valores de Episcore con las diferentes categorías de Paris System for Reporting Urinary Cytology, evidenciando que en aquellos pacientes con citología negativa, todos los pacientes con Episcore <60 tuvieron una citología negativa durante el seguimiento de un año (sensibilidad 100%, VPN del 100%, especificidad del 89.9%). En el caso de citología atípica con Episcore <60, dos casos fueron positivos para alto grado durante el seguimiento (sensiblidad del 86.6% y VPN del 84.6%). Para las citologías positivas de alto grado, todos los pacientes con Episcore >60 fueron positivos para carcinomas de alto grado (especificidad del 100%, sensibilidad del 98% y VPN del 86%). Los autores infieren que la Paris System for Reporting Urinary Cytology no sólo es capaz de diferenciar las distintas categorías citológicas, sino que éstas tienen diferente traducción molecular.
4. Discusión
Pese a que las EAU Guidelines3, basándose en la premisa de no perder ninguna recidiva de alto riesgo y detectarla con la mayor precocidad posible, continúan sugiriendo que el seguimiento de los TVNMI de alto riesgo sea con cistoscopias y citologías frecuentes, dejan entrever un escenario para el uso de biomarcadores en los tumores de bajo riesgo y riesgo intermedio, donde la necesidad de un diagnóstico precoz es más relativo, y prima más el evitar un exceso de procedimientos invasivos al paciente. La principal limitación de los biomarcadores en este subgrupo de pacientes es la baja sensibilidad de los mismos para detectar recidivas22. La selección de biomarcadores en el seguimiento de los pacientes con tumor vesical debe estar basado en el escenario concreto y siguiendo los principios de las guías internacionales23.
Su utilidad y su empleo debería ajustarse e individualizarse a las necesidades de cada paciente. En aquellos de bajo riesgo o riesgo intermedio, en los que el riesgo de progresión es bajo, el empleo de BE podría evitar el uso de técnicas invasivas como la cistoscopia sin comprometer la supervivencia global (Figura 1). En los casos de pacientes de alto riesgo, en los cuales el diagnóstico precoz es fundamental para evitar la progresión, se ha sugerido la opción de alternar la cistoscopia y citología con el biomarcador. Según las Guías Europeas3, un paciente de este subgrupo será sometido a ocho cistoscopias en los dos primeros años tras la RTU de su tumor vesical. A pesar de que no existen estudios de biomarcadores adaptados a la práctica clínica diaria, el diseño de seguimiento en este escenario por parte de los centros que han comenzado a implementar este tipo de test no va enfocado a la sustitución total de la cistoscopia, sino a la idea de intercalar una exploración invasiva con una no invasiva (Fig. 1). De hecho, en las guías se apunta que los tests urinarios podrían tener un impacto positivo en la calidad del seguimiento con cistoscopias23, hecho que iría a favor de su uso conjunto en la práctica clínica diaria.
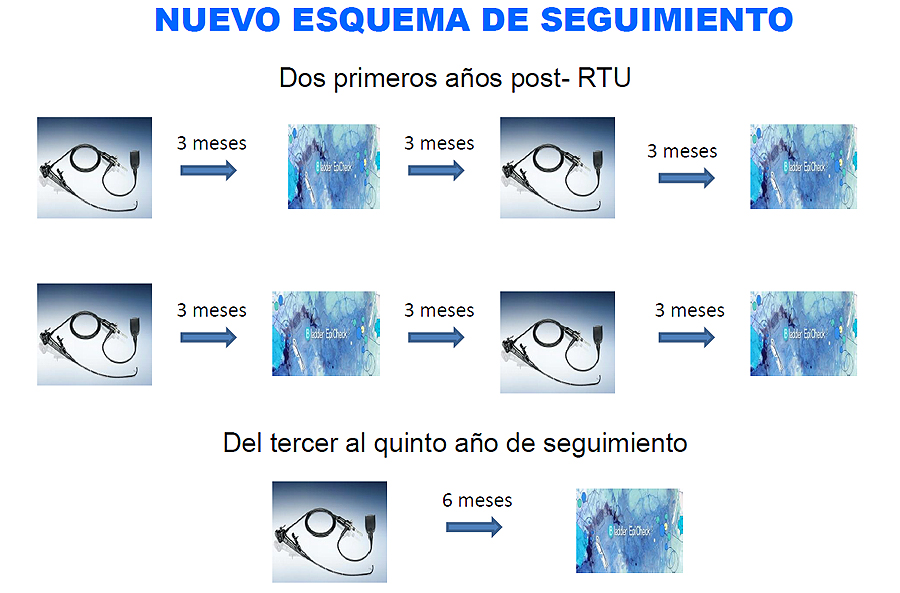
Figura 1
Elaboración propia
Comparado con otros biomarcadores disponibles en la práctica clínica diaria, BE permite detectar hasta 15 cambios en la metilación de los genes. El proceso de metilación aberrante de DNA, puede ocurrir igualmente en tejido no neoplásico24, pero es esta selección y combinación de las alteraciones en la metilación de DNA, que incluye el BE test, lo que permite distinguir con mayor sensibilidad entre entidades no neoplásicas como procesos infecciosos, inflamatorios… y el diagnóstico de una recidiva de tumor vesical.
Algo aún no explorado en la literatura respecto a BE, es la justificación del número de “falsos positivos” del test en la detección de recurrencias, que afecta de manera significativa a la especificidad del mismo. En otros artículos sobre biomarcadores, los autores justifican estos porcentajes por el ya conocido fenómeno del efecto anticipatorio, es decir, que los test en orina son capaces de detectar la neoplasia antes de su traducción en la cistoscopia. Está aceptado en la literatura que la detección anticipada por parte del test podría incluir recurrencias hasta en los siguientes 18 meses posteriores al positivo en el biomarcador25. En cualquier caso, realizar una cistoscopia en un caso de falso positivo es mucho más aceptable que perder una recidiva por un falso negativo.
Conclusiones
El cáncer de vejiga es uno de los tumores que más recursos materiales y económicos consume debido a su elevada tasa de recurrencias y los complejos protocolos de seguimiento.
Esta es la razón por la que existe una creciente inversión en biomarcadores que permitan reducir el número de exploraciones (invasivas), mejorar la calidad de vida de los pacientes y reducir costes.
En los diversos estudios publicados, BE presenta una elevada precisión diagnóstica y demuestra un buen rendimiento en el seguimiento de los pacientes con TVNMI. A pesar de que no existen ensayos clínicos que aleatoricen su uso frente al gold estándar, las futuras estrategias para su implementación pasan por su empleo en adyuvancia con las técnicas de referencia. Su elevado valor predictivo negativo permitirá evitar procedimientos invasivos a los pacientes. Incluso en los casos de “falsos positivos” puede ayudar a seleccionar población con alto riesgo genético de recidiva y a seleccionar aquellos casos que precisen una vigilancia más intensiva. Igualmente, en los casos en los que BE resulta negativo, se trataría de pacientes con un patrón de metilación más estable y, por tanto, con menor riesgo de progresión, información relevante tanto para el urólogo como para el propio paciente. Por otro lado, BE tiene una vertiente cuantitativa, el Episcore, valor numérico que podría ayudar al clínico en la valoración de riesgo del paciente y, en casos de cistoscopia o citología dudosos, complementar en la toma de decisiones.
Referencias
1. Siegel RL, Miller KD, Jemal A. Cancer statistics, 2019. CA Cancer J Clin [Internet]. 2019;69(1):7–34. Available from: http://www.ncbi.nlm.nih.gov/pubmed/30620402
2. Leal J, Luengo-Fernandez R, Sullivan R, Witjes JA. Economic Burden of Bladder Cancer Across the European Union. Eur Urol [Internet]. 2016;69(3):438–47. Available from: http://dx.doi.org/10.1016/j.eururo.2015.10.024
3. Babjuk M, Burger M, Compérat EM, Gontero P, Mostafid AH, Palou J, et al. European Association of Urology Guidelines on Non-muscle-invasive Bladder Cancer (TaT1 and Carcinoma In Situ) - 2019 Update. Eur Urol. 2019;76(5):639–57.
4. Daneshmand S, Konety BR. American Urological Association (AUA) Guideline American Urological Association Non-Muscle Invasive Bladder Cancer. AUA Clin Guidel. 2016;(April):1–45.
5. Burke DM, Shackley DC, O’Reilly PH. The community-based morbidity of flexible cystoscopy. BJU Int. 2002;89(4):347–9.
6. Karakiewicz PI, Benayoun S, Zippe C, Lüdecke G, Boman H, Sanchez-Carbayo M, et al. Institutional variability in the accuracy of urinary cytology for predicting recurrence of transitional cell carcinoma of the bladder. BJU Int. 2006;97(5):997–1001.
7. Lotan Y, Roehrborn CG. Sensitivity and specificity of commonly available bladder tumor markers versus cytology: Results of a comprehensive literature review and meta-analyses. Urology. 2003;61(1):109–18.
8. Holliday R. Epigenetic Defects. Science (80- ). 1987;238(11):163–70.
9. Feinberg AP, Vogelstein B. Hypomethylation distinguishes genes of some human cancers from their normal counterparts. Nature. 1983;301(5895):89–92.
10. Greger V, Passarge E, Höpping W, Messmer E, Horsthemke B. Epigenetic changes may contribute to the formation and spontaneous regression of retinoblastoma. Hum Genet. 1989;83(2):155–8.
11. Witjes JA, Morote J, Cornel EB, Gakis G, van Valenberg FJP, Lozano F, et al. Performance of the Bladder EpiCheckTM Methylation Test for Patients Under Surveillance for Non–muscle-invasive Bladder Cancer: Results of a Multicenter, Prospective, Blinded Clinical Trial. Eur Urol Oncol [Internet]. 2018;1(4):307–13. Available from: https://linkinghub.elsevier.com/retrieve/pii/S2588931118300968
12. D’Andrea D, Soria F, Zehetmayer S, Gust KM, Korn S, Witjes JA, et al. Diagnostic accuracy, clinical utility and influence on decision-making of a methylation urine biomarker test in the surveillance of non-muscle-invasive bladder cancer. BJU Int. 2019;123(6):959–67.
13. Trenti E, D’Elia C, Mian C, Schwienbacher C, Hanspeter E, Pycha A, et al. Diagnostic predictive value of the Bladder EpiCheck test in the follow-up of patients with non–muscle-invasive bladder cancer. Cancer Cytopathol. 2019;127(7):465–9.
14. Trenti E, Pycha S, Mian C, Schwienbacher C, Hanspeter E, Kafka M, et al. Comparison of 2 new real-time polymerase chain reaction–based urinary markers in the follow-up of patients with non–muscle-invasive bladder cancer. Cancer Cytopathol. 2020;128(5):341–7.
15. Lozano Palacio F, Morote J, Leibovitch I, Cornel EB, Joyce J, Gakis G, et al. Performance of bladder EpiCheckTM for NMIBC monitoring - updated results of a European multi-center study. Eur Urol Suppl [Internet]. 2019;18(1):e947–9. Available from: https://doi.org/10.1016/S1569-9056(19)30689-X
16. Wasserstrom A, Frumkin D, Dotan Z, Bukin E, Gadish T, Hanuka S, et al. Mp13-15 Molecular Urine Cytology – Bladder Epicheck Is a Novel Molecular Diagnostic Tool for Monitoring of Bladder Cancer Patients. J Urol [Internet]. 2016;195(4S):e140. Available from: http://dx.doi.org/10.1016/j.juro.2016.02.2496
17. Pierconti F, Martini M, Cenci T, Fiorentino V, Sacco E, Bientinesi R, et al. Methylation study of the Paris system for reporting urinary (TPS) categories. J Clin Pathol. 2021;74(2):102–5.
18. Mancini M, Righetto M, Zumerle S, Montopoli M, Zattoni F. The bladder epicheck test as a non-invasive tool based on the identification of DNA methylation in bladder cancer cells in the urine: A review of published evidence. Int J Mol Sci. 2020;21(18):1–9.
19. Righetto ML, Zumerle S, Barcaro F, Saponaio M, Montopoli M, Ragazzi E, et al. Genomic subtypes of bladder cancer with distinct methylation profiles could be better identified by the Bladder EpiCheck test as compared to cystoscopy/urine cytology. Eur Urol Suppl [Internet]. 2019;18(8):e3118. Available from: https://doi.org/10.1016/S1569-9056(19)33362-7
20. Pierconti F, Martini M, Fiorentino V, Cenci T, Capodimonti S, Straccia P, et al. The combination cytology/epichek test in non muscle invasive bladder carcinoma follow-up: Effective tool or useless expence? Urol Oncol Semin Orig Investig [Internet]. 2021;39(2):131.e17-131.e21. Available from: https://doi.org/10.1016/j.urolonc.2020.06.018
21. Barkan GA, Wojcik EM, Nayar R, Savic-Prince S, Quek ML, Kurtycz DFI, et al. The Paris System for Reporting Urinary Cytology: The Quest to Develop a Standardized Terminology. Acta Cytol. 2016;60(3):185–97.
22. Kamat AM, Karakiewicz PI, Xylinas E, Hegarty PK, Hegarty N, Jenkins LC, et al. ICUD-EAU International Consultation on Bladder Cancer 2012: Screening, Diagnosis, and Molecular Markers. Eur Urol. 2012;63(2013):4–15.
23. van der Aa MNM, Steyerberg EW, Bangma C, van Rhijn BWG, Zwarthoff EC, van der Kwast TH. Cystoscopy Revisited as the Gold Standard for Detecting Bladder Cancer Recurrence: Diagnostic Review Bias in the Randomized, Prospective CEFUB Trial. J Urol [Internet]. 2010;183(1):76–80. Available from: http://dx.doi.org/10.1016/j.juro.2009.08.150
24. Esteller M. CpG island hypermethylation and tumor suppressor genes: A booming present, a brighter future. Oncogene. 2002;21(35 REV. ISS. 3):5427–40.
25. Wolff EM, Chihara Y, Pan F, Weisenberger DJ, Siegmund KD, Sugano K, et al. Unique DNA methylation patterns distinguish noninvasive and invasive urothelial cancers and establish an epigenetic field defect in premalignant tissue. Cancer Res. 2010;70(20):8169–78.




