Redacción Farmacosalud.com
La compañía Janssen ha anunciado que la Comisión Europea (CE) ha aprobado STELARA® (ustekinumab) para el tratamiento de la psoriasis en placas moderada o grave en pacientes adolescentes de 12 años de edad o más, cuya enfermedad no esté bien controlada con otros tratamientos sistémicos o fototerapias o que no toleren dichos tratamientos. La CE ha aprobado el producto tras la opinión positiva que emitió el Comité de Medicamentos para Uso Humano (CHMP) de la Agencia Europea del Medicamento (EMA) en mayo de 2015, en la que aprobó el uso de STELARA® para esta indicación. Según el Dr. Antonio Torrelo Fernández, jefe de sección de Dermatología del Hospital Niño Jesús de Madrid, “el síntoma más importante de la psoriasis moderada-grave es el picor, que a menudo condiciona la calidad de vida del paciente. El padecimiento de una enfermedad visible y a menudo desagradable para los demás conduce a la estigmatización y rechazo, miedo al contagio (aunque la psoriasis no es una enfermedad contagiosa) y distorsiones en las relaciones personales”.
En cuanto a los principales efectos que produce esta enfermedad entre los jóvenes, el Dr. Torrelo explica que “son frecuentes entre los adolescentes con psoriasis moderada-grave sentimientos de inferioridad, vergüenza o dificultades para entablar relaciones. Estos efectos emocionales condicionan una merma muy importante en la calidad de vida de los pacientes. Finalmente, no debe olvidarse que la psoriasis es una enfermedad que va más allá de la piel y puede acompañarse de manifestaciones internas como artritis u otros síntomas inflamatorios variados. Se ha descrito que la obesidad es más frecuente entre los pacientes psoriásicos, tanto adultos como adolescentes”.

(Imagen modificada) Autor/a del original: taliesin
Fuente: www.morguefile.com (free photo)
La aprobación, basada en los datos del estudio CADMUS
La alta eficacia de Stelara® demostrada en el estudio y su comodidad de administración permiten a los pacientes tener la seguridad de que reciben un tratamiento que les permite mantener la enfermedad controlada y olvidar los inconvenientes de las medicaciones clásicas. Las ventajas de Stelara® son una cómoda posología de administración cada 12 semanas una vez superada la fase de inicio y una alta eficacia terapéutica, junto con un perfil controlado de toxicidad. La psoriasis en placa es una enfermedad autoinmune crónica que afecta al 0,5%-2% de la población general en la infancia y la adolescencia.[1] Es el tipo más frecuente de psoriasis y a menudo se caracteriza por la presencia de zonas de piel gruesa, enrojecida o inflamada cubiertas por escamas plateadas llamadas placas.[1] “Si bien se dice que entre el 1 y el 2 % de la población tiene o ha tenido psoriasis alguna vez en su vida, el porcentaje de pacientes con psoriasis moderada o grave es menor. La incidencia de formas moderadas-graves en adolescentes probablemente oscile entre 1 y 4 de cada 1.000 individuos”, añade.
La aprobación de la CE se ha basado en los datos del estudio CADMUS, un ensayo fase 3, aleatorizado, doble ciego, multicéntrico y controlado con placebo.[2] En el ensayo se aleatorizó a pacientes de 12 a 17 años de edad con psoriasis en placas moderada o grave para recibir en una proporción de 1:1:1 placebo por vía subcutánea, STELARA® en la dosis habitual (cuyo objetivo es alcanzar la misma exposición al fármaco que en los adultos) o STELARA® en la mitad de la dosis habitual (cuyo objetivo es alcanzar la mitad de la exposición al fármaco que en los adultos) en las semanas 0 y 4 y luego cada 12 semanas. Los niveles de dosis de STELARA® se determinaron en función del peso corporal. Los pacientes que recibieron placebo pasaron a recibir STELARA® en la dosis habitual o STELARA® en la mitad de la dosis habitual en las semanas 12 y 16; todos los pacientes continuaron recibiendo la dosis de mantenimiento cada 12 semanas hasta la semana 40.[3] El criterio de valoración principal fue el porcentaje de pacientes que presentaron una puntuación de la Escala de evaluación global del médico (PGA) de 0 (sin enfermedad) o 1 (enfermedad mínima) en la semana 12. Los criterios de valoración secundarios fueron las puntuaciones de los Índices de gravedad del área con psoriasis 75 (PASI 75) y 90 (PASI 90), el cambio desde el periodo basal hasta la semana 12 en la puntuación del Índice de calidad de vida dermatológico infantil (CDLQI) y el cambio desde el periodo basal hasta la semana 12 en la puntuación total del Inventario de calidad de vida pediátrico (PedsQL). Las evaluaciones finales de eficacia y seguridad se realizaron en las semanas 52 y 60, respectivamente.[3]
La psoriasis, una enfermedad crónica
En la semana 12, los pacientes tratados con STELARA® presentaron una mejora significativamente mayor de la psoriasis y de la calidad de vida relacionada con la salud que los tratados con placebo. El 69,4% de los pacientes tratados con la dosis habitual de STELARA® tuvieron una puntuación PGA de 0 ó 1, frente al 5,4% de los pacientes que recibieron placebo. Después de la semana 12 la eficacia fue generalmente mayor y más sostenida en el grupo de la dosis habitual de STELARA® que en el grupo de la mitad de la dosis habitual de STELARA®. Las mejoras de las puntuaciones PGA, PASI, CDLQI y PedsQL se mantuvieron hasta la semana 52 en el grupo de la dosis habitual de STELARA®.[3] Hasta la semana 12, los porcentajes de pacientes que presentaron al menos un acontecimiento adverso fueron similares con STELARA® y con placebo: el 47,9% en los dos grupos de STELARA® combinados y el 56,8% en el grupo placebo. De los pacientes tratados con STELARA®, un paciente del grupo de la mitad de la dosis habitual presentó un acontecimiento adverso grave de la semana 0 a la 12. Los perfiles de seguridad de los pacientes de los grupos de la dosis habitual y de la mitad de la dosis habitual fueron parecidos.[4] Hasta la semana 60, el 81,8% de los pacientes tratados con STELARA® presentaron al menos un acontecimiento adverso, y el 5,5% de ellos presentaron un acontecimiento adverso grave. No se registró ningún caso de cáncer, infecciones oportunistas o reacciones anafilácticas. Los acontecimientos adversos comunicados fueron similares a los observados en estudios previos realizados en adultos con psoriasis en placas.[4]
La psoriasis es una enfermedad crónica, causada por alteraciones en el sistema inmunitario y que conduce a un exceso en la producción de células cutáneas, afectando a 125 millones de personas a nivel mundial, entre ellas a 14 millones de europeos.[5,6,7,8,9]. La psoriasis en placas a menudo se caracteriza por la presencia de zonas de piel gruesa, enrojecida o inflamada cubiertas por escamas plateadas llamadas placas, las cuales pueden romperse y sangrar y aparecer en cualquier parte del cuerpo. Los síntomas de la enfermedad pueden ser leves, moderados, intensos o discapacitantes.[10] Se calcula que casi el 3% de la población mundial tiene psoriasis y que casi una cuarta parte de estas personas padece psoriasis moderada o grave.[3] Aunque la enfermedad puede aparecer a cualquier edad, aproximadamente en un tercio de los casos aparece antes de los 18 años.[11] El estudio CADMUS[3] fue un ensayo fase 3, aleatorizado, doble ciego, multicéntrico, de grupos paralelos y controlado con placebo en el que se evaluaron la eficacia y la seguridad de STELARA en pacientes pediátricos de 12 a 17 años de edad con psoriasis en placas moderada o grave. A los pacientes (N=110) les habían diagnosticado que tenían psoriasis en placas al menos 6 meses antes de la administración de la primera dosis del fármaco del estudio. Su enfermedad era moderada o grave, definida como una puntuación PASI de 12 o más, una puntuación PGA de 3 o más y un porcentaje de afectación del área de superficie corporal (BSA) del 10% o más. Además, los pacientes no tenían bien controlada su enfermedad con tratamiento tópico o eran candidatos para recibir tratamiento sistémico o fototerapia. Aproximadamente el 60% de los pacientes habían recibido previamente tratamiento sistémico o fototerapia convencionales y aproximadamente el 11% habían recibido previamente productos biológicos.
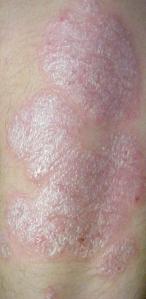
Placas de psoriasis en el codo («Psoriasis». Publicado bajo la licencia CC BY-SA 3.0 vía Wikimedia Commons)
Autor/a de la imagen: User:Marnanel
Fuente: Wikipedia / Methoxyroxy~commonswiki
Ustekinumab inhibe la acción de las interleucinas IL-12 e IL-23
STELARA (ustekinumab)[3], un anticuerpo humano que inhibe la acción de las interleucinas IL-12 e IL-23, está aprobado para el tratamiento de la psoriasis en placas moderada o grave en adultos que no han respondido a otros tratamientos sistémicos como ciclosporina, metotrexato (MTX) o psoraleno más luz ultravioleta A (PUVA), que tienen contraindicaciones para estos tratamientos o que no los toleran. STELARA está indicado para el tratamiento de la psoriasis en placas moderada o grave en pacientes adolescentes de 12 años de edad o más cuya enfermedad no está bien controlada con otros tratamientos sistémicos o fototerapias o que no toleran dichos tratamientos. La seguridad y la eficacia de STELARA en niños de menos de 12 años de edad todavía no se han determinado. STELARA también está aprobado en monoterapia o en combinación con MTX para el tratamiento de la artritis psoriásica activa en pacientes adultos que han presentado una respuesta insuficiente al tratamiento previo con fármacos antirreumáticos modificadores de la enfermedad (FARME) no biológicos.
Información importante de seguridad (UE)[3]
ADVERTENCIAS Y PRECAUCIONES ESPECIALES: Infecciones: STELARA® puede incrementar el riesgo de infecciones y reactivar infecciones latentes. En los ensayos clínicos se han observado infecciones bacterianas, fúngicas y víricas graves en pacientes tratados con STELARA. Hay que actuar con precaución en los pacientes con una infección crónica o con antecedentes de infecciones recurrentes, especialmente de tuberculosis. Hay que evaluar a los pacientes para ver si tienen tuberculosis y tratar la tuberculosis latente, si la tienen, antes de iniciar el tratamiento con STELARA®. También hay que considerar administrar un tratamiento para la tuberculosis antes de empezar a administrar STELARA® en los pacientes con antecedentes de tuberculosis activa o latente. Si un paciente presenta signos o síntomas de una infección, debe consultar a su médico. Si un paciente presenta una infección grave, hay que vigilarlo estrechamente e interrumpir el tratamiento con STELARA® hasta que la infección se haya resuelto. Cáncer: STELARA® puede incrementar el riesgo de cáncer. Algunos de los pacientes tratados con STELARA en ensayos clínicos presentaron tumores malignos cutáneos y no cutáneos. No se han realizado estudios en pacientes con antecedentes de cáncer ni en pacientes que siguen recibiendo STELARA® después de haberles diagnosticado un cáncer. Hay que actuar con precaución a la hora de administrar STELARA® a estos pacientes. Se recomienda vigilar a los pacientes por si presentan cáncer de piel no melanoma, en particular a los pacientes de más de 60 años de edad y a los que han recibido tratamiento inmunosupresor prolongado o tratamiento con PUVA.
Reacciones de hipersensibilidad: Se han comunicado casos de reacciones de hipersensibilidad graves (anafilaxia y angioedema) en pacientes tratados con STELARA®, en algunas ocasiones varios días después del tratamiento. Si un paciente presenta una reacción de hipersensibilidad, hay que instaurar el tratamiento apropiado y dejar de administrarle STELARA®. Vacunas: Los pacientes tratados con STELARA® no deben recibir de forma concomitante vacunas con virus vivos o con bacterias vivas como la vacuna BCG. Antes de administrar una vacuna con virus vivos o con bacterias vivas hay que interrumpir el tratamiento con STELARA® por lo menos durante 15 semanas desde la fecha de administración de la última dosis y volver a instaurarlo por lo menos 2 semanas después de la vacunación. Los pacientes tratados con STELARA® pueden recibir de forma concomitante vacunas inactivadas o sin microorganismos vivos. El tratamiento a largo plazo con STELARA no reduce la respuesta humoral inmune a la vacuna antineumocócica de polisacáridos o a la vacuna del tétanos Tratamiento inmunosupresor concomitante: Hay que actuar con precaución en los pacientes que reciben este tratamiento y también cuando se cambie un fármaco biológico inmunosupresor por otro. En estudios en psoriasis no se han evaluado la seguridad y la eficacia de STELARA® en combinación con otros inmunosupresores, incluidos productos biológicos, o con fototerapia. En estudios en artritis psoriásica, el uso concomitante de MTX no pareció influir en la seguridad o la eficacia de STELARA®. Inmunoterapia: Se desconoce si STELARA® afecta a la inmunoterapia para la alergia. Trastornos cutáneos graves: En pacientes con psoriasis se han comunicado casos de dermatitis exfoliativa tras el tratamiento con STELARA®. Los pacientes con psoriasis en placas pueden presentar psoriasis eritrodérmicas, cuyos síntomas pueden ser clínicamente indistinguibles de los de la dermatitis exfoliativa, como parte de la evolución natural de la enfermedad. Si aparecen estos síntomas, hay que instaurar el tratamiento apropiado. El tratamiento con STELARA® debe interrumpirse si se sospecha que se ha producido una reacción al fármaco. Sensibilidad al látex: La cubierta de la aguja contiene goma natural (látex), el cual puede causar reacciones alérgicas. Pacientes ancianos de > 65 años de edad: STELARA® debe usarse con precaución en los pacientes ancianos, han informado desde Janssen.
Bibliografía
1. Fotiadou C, et al. Management of psoriasis in adolescence. Adolesc Health Med Ther 2014;5:25–34.
2.ClinicalTrials.gov. NCT01090427 Available at
www.clinicaltrials.gov/show/NCT01090427 (last accessed June 2015).
3. Summary of Product Characteristics Stelara 45 mg solution. Janssen-Cilag International NV. Last updated June 2015.
4. Landells I, Marano C, Hsu MC et al. Safety and efficacy of ustekinumab in adolescent patients with moderate-to-severe plaque psoriasis: Results through 1 year of the Phase 3 CADMUS trial. Presented at: 23rd World Congress of Dermatology, June 9-13, 2015, Vancouver, Canada.
5. National Psoriasis Foundation. What is known about psoriasis: statistics. Available at https://www.psoriasis.org/cure_known_statistics (last accessed June 2015).
6. Augustin M, et al. Prevalence of skin lesions and need for treatment in a cohort of 90 880 workers Br J Dermatol 2011;165:865–873.
7. Ortonne J, et al. Alefacept: a novel and selective biologic agent for the treatment of chronic plaque psoriasis. Eur J Dermatol 2004;14:41–45.
8. Parisi R, et al. Global Epidemiology of Psoriasis: A Systematic Review. J Invest Dermatol 2013;133:377–385.
9. World Population statistics. Population of Europe 2014. Available at http://www.worldpopulationstatistics.com/population-of-europe-2014 (last accessed June 2015).
10. Chong HT et al. Lifting the silver flakes: the pathogenesis and management of chronic plaque psoriasis. BioMed Research International 2013;2013:1–9.
11. AbuHilal M and Ho N. Successful treatment of severe psoriasis in an adolescent with ustekinumab. Pediatric dermatology 2015;32(3):377–380.




