Redacción Farmacosalud.com
Durante los últimos veinte años, los estudios de investigación han señalado la acumulación de agregados de proteína beta-amiloide (Aβ) como el suceso principal en el origen de la enfermedad de Alzheimer. Ahora, un estudio[1] liderado por Francisco José Muñoz, investigador principal en el Departamento de Ciencias Experimentales y de la Salud (DCEXS) de la Universidad Pompeu Fabra (UPF) de Barcelona, arroja luz sobre la acumulación de estos agregados en el cerebro, descubriendo que la presencia de peroxinitrito en el ambiente extracelular promueve la formación y la estabilización de los agregados de beta-amiloide.
Portada de revista Journal of Neuroscience-acuarela a cargo de Biuse Guivernau
Fuente: UPF
El beta-amiloide es una proteína presente en el sistema nervioso cuya función no se conoce con exactitud. Las formas solubles de beta-amiloide pueden agregar dando lugar a unas estructuras primarias llamadas oligómeros, que a su vez se agregan para dar lugar a las fibras maduras.
Algunos expertos consideran que la formación de fibras maduras es un mecanismo protector para evitar la presencia de oligómeros, puesto que éstos se han descrito como la forma más tóxica de beta-amiloide. Los oligómeros alteran directamente la función de las neuronas y promueven la neurodegeneración. Los oligómeros y las fibras de beta-amiloide incrementan la producción de óxido nítrico y de radicales libres en el ambiente extracelular. Cuando éstos se combinan, se produce peroxinitrito, una molécula altamente reactiva que modifica las proteínas, alterando su función.
Cuanta más beta-amiloide, más formación de peroxinitrito
El estudio liderado por Francisco José Muñoz revela que cuando el peroxinitrito reacciona con los oligómeros de beta-amiloide, facilita su estabilización e impide la formación de las fibras maduras. De esta manera, cuanta más proteína beta-amiloide hay, más se promueve la formación de peroxinitrito y éste, a su vez, hace que los oligómeros de beta-amiloide se mantengan estabilizados, perpetuando el daño a nivel neuronal característico de la enfermedad de Alzheimer.
“El estudio de los mecanismos que subyacen a la agregación de beta-amiloide es crucial para el desarrollo de nuevas estrategias terapéuticas”, comenta Francisco José Muñoz, coordinador del estudio y jefe del grupo de investigación en Envejecimiento Cerebral del DCEXS. Además de describir los efectos que tiene la nitración sobre los oligómeros de beta-amiloide, el equipo científico, en colaboración con los investigadores Baldo Oliva y David Andreu, ha desarrollado un modelo computacional según el cual una mutación de la adición del grupo nitro a la proteína beta-amiloide estabiliza los altamente tóxicos oligómeros de beta-amiloide e impide la formación de fibras maduras.
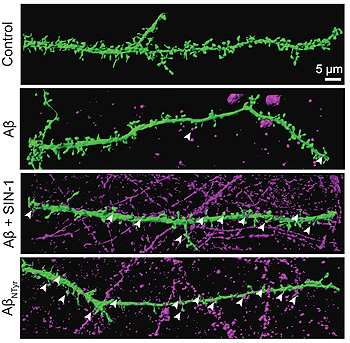
Figura cedida por los autores-Aumento de oligómeros Aβ nitrados y unidos a las sinapsis
Fuente: UPF
“Es esencial conocer en profundidad los mecanismos moleculares que ocurren en los inicios de la enfermedad, cuando todavía no se presentan síntomas, para poder desarrollar terapias focalizadas en la prevención y el tratamiento precoz”, comenta la autora del artículo, Biuse Guivernau.
Los estímulos auditivos como posible marcador
Por otro lado, un estudio publicado en ‘Scientific Reports’ se planteó buscar la fiabilidad de la negatividad auditiva de desadaptación (en inglés, auditory Mismatch Negativity- aMMN) como marcador capaz de identificar la progresión del deterioro cognitivo leve en la enfermedad de Alzheimer. Se trata de un trabajo[2] llevado a cabo por Manuela Ruzzoli, primera autora e investigadora del Centro de Cognición y Cerebro (CBC) del Departamento de Tecnologías de la Información y las Comunicaciones (DTIC) de la UPF, en colaboración con investigadores italianos de la Universidad de Trento i del Centro San Giovanni di Dio de Brescia. La negatividad auditiva de desadaptación o aMMN es una componente de la actividad eléctrica cerebral que responde a estímulos auditivos y que puede ponerse de relieve a través de un simple electroencefalograma (EEG). Se usa como índice de memoria sensorial y de atención. En este tipo de experimentos se producen una serie de estímulos sonoros regulares o estándar que, de repente, se tornan diferentes o desviantes. Estos estímulos generan ondas cerebrales susceptibles de ser captadas a través de un EEG.
Como explica Ruzzoli: “En nuestro estudio, se evaluaron las potenciales alteraciones de la memoria sensorial auditiva en pacientes con demencia y con deterioro cognitivo leve, en comparación con un grupo control de personas ancianas sanas. Para identificar las posibles diferencias entre los tres grupos en la codificación de estímulos acústicos y/o en el mantenimiento de la representación de dichos estímulos a lo largo del tiempo, se compararon las ondas cerebrales de los registros del EEG provocadas por series de estímulos auditivos regulares interrumpidos por estímulos auditivos menos frecuentes (desviantes) y presentados a intervalos de tiempo cortos y largos”. Este experimento tenía que ser crucial para identificar pacientes con enfermedad de Alzheimer capaces de responder a intervalos cortos de estímulo pero no a los intervalos largos, debido al deterioro de su memoria sensorial. Del mismo modo, los pacientes con deterioro cognitivo leve deberían mostrarse a medio camino entre el envejecimiento normal y la demencia. Con ello, los autores querían poder discriminar entre el envejecimiento normal y el patológico, en sus primeras fases. Así pues, en este estudio se analizaron personas ancianas sanas, personas con deterioro cognitivo leve y sujetos con diagnóstico de enfermedad de Alzheimer.
Los resultados del experimento mostraron que ante un sonido desviante de duración e intervalo intermedio corto, las personas con deterioro cognitivo leve respondieron al estímulo en su localización temporal, mientras que las personas con enfermedad de Alzheimer lo hicieron en su zona frontal. Los ancianos sanos respondieron al mismo tipo de estímulo auditivo en ambas localizaciones cerebrales. En cambio, cuando los intervalos intermedios entre los estímulos administrados fue largo, la respuesta sólo se obtuvo en el grupo de sujetos con envejecimiento normal, y más concretamente en el lóbulo temporal cerebral. Por todo ello, el estudio concluye que la aMMN podría ser utilizada como marcador para discernir entre un envejecimiento normal o patológico en lo que concierne a disminución cognitiva neurofisiológica debida a la edad. "El aspecto interesante de ese marcador es que no es intrusivo, puede der obtenido de forma pasiva (sin que la persona o el paciente ponga atención directa), es un marcador fácil de registrar y calcular y no requiere demasiada especialización técnica o computacional", ha añadido Ruzzoli.
En definitiva, la aMMN podría ser introducido en los centros clínicos, en la práctica clínica habitual, para evaluar de manera sólida y fiable si éste podría ser un método diagnóstico de deterioro cognitivo de las personas inherente a la enfermedad de Alzheimer, ya en sus primeras manifestaciones.
Referencias
1. Guivernau B, Bonet J, Valls-Comamala V, Bosch-Morató M, Godoy JA, Inestrosa NC, Perálvarez-Marín A, Fernández-Busquets X, Andreu D, Oliva B, Muñoz FJ. Amyloid-β Peptide Nitrotyrosination Stabilizes Oligomers and Enhances NMDAR-Mediated Toxicity. J Neurosci. 2016 Nov 16;36(46):11693-11703. PubMed PMID: 27852777
2. Manuela Ruzzoli, Cornelia Pirulli, Veronica Mazza, Carlo Miniussi, Debora Brignani (2016), “The mismatch negativity as an index of cognitive decline for the early detection of Alzheimer’s disease", Scientific Reports, 12 de septiembre, DOI: 10.1038/srep33167.




