Redacción Farmacosalud.com
Un equipo de investigadores ha conseguido, por primera vez, que desaparezcan totalmente cánceres ductales de páncreas en un modelo experimental. Según el Dr. Mariano Barbacid, jefe del Grupo AXA- CNIO de Oncología Experimental de la FSP CNIO adscrita al Instituto de Salud Carlos III, organismo del Ministerio de Ciencia, Innovación y Universidades, con la nueva terapia no se registró una reaparición o recidiva del tumor en los ratones en los que el tratamiento funcionó, al menos durante el período estudiado: “En los animales que respondieron, el experimento sólo se extendió por 4 meses. Hasta ese momento no hubo ‘reaparición’ del tumor”.
Ahora bien, “dos de los ratones se volvieron resistentes a las 8 semanas, antes de que hubiera desaparecido el tumor”, matiza Barbacid en declaraciones a www.farmacosalud.com. Los hallazgos forman parte del estudio ‘Regresión completa de los adenocarcinomas ductales pancreáticos avanzados tras la inhibición combinada de EGFR y c-RAF’[1], considerado uno de los trabajos más importantes realizados hasta el momento en la investigación contra el cáncer de páncreas, uno de los tumores malignos más letales.

Dr. Mariano Barbacid
Fuente: AECC / Actitud de Comunicación / Apple tree communications
El adenocarcinoma ductal de páncreas (ADP), muy resistente a los tratamientos
“Durante los últimos cinco años, nuestro laboratorio ha desarrollado una nueva generación de modelos de ratón genéticamente modificados que han permitido, por un lado, evaluar el efecto terapéutico de dianas moleculares en ratones portadores de tumores avanzados, y por otro, identificar posibles efectos tóxicos al eliminar o inhibir estas dianas de forma sistémica en todo el organismo”, explica el Dr. Barbacid, a su vez profesor y miembro del Comité de Dirección del Máster de Oncología Molecular MOM, y miembro de la Asociación Española Contra el Cáncer (AECC). Precisamente, la Dra. Marta Puyol, directora de investigación de la AECC, señala que “este es un claro ejemplo de un resultado innovador y rompedor que podrá marcar una nueva era en el abordaje y tratamiento de un cáncer tan agresivo como es el cáncer pancreático”.
“El objetivo de la AECC -continúa Puyol- es promover el trabajo coordinado y multidisciplinar de los investigadores para poder abordar el problema del cáncer desde distintas perspectivas, pero con un objetivo común: vencer la enfermedad”. El proyecto del Dr. Barbacid es uno de los 334 proyectos que actualmente está financiando la AECC por un total de 56M€.
El adenocarcinoma ductal de páncreas (ADP) es una de las formas más agresivas de cáncer y una de las que más se resiste a los tratamientos actuales, ya sean de Medicina Personalizada o de Inmunoterapia. En la actualidad, la curación de los ADPs se limita prácticamente a aquellos casos en los que el tumor está localizado y puede ser eliminado quirúrgicamente, lo que representa menos de un 10% de los pacientes.
El conocimiento acerca del ADP ha aumentado exponencialmente en los últimos años
Según los últimos datos demográficos obtenidos en los Estados Unidos, el tumor pancreático es ya la tercera causa de muerte en EEUU, sólo por detrás del cáncer de pulmón y colon, habiendo superado la mortalidad causada por los cánceres de mama. En España, según el Observatorio del Cáncer de la AECC, se registran unos 8.000 casos anuales. Es un tumor ligeramente más frecuente entre los hombres que entre las mujeres. La incidencia en territorio español se puede considerar media (tasa ajustada mundial en 2002: 6,6 nuevos casos/100.000 habitantes/año en hombres y 3,9 en mujeres), pero con un ascenso muy importante que se inició en los años 50 y que continúa en la actualidad con cifras que desvelan los altos índices de mortalidad de esta enfermedad.
Paradójicamente, el conocimiento acerca del ADP ha aumentado exponencialmente en los últimos años tanto a nivel celular como molecular. En la gran mayoría de los casos (>95%), la mutación iniciadora tiene lugar en el oncogén KRAS. A medida que estas lesiones progresan en malignidad se van acumulando otras mutaciones, sobre todo en genes supresores tumorales, principalmente TRP53, CDKN2A y SMAD4.
Fragmento del video ‘Siguientes pasos del Grupo AXA- CNIO de Oncología Experimental. Del MODELO ANIMAL AL TRATAMIENTO EN HUMANOS’
Autor/a del vídeo-fuente de la imagen: CNIO / Instituto de Salud Carlos III / 3D TECH OMEGA ZETA
Difusión: AECC / Actitud de Comunicación / Apple tree communications
En el nuevo trabajo se ha evaluado el potencial terapéutico de dos dianas implicadas en la señalización de las oncoproteínas KRAS. Se trata del receptor del factor de crecimiento epidérmico, EGFR en sus siglas inglesas, y la quinasa c-RAF. Para ello se ha utilizado una nueva generación de ratones genéticamente modificados e inducidos por las mismas mutaciones responsables de la mayoría de los tumores humanos, KRAS y TP53, y que reproducen fielmente la historia natural de estos tumores. Gracias a esos modelos experimentales ha sido posible, por primera vez, eliminar dianas terapéuticas en ratones portadores de tumores ADPs de alto grado, y además se ha hecho de forma sistémica, es decir, en todo el organismo (no solo en tejido tumoral como en muchos otros estudios).
La eliminación de cada una de las dianas por sí solas no produjo ningún efecto terapéutico. Sin embargo, cuando se eliminaron ambas simultáneamente se pudo comprobar que un porcentaje importante de tumores ADP de alto grado no sólo dejaron de crecer, como suele suceder en la mayoría de los modelos experimentales, sino que en unas semanas desaparecieron completamente. Este efecto terapéutico no había sido observado previamente en ningún modelo experimental de ADP in vivo.
Los buenos resultados no incluyen el cáncer de páncreas metastásico
No obstante, los espectaculares resultados conseguidos no incluyeron el cáncer de páncreas metastásico, estadío que en humanos afectados por esta enfermedad significa, por ahora, estar prácticamente desahuciado desde un punto de vista terapéutico. En ratones no se obtuvieron esos resultados porque en el modelo murino genéticamente modificado para esa investigación sobre cáncer de páncreas las metástasis son poco frecuentes, ya que el animal fallece antes por el tumor primario. “Lo que sí puedo decir es que los animales del grupo control o del grupo que no respondió a la estrategia terapéutica sólo sobrevivieron entre 1 y 8 semanas más. Sin embargo, los ratones que respondieron seguían libres de enfermedad hasta 16 semanas después del inicio de la ‘terapia’”, asegura el Dr. Barbacid.
Igualmente importante es el hecho de que la eliminación sistémica del EGFR y de c-RAF sólo produjera una toxicidad menor -ya observada en pacientes tratados con inhibidores del EGFR como Gefitinib o Afatinib-, consistente en una dermatitis fácilmente controlable. La eliminación concomitante de c-RAF no indujo ninguna toxicidad adicional. Por lo tanto, la terapia combinatoria basada en la inhibición simultánea de EGFR y c-RAF debería ser, en principio, bien tolerada por los pacientes de cáncer.
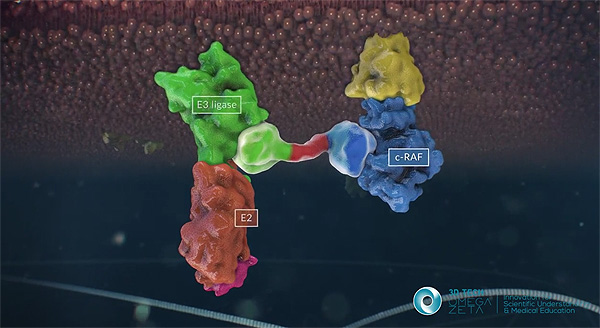
Imagen relativa a c-RAF
Autor/a del vídeo-fuente de la imagen: CNIO / Instituto de Salud Carlos III / 3D TECH OMEGA ZETA
Título del video: ‘Siguientes pasos del Grupo AXA- CNIO de Oncología Experimental. Del MODELO ANIMAL AL TRATAMIENTO EN HUMANOS’
Difusión: AECC / Actitud de Comunicación / Apple tree communications
Efecto terapéutico en 9 de 10 tumores de páncreas humanos (modelos PDX)
Según se describe en el trabajo, el nuevo tratamiento también dio resultados positivos en 9 de 10 modelos PDX (patient-derived xenografts) obtenidos de pacientes con cáncer de páncreas mantenidos en ratones inmunodeficientes. Aunque el éxito de terapias experimentales en modelos PDX no es garantía de que funcionen en humanos, esta actividad se considera como un paso previo esencial para el desarrollo de ensayos clínicos.
De acuerdo con el experto, la inhibición de las dos dianas moleculares, EGFR y c-RAF, no es una terapia génica, sino una operación de manipulación genética: “Se trata de alelos condicionales que son eliminados mediante la activación de una recombinasa inducible denominada CreERT2. Es decir, eliminamos por manipulación genética los genes que codifican las dos dianas terapéuticas EGFR y c-RAF”. Desgraciadamente, el proceso de transferencia de los resultados de la investigación a la clínica no va a poder ser inmediato debido a que, si bien existen muy buenos inhibidores del EGFR, no existen inhibidores capaces de bloquear la actividad de c-RAF y, por lo tanto, aún no es posible reproducir farmacológicamente los resultados experimentales obtenidos con la eliminación génica de EGFR y c-RAF.

Autor/a: Dafne Cholet
Fuente: Flickr / Creative Commons
Habrá que esperar unos años para poder ver la utilidad de la terapia en humanos
El jefe del Grupo AXA- CNIO de Oncología Experimental de la FSP CNIO prefiere no hacer pronósticos sobre la utilidad del nuevo procedimiento en humanos: “A mí no me gusta predecir nada en Ciencia. Hasta ahora lo único que se ha probado en ensayos clínicos son inhibidores del EGFR. Estos ensayos produjeron un retraso muy leve de la enfermedad, lo mismo que observamos en nuestros ratones cuando sólo eliminamos el EGFR. Hasta ahora todos los inhibidores de c-RAF que se han probado en ensayos clínicos han sido muy tóxicos y no han pasado de la fase I. Por lo tanto, la combinación de inhibidores de EGFR y c-RAF no ha podido ser probada todavía en pacientes de cáncer de páncreas”. Según Barbacid, como mínimo deberán pasar 5 años antes de poder obtener resultados determinantes en humanos con respecto a dicha combinación.
Por último, es importante subrayar que no todos los tumores, tanto los murinos como los derivados de pacientes, respondieron a la nueva terapia, un dato que pone de manifiesto la gran heterogeneidad que presentan los ADPs. Los estudios de perfiles transcripcionales descritos en este trabajo revelaron diferencias de expresión de más de 2.000 genes entre los tumores que respondieron y los que no respondieron a la terapia. La identificación de dianas adicionales a partir de estos perfiles es, sin duda, un importante reto para poder incrementar el armamentarium terapéutico con el que combatir aquellos tumores de páncreas que no responden en la clínica al tratamiento combinado contra EGFR y c-RAF. La nueva investigación sobre cáncer de páncreas ha sido posible en parte, gracias a la financiación proporcionada por:
• Asociación Española contra el Cáncer (Proyecto GC16173694BARB) a los grupos de investigación de Mariano Barbacid, Alfredo Carrato (Hospital Ramón y Cajal) y Bruno Sainz Jr. (Universidad Autónoma de Madrid)
• European Research Council (Consejo Europeo de Investigación) (Advanced Grants ERC-AG/250297-RAS AHEAD y ERC-AG/695566-THERACAN) a Mariano Barbacid
• Ministerio de Economia y Competitividad (Proyecto SAF2014-59864-R) a Mariano Barbacid
• Endowed Chair del AXA Research Fund a Mariano Barbacid
• Beca de Formación de Personal Universitario a la Dra. María Teresa Blasco (actualmente en el IRB de Barcelona)
• Contrato Juan de la Cierva a la Dra. Carolina Navas
La financiación de los otros investigadores que han colaborado en el proyecto puede obtenerse en la sección de Acknowledgements del trabajo publicado en 'Cancer Cell'.
La quimioterapia postoperatoria incrementa la supervivencia
Por otro lado, los últimos avances en el tratamiento del cáncer de páncreas están evidenciando que la quimioterapia postoperatoria, con regímenes de alta intensidad, incrementa de forma notable la supervivencia de los pacientes, según informa la compañía Celgene mediante un comunicado. Para el Dr. Manuel Hidalgo, catedrático de medicina en la Facultad de Medicina de la Universidad de Harvard, en Boston, EE.UU. y codirector del Título de Experto en Cáncer de Páncreas, el progreso más relevante de los últimos meses reside en el incremento de la supervivencia -y puede que también la curación- de algunos pacientes diagnosticados con enfermedad localizada, a través de la quimioterapia postoperatoria con regímenes de alta intensidad.

Los avances sobre quimioterapia postoperatoria se han constatado en la entrega de diplomas del Título propio de Expertos en Cáncer de Páncreas de la Universidad de Alcalá de Henares (Madrid)
Fuente: Celgene / Cícero Comunicación
En cuanto al tratamiento de primera línea en pacientes adultos con adenocarcinoma de páncreas metastásico, “actualmente existen dos regímenes de tratamiento aceptados en esta situación: Gemcitabina-Abraxane (GA) y Folfirinox. Si bien es cierto que no han sido comparados en estudios fase III, en términos de eficacia podrían ser similares. Sin embargo, GA es mejor tolerado y por esa razón es el tratamiento más utilizado en líneas generales”.
Referencias
1. Blasco MT., Navas C., Martín-Serrano G., Barbacid M., et al. “Complete Regression of Advanced Pancreatic Ductal Adenocarcinomas upon Combined Inhibition of EGFR and C-RAF”. Cancer Cell. Abril 2019. https://doi.org/10.1016/j.ccell.2019.03.002 https://www.sciencedirect.com/science/article/pii/S1535610819301114?via%3Dihub#!




