Redacción Farmacosalud.com
Un estudio ha demostrado por primera vez que la sobreexpresión de TFEB (factor de transcripción EB) en neuronas dopaminérgicas tiene un efecto neurotrófico y neuroprotector en un modelo de ratones con la enfermedad de Parkinson. Se abre así una vía para detener la progresión de la patología y revertir la sintomatología. El trabajo, liderado por el grupo de investigación en Enfermedades Neurodegenerativas del Vall d'Hebron Instituto de Investigación (VHIR) [Barcelona], ha sido publicado en la revista ‘Molecular Therapy’. Por ahora, en los animales estudiados no se han detectado efectos adversos aparentes, si bien hay que puntualizar que la investigación está todavía en fases muy iniciales de desarrollo.
“Lo que hemos observado es que la sobreexpresión de TFEB produce un efecto neurotrófico que se pone de manifiesto por un incremento del 40% del tamaño de las neuronas. Este efecto neurotrófico es debido a la activación de la síntesis de proteínas y de vías de supervivencia, que confieren resistencia a la neurona frente a cualquier tipo de estrés, de la misma manera que lo hacen los factores neurotróficos”, explica el doctor Jordi Bové, investigador principal del mencionado grupo del VHIR, cuyo liderazgo recae en el doctor Miquel Vila.
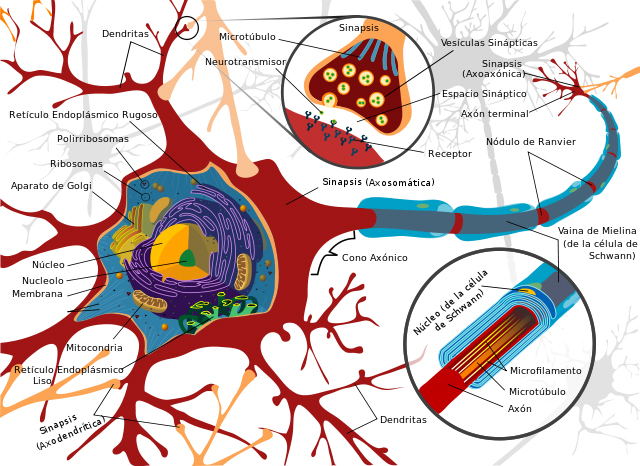
Partes de una neurona
Autor/a de la imagen: LadyofHats (English original); Josell7 (Spanish translation) - Translation of Image:Complete_neuron_cell_diagram_en.svg. Image renamed from Image:Complete neuron diagram español.svg
Fuente: Wikipedia
Por otro lado, se ha determinado que dicho efecto neurotrófico va acompañado de cambios en el metabolismo y almacenamiento de dopamina. “Por ejemplo, hemos visto un incremento del 15% de la tirosina hidroxilasa, enzima limitante de la síntesis de dopamina, y un incremento de la cantidad de dopamina almacenada. Cuando hemos inducido la liberación de dopamina, mediante la administración de anfetamina, hemos observado que las neuronas que sobreexpresaban TFEB liberan el doble de dopamina en el estriado. Una vez establecidos estos efectos, nos propusimos determinar el efecto neuroprotector de la sobreexpresión de TFEB en un modelo de la enfermedad de Parkinson inducido por la toxina MPTP. El MPTP es un tóxico que se demostró hace más de 30 años que induce parkinsonismo en humanos. En nuestros ratones, el MPTP produjo una muerte neuronal del 30%, pero si las neuronas sobreexpresaban TFEB se observaba una protección total tanto a nivel de los cuerpos neuronales como a nivel de las terminales en el estriado”, señala el investigador.
Frente a MPTP, el TFEB sobreexpresado permite recuperar el tamaño neuronal inicial
Asimismo, estas neuronas mantenían su funcionalidad intacta, ya que liberaban dopamina cuando se administraba anfetamina. A nivel conductual, los déficits motores inducidos en el ratón no son iguales que los que se pueden observar en los pacientes; no obstante, sí que presentan déficits motores cuantificables. “En nuestro caso -prosigue en declaraciones a www.farmacosalud.com-, como sólo sobreexpresamos TFEB en una de las dos sustancias negras, en el caso de que el TFEB no sólo protegiera las neuronas físicamente, sino que mantuviera su funcionalidad, observaríamos una conducta rotacional debido al desequilibrio entre ambos hemisferios. Efectivamente, observamos esta conducta rotacional que demostraba la preservación de la funcionalidad de las neuronas”.
A todo esto, se observó que el MPTP inducia una atrofia neuronal antes de matar a las neuronas, y que esta atrofia neuronal se mantenía en las neuronas que sobrevivían. La atrofia se puso de manifiesto por una reducción del tamaño celular de un 20%. “No obstante, en los ratones que sobreexpresaban TFEB se recuperaba el tamaño neuronal inicial”, asegura el doctor Bové.

(de izq. a dcha): Albert Torra, investigador predoctoral, y Dr. Jordi Bové
Fuente: VHIR / Vall d’Hebron Hospital Campus
En resumen: el efecto neurotrófico conlleva el crecimiento neuronal, la activación de las vías de supervivencia que confieren neuroprotección y el restablecimiento de las neuronas afectadas. "Y este efecto neurotrófico no sólo es capaz de prevenir la muerte neuronal sino que también es capaz de rescatar neuronas que han quedado afectadas por la enfermedad", aduce Bové a través de un comunicado del VHIR. Es decir, las neuronas que sufren una disfunción, una atrofia, con la sobreexpresión de TFEB recuperan su tamaño normal y su funcionalidad. Y eso, "sumado a que la sobreexpresión de TEFB es capaz de incrementar los niveles de dopamina, tenemos un efecto triple: neuroprotector, de neurorescate y de restablecimiento de los niveles de dopamina", añade.
El efecto neuroprotector va más allá del efecto de activación autofágica lisosomal
La enfermedad de Parkinson cursa con un déficit lisosomal y una acumulación de agregados proteicos como es el caso de los cuerpos de Lewy. Conociendo que TFEB coordina la expresión de proteínas involucradas en los lisosomas y en la degradación de autofagia, los investigadores testaron esta estrategia descubriendo que el efecto neuroprotector de TFEB iba más allá del efecto de activación del sistema autofágico lisosomal. De este modo, comprobaron que "la sobreexpresión de TFEB en neuronas dopaminérgicas comportaba un efecto neurotrófico, es decir, un efecto a nivel de crecimiento neuronal, de la activación de vías de supervivencia y de los mecanismos antiapoptópicos", comenta el responsable del estudio.
En relación con dicho alcance neurotrófico, vieron que el efecto era el mismo que ya se había descrito con otros factores neurotróficos. Este tipo de factores se han testado en ensayos clínicos y una de las posibles explicaciones del fracaso en la enfermedad de Parkinson se atribuye a una posible disminución en la regulación de los receptores por los que actúan, lo que haría que no tuvieran efecto. Y lo que permite la sobreexpresión de TEFB es activar los mecanismos de supervivencia intrínsecos, dentro de la célula, sin necesidad de receptores y evitando el fracaso.
(Imagen modificada) Autor/a del original: mconnors
Fuente: www.morguefile.com (free photo)
La sobreexpresión no genera ningún efecto adverso aparente
Aparte de este incremento de las vías de supervivencia que confieren neuroprotección, otro aspecto importante que se describe en el estudio es la capacidad de modular el metabolismo de la dopamina. "Hemos visto que TFEB no sólo incrementa las enzimas involucradas en la síntesis de la dopamina, sino que también aumenta la cantidad de dopamina que se puede liberar", comenta el Dr. Bové. Por tanto, estamos hablando de una estrategia neuroprotectora y también de una estrategia para restablecer los niveles de dopamina. "Y este efecto es muy importante a nivel del control de la sintomatología de la enfermedad", añade.
Los científicos, además, no han observado que la sobreexpresión de TFEB haya supuesto ningún efecto adverso aparente para los ratones. “No obstante, no se ha realizado una batería extensa de test conductuales para descartar cualquier alteración en la conducta”, matiza el doctor Bové.
La sobreexpresión de TFEB en esos animales se consiguió mediante un vector viral adeno-asociado que contiene el ADN de TFEB. El vector viral permite la introducción del ADN, y una vez en la neurona, se empieza a expresar la proteína utilizando la maquinaria de la célula neuronal. Para ello se tuvo que inyectar el vector viral en el cerebro justo encima de la sustancia negra compacta, donde se encuentran las neuronas que degeneran en la enfermedad de Parkinson, mediante cirugía estereotáxica que permite la administración del vector con mucha precisión.
Aunque no se descarta la terapia génica, se apuesta por la activación farmacológica
La enfermedad de Parkinson se caracteriza por la muerte de las neuronas dopaminérgicas de la sustancia negra pars compacta, que implica una disminución de los niveles de dopamina en el estriado. Es cierto que se ven afectadas otras zonas del cerebro, pero la principal sintomatología, sobre todo a nivel motor, se debe a la muerte de las neuronas dopaminérgicas de la sustancia negra pars compacta. Hoy en día aún se desconoce la causa exacta por la que mueren las neuronas, de manera que el tratamiento farmacológico se basa en el restablecimiento de los niveles de dopamina. A pesar de que permite revertir inicialmente la sintomatología (disminución de los movimientos, inestabilidad postural, temblor en reposo, etc.), llega un momento en que deja de funcionar y aparecen otras complicaciones. Por tanto, "es muy importante establecer estrategias neuroprotectoras que detengan la progresión de la enfermedad", afirma el investigador.
Autor/a de la imagen: Enric Arandes
Fuente: E. Arandes / www.farmacosalud.com
"En este sentido, nosotros planteamos la sobreexpresión de TFEB como una estrategia que se puede trasladar a la clínica porque hemos visto que funciona en un modelo de Parkinson en ratones. La proponemos como una alternativa a los factores neurotróficos, ya que podrían evitar los motivos por los que éstos fracasan. Aunque no se descarta la terapia génica para conseguir la sobreexpresión de TFEB, nosotros apostamos por la activación farmacológica", apunta.
Según el doctor Bové, “la idea es utilizar un fármaco no tanto que induzca la sobreexpresión de TFEB, sino que sea capaz de activar TFEB e inducir su translocación al núcleo donde ejerce su función de factor de transcripción. En nuestro caso, hemos observado que la sobreexpresión de TFEB implica su activación y localización en el núcleo. Afortunadamente, el TFEB no es una diana terapéutica nueva y ya hace unos años que se están realizando esfuerzos para obtener un activador, ya sea mediante el diseño de nuevos fármacos o por reposicionamiento. Básicamente el TFEB captó el interés como diana terapéutica cuando se describió su papel en la biogénesis lisosomal y como inductor de autofagia, motivo por el cual quisimos investigar el TFEB inicialmente. No obstante, nuestros resultados demuestran que los mecanismos de neuroprotección van mucho más allá de la activación del sistema autofágico-lisosomal”.
El diagnóstico de la enfermedad de Parkinson se basa en la aparición de los síntomas motores característicos, que se ponen de manifiesto cuando una gran proporción de las neuronas dopaminérgicas de la sustancia negra han desaparecido. “Por lo tanto -sostiene el investigador-, en el caso de que se pudiera aplicar una terapia neuroprotectora, sólo se podrían salvar aquellas (células) que todavía no han sucumbido. También es cierto que, probablemente, una proporción importante de neuronas no ha muerto, pero son disfuncionales. Nosotros creemos que la activación de TFEB podría detener la muerte neuronal, rescatar a las neuronas disfuncionales e incrementar la producción de dopamina de todas ellas. Por lo tanto, es posible que la sintomatología se pudiera revertir o minimizar en función del grado de muerte neuronal en el momento de empezar el tratamiento”.




