Introducción
En Junio del 2013, la agencia europea del medicamento (EMA) aprobaba el uso del biosimilar de Infliximab (CT-P13) para pacientes adultos y pediátricos en todas las indicaciones del producto original.[1] Las indicaciones del biosimilar para enfermedad inflamatoria intestinal (EII), fueron extrapoladas a partir de las conclusiones de equivalencia y eficacia clínica demostrada en estudios realizados en pacientes con espondilitis anquilosante (EA) y artritis reumatoide (AR).[2,3] Aunque inicialmente la no existencia de ensayos clínicos controlados de pacientes con patología intestinal condicionó ciertas precauciones en su utilización, en la actualidad el escenario es diferente, siendo frecuente en práctica clínica su utilización en pacientes naïve a anti-TNFs como primera opción dada su adecuada relación coste-efectividad. La inmunogenicidad asociada al empleo del tratamiento y fundamentalmente, la relacionada con los cambios de molécula original a biosimilar CT-P13, siguen planteando dudas en cuanto a la aparición de pérdida de respuesta al realizar el cambio en pacientes estables o de incremento en el desarrollo de anticuerpos, que son el motivo de esta revisión.

Doctora Ana Echarri Piudo
Fuente: Dra. Ana Echarri Piudo
Eficacia y seguridad del cambio de infliximab original a CT-P13 en enfermedad inflamatoria intestinal
1. Estudios prospectivos con seguimiento menor o igual a 6 meses
El estudio finlandés de Eberl et al[4], presenta los resultados de 62 pacientes (32 con E.Crohn EC y 30 con colitis ulcerosa CU) en los que realizan seguimiento durante 16 semanas tras el cambio de IFX original a biosimilar CT-P13. En términos globales no se objetivaron diferencias significativas en la actividad de la enfermedad y los niveles de calprotectina tras el cambio. Aunque en conjunto para las dos enfermedades, no se apreciaron diferencias significativas en los niveles medios de fármaco antes y después del cambio, en los análisis individuales, los pacientes con CU presentaron unos niveles de fármaco significativamente más bajos tras el cambio (aunque dentro del rango de nivel (3-7mg/L)). Dos pacientes desarrollaron anticuerpos presentando uno de ellos recurrencia clínica. La incidencia de reacciones infusionales fue baja (2.5%) y durante las 16 semanas de seguimiento todos los pacientes continuaron con la medicación.
PROSIT-BIO, estudio italiano prospectivo de análisis de efectividad y seguridad de pacientes tratados con CT-P13 que pertenecen a tres categorías diferentes: pacientes naïve a antiTNF, previamente tratados con Infliximab con suspensión por diferentes motivos y un grupo de 97 pacientes con EII en donde el IFX original es cambiado por el biosimilar, que son los que nos interesan en esta revisión.[5] El 94% de estos pacientes con switch de tratamiento, continúan durante las 24 semanas que dura el estudio con el mismo tratamiento. El índice de reacciones infusionales en este grupo de pacientes fue de un 7.2%.
El estudio noruego de Buer et al.[6], evalúa la eficacia del tratamiento, las modificaciones de niveles medios de fármaco y el desarrollo de anticuerpos, durante los 6 meses de seguimiento a 143 pacientes (99 con EC y 44 con CU) en tratamiento de mantenimiento con Infliximab original, en los que se realiza el cambio a biosimilar. El 97% de los pacientes continúan con el biosimilar al final del estudio, produciéndose cuatro suspensiones de tratamiento pero sólo 2 relacionadas con efectos secundarios del mismo. Destaca la necesidad de intensificación del biosimilar en el 23% de los pacientes, aunque en muchos casos motivado por la detección de un nivel bajo de fármaco sin manifestaciones clínicas de pérdida de respuesta. Sólo un 0.7% de los pacientes presentaron reacciones infusionales al fármaco tras el cambio y en un 3.5% de los casos se detectaron anticuerpos anti-IFX tras la modificación del tratamiento.
Fuente: Archivo
2. Estudios prospectivos con seguimiento mayor a 6 meses
Rasanskaite et al[7], valoraron la aparición de efectos secundarios o de pérdida de respuesta de 143 pacientes (118 EC, 25 UC) tras el cambio de tratamiento a biosimilar. El grupo de pacientes fue seguido durante 1 año sin apreciar diferencias en la actividad de la enfermedad y en los niveles de fármaco. Además se comparó con un grupo de 120 pacientes que continuaron el tratamiento con IFX original, sin observarse diferencias significativas en pérdida de respuesta entre grupos.
El grupo español liderado por Arguelles[8], realizó un seguimiento durante 12 meses a un grupo de 98 pacientes (67 EC y 31 UC), en los que se había realizado un cambio de tratamiento desde IFX original a biosimilar CT-P13. A la entrada en el estudio un 83.6% de los pacientes con EC estaba en remisión frente al 63% de los pacientes en remisión al finalizar el estudio, calculándose un mantenimiento de la remisión del 69.8%. El 81% de los pacientes con CU mantenían la remisión al año, detectándose efectos adversos en un 11% de los casos.
Avouac et al[9], exponen la experiencia del grupo francés tras realizar el cambio de tratamiento en 260 pacientes con diferentes patologías de los cuales 64 están en tratamiento con IFX original por una EII. Se analizan las pérdidas de respuesta o la aparición de efectos secundarios evaluados tras la tercera infusión del biosimilar con un seguimiento medio de 34 semanas. El 87% de los pacientes mantenían el tratamiento al final del estudio con una frecuencia escasa de efectos secundarios importantes.
83 pacientes holandeses con EII (57 con EC y 26 con CU) son evaluados al año de seguimiento tras el cambio de tratamiento a biosimilar por Smits et al.[10] El 82% de los pacientes mantenían el tratamiento hasta el final del estudio, con suspensión en un 13% por efectos secundarios o pérdida de respuesta. No se apreciaron modificaciones significativas del nivel de fármaco con aparición de anticuerpos anti-IFX en un 8%.
Uno de los estudios más importantes realizados para analizar el impacto del cambio a biosimilar, es el ensayo clínico NOR-SWITCH, randomizado y doble ciego patrocinado por el Gobierno noruego.[11] El ensayo, de 52 semanas de seguimiento, compara los resultados en eficacia de dos ramas de tratamiento (continuación con IFX original vs biosimilar CT-P13). Participaron en el estudio 482 pacientes con las diferentes patologías que se consideran indicaciones de tratamiento, que fueron randomizados en dos brazos de tratamiento con 241 pacientes/brazo. 247 pacientes padecían una EII (155 pacientes con EC y 92 con CU). En todas las indicaciones se produce un empeoramiento de la enfermedad sin diferencias significativas entre ambos grupos (26.2% en grupo IFX original vs 29.6% en grupo biosimilar). (Figura 1)
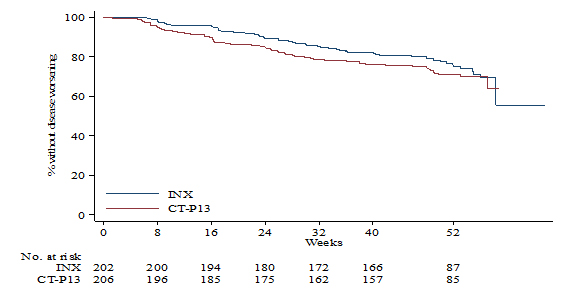
Figura 1. Estudio NOR-SWITCH. Desarrollo de pérdida de respuesta en paciente en tto con IFX original vs biosimilar.
Jongersen et al. Lancet 2017
La frecuencia de eventos adversos fue similar en los dos grupos de tratamiento (9% biosimilar vs 10% original), sin diferencias significativas en el porcentaje de pacientes que suspenden el tratamiento al final del estudio (IFX original (4%) vs biosimilar CT-P13 (3%). Los niveles de fármaco y la incidencia de anticuerpos (en torno al 8%), fue igualmente similar para ambos grupos. Los resultados del ensayo revelan una eficacia similar para el tratamiento biosimilar y el tratamiento con el producto original, concluyendo que los pacientes podrían efectuar el cambio con seguridad.
Análisis de resultados y comparación con la evidencia disponible
Aproximadamente un 37% de los pacientes con EC presentan pérdida de respuesta durante el tratamiento de mantenimiento con IFX original[12], calculándose un riesgo de pérdida de un 13% por paciente/año. Para la colitis ulcerosa, los resultados de pérdida de respuesta publicados, ascienden hasta un 55% al año en algunas series.[13]
Los resultados del estudio NOR-SWITCH[11], sitúan en torno a un 30% el desarrollo de pérdida de respuesta independientemente del tratamiento de mantenimiento (IFX original vs switch a biosimilar), muy en la línea de la evidencia disponible. La suspensión del tratamiento en los estudios publicados tras el cambio a biosimilar se sitúa en torno al 13%, que es la cifra ya conocida de riesgo de suspensión del tratamiento/año para el IFX original. La frecuencia de aparición de anticuerpos anti-IFX varía entre un 6 y un 46%, produciéndose la mayoría en los primeros 12 meses de tratamiento; se pueden encontrar ADA transitorios hasta en un 26% de los pacientes.[14] En los estudios analizados el porcentaje de desarrollo de anticuerpos se sitúa entre un 3.5 y un 8%, muy en el rango de la evidencia disponible, y en general, los efectos secundarios y las reacciones infusionales tras el cambio ha sido bajo en todos los estudios, consistente con los datos disponibles para IFX-original a largo plazo (Tabla 1)
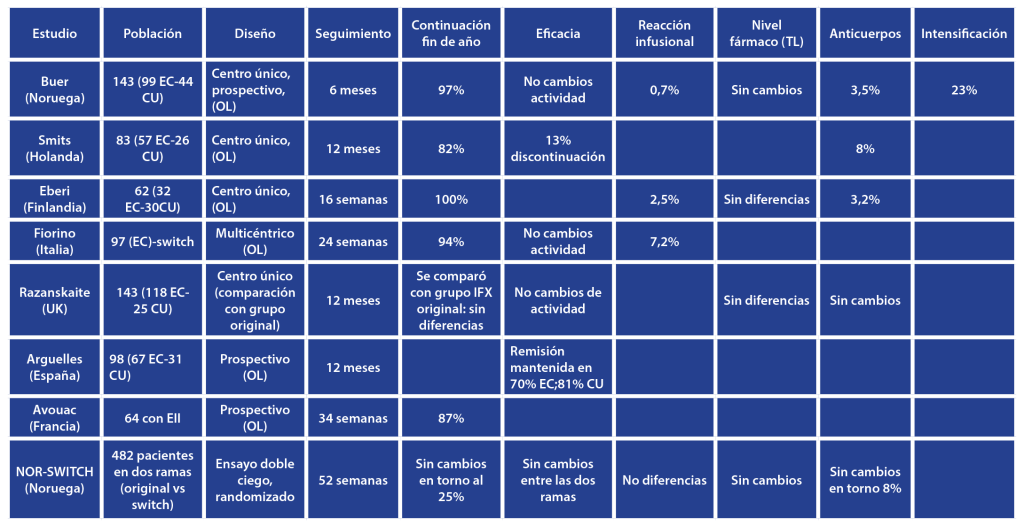
Tabla 1. Estudios switch infliximab-biosimilar con seguimiento a corto y largo plazo
En Octubre del 2016, se realizó una reunión de consenso ECCO con el fin de evaluar y clarificar diferentes aspectos del tratamiento con biosimilares en la EII que se ha publicado recientemente.[15] Los resultados de la reunión quedaron reflejados en “8 declaraciones”, que resumen la idea que se ha querido transmitir con esta revisión.
Conclusiones de la ECCO en relación con el tratamiento con biosimilares
1. La biosimilaridad se caracteriza en ensayos in vitro, no en estudios clínicos.
2. Los estudios clínicos de equivalencia en la indicación más sensible, proporcionan la base para la extrapolación.
3. Los datos para el uso de biosimilares en la EII pueden extrapolarse desde otra indicación. Cuando un producto biosimilar está registrado en la UE, se considera tan eficaz como el producto de referencia.
4. La demostración de la seguridad de los biosimilares requiere estudios con seguimiento a largo plazo en pacientes con EII. Registros (fabricantes, asociaciones, pacientes).
5. Los eventos adversos y la pérdida de respuesta se presumen serán los mismos.
6. Importancia de la trazabilidad del fármaco y estrategia robusta de farmacovigilancia.
7. El cambio del original a un biosimilar en pacientes con IBD es aceptable. Falta evidencia científica y clínica respecto a cambios inversos, múltiples y cruzados.
8. Debe realizarse el cambio del original a un biosimilar después de un consenso entre médicos, enfermeras, farmacéuticos y pacientes.
Bibliografía
1. European Medicine Agency. [EMA/CHMP/589422/2013]. 2013.
http:// www.ema.europa.eu/docs/en_GB/document_library/EPAR_-_Public_ assessment_report/human/002778/WC500151490.pdf. Ultimo acceso 20 Noviembre 2017.
2. Park W, Hrycaj P, Jeka S, et al. A randomised, double-blind, multicentre, parallel-group, prospective study comparing the pharmacokinetics, safety, and efficacy of CT-P13 and innovator infliximab in patients with ankylosing spondylitis: the PLANETAS study. Ann Rheum Dis 2013;72:1605–12.
3. Yoo DH, Hrycaj P, Miranda P, et al. A randomised, double-blind, parallelgroup study to demonstrate equivalence in efficacy and safety of CT-P13 compared with innovator infliximab when coadministered with methotrexate in patients with active rheumatoid arthritis: the PLANETRA study. Ann Rheum Dis 2013;72:1613–20
4. Eberl A, Huoponen S, Pahikkala T, et al. Switching maintenance infliximab therapy to biosimilar infliximab in inflammatory bowel disease patients. Scand J Gastroenterol 2017; 52: 1348-1353.
5. Fiorino G, Manetti N, Armuzzi A, et al. The PROSIT-BIO cohor: a prospective observational study of patients with IBD treated with Infliximab biosimilar. Inflamm Bowel Dis 2017; 23:233-243.
6. Buer L, Moum B, Cvancorova M, et al. Switching from Remicade to Remsima is well tolerated and feasible: a prospective, open-label study. J Crohns Colitis 2017; 11:297-304.
7. Razanskaite V, Bettey M, Downey L, et al. Biosimilar infliximab in IBD: outcomes of a managed switching programme. J Crohns Colitis 2017; 11:690-696.
8. Argüelles-Arias F, Guerra MF, Perea R, et al. Switching from reference infliximab to CT-P13 in patients with inflammatory bowel disease: 12 months results. Eur J Gastroenterol Hepatol 2017; 29: 1290-1295.
9. Avouac J, Moltó A, Abitvol V, et al. Systematic switch from innovator infliximab to biosimilar infliximab in inflammatory chronic diseases in daily clinical practice: the experience of Cochin University Hospital, France. Seminars in arthritis and Rhemuatism
10. Smits L, Grelack A, Derikx D, et al. Long-term clinical outcomes after switching from Remicade to biosimilar CT-P13 in IBD. Dig Dis Sci 2017; 62: 3117-3122.
11. Jorgensen K, Olsen I, Goll G, et al. Switching from originator infliximab to biosimilar CT-P13 compared with maintained treatment with originator infliximab (NOR_SWITCH): a 52-week, randomised, double-blind, non-inferiority trial. Lancet 2017; 10: 2304-2316.
12. Gisbert JP, Panes J. Loss of response and requirement of infliximab dose intensification in Crohn’s disease: a review. Am J Gastroenterol 2009; 104:760–767.
13. Reinisch W, Sandborn WJ, Rutgeerts P, Feagan BG, Rachmilewitz D, Hanauer SB, et al. Long‐term infliximab maintenance therapy for ulcerative colitis: the ACT‐1 and ‐2 extension studies. Inflamm Bowel Dis 2012; 18:201–211.
14. Ungar B, Chowers Y, Yavzori M, et al. The temporal evolution of antidrug antibodies in patients with IBD treated with Infliximab. Gut 2014; 63: 1258-1264.
15. Danese S, Fiorino G, Raine T, et al. ECCO position statement on the use of biosimilars for IBD. An update. J Crohns Colitis 2017; 11:26-34




