Redacción Farmacosalud.com
La compañía biotecnológica Amgen anuncia la comercialización en España de LUMYKRAS® (sotorasib) para el tratamiento del cáncer de pulmón no microcítico (CPNM) avanzado, con mutación KRASG12C y previamente tratado1, tras su inclusión en la prestación farmacéutica del Sistema Nacional de Salud (SNS) en base a los datos del estudio fase I/II, CodeBreaK 1002. El nuevo fármaco es la primera terapia dirigida aprobada en el mundo3,4 para este tipo de pacientes con CPNM avanzado y supone el primer inhibidor de la mutación KRASG12C[1,5], un hito científico histórico para el que han sido necesarios más de 40 años de investigación. De hecho, durante décadas se había pensado que esta mutación no era tratable farmacológicamente2. “La verdad es que sotorasib es un gran avance de la medicina… un gran paso adelante que los pacientes -en especial los que tienen esta mutación- estaban esperando, porque no había ningún fármaco que pudiera prescribirse para este tipo de alteración”, señala Bernard Gaspar, presidente de la Asociación Española de Afectados de Cáncer de Pulmón (AEACaP).
Difusión: AMGEN / agencia Torres y Carrera
El oncogén KRAS, una de las mutaciones genéticas más comunes relacionadas con el cáncer, genera una proteína participante en la multiplicación, maduración y supervivencia de las células del organismo. Este oncogén fue descubierto en 1982 de forma independiente por tres grupos de investigación, incluido el liderado por el bioquímico español Mariano Barbacid, quien por aquel entonces trabajaba en el Instituto Nacional del Cáncer de Estados Unidos. “Es una alegría inmensa para Amgen formar parte de este hito científico y ofrecer una nueva opción terapéutica a los pacientes con este tipo de cáncer de pulmón tan agresivo y difícil de tratar”, señala Miquel Balcells, director Médico de Amgen Iberia.
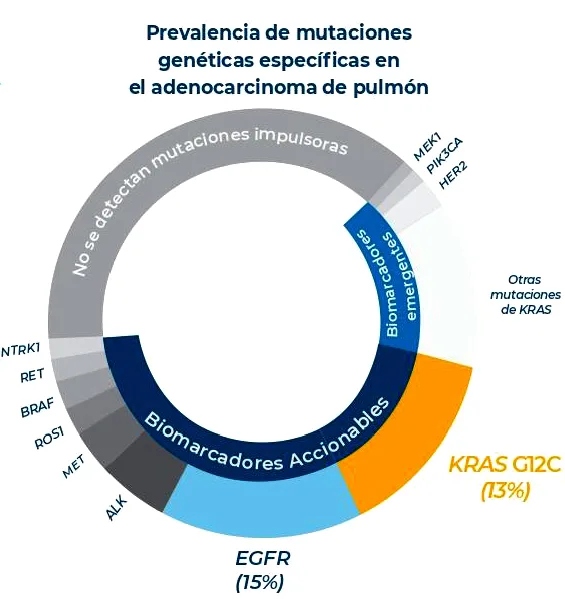
La mutación KRASG12C representa más del 13% de los casos de CPNM en España
Alrededor de 30.000 personas en España sufren cáncer de pulmón no microcítico, lo que supone el 85% del total de casos. Se trata de uno de los tumores más agresivos que existen y, de hecho, hasta el 66% de los afectados presentan enfermedad localmente avanzada o metastásica en el momento del diagnóstico6. La mutación KRASG12C, contra la que se dirige sotorasib, es una de las más frecuentes en este tipo de cáncer, representando más del 13% de los casos de CPNM en España6.
“Los pacientes con cáncer de pulmón no microcítico tienen un pronóstico muy desfavorable, por lo que la llegada de sotorasib es una muy buena noticia para ellos, ya que es uno de los tumores con mayor tasa de mortalidad”, apunta el Dr. Mariano Provencio, presidente del Grupo Español de Cáncer de Pulmón (GECP) y jefe del Servicio de Oncología Médica del Hospital Puerta de Hierro (Majadahonda, en Madrid). En 2021, se registraron más de 22.000 muertes por cáncer de pulmón, según la Sociedad Española de Oncología Médica (SEOM)6.
El programa de desarrollo clínico CodeBreaK para el fármaco sotorasib de Amgen se ha diseñado para tratar a enfermos con un tumor sólido avanzado con la alteración KRASG12C y abordar la necesidad médica no cubierta desde hace tiempo para esta patología. Los resultados de la fase 2 del estudio CodeBreaK 1002 en pacientes con CPNM, con KRASG12C y previamente tratados, cuya variable principal fue la tasa de respuesta objetiva, sirvieron como base para la la autorización condicional del medicamento por parte de la EMA (Agencia Europea del Medicamento)3 y ahora para su entrada en el SNS español.
La toma oral favorece la adherencia terapéutica
En este ensayo, en el que participaron 126 enfermos con CPNM, sotorasib se administró en dosis de 960 mg por vía oral una vez al día y demostró una tasa de respuesta objetiva del 37,1% y una mediana de duración de la respuesta de 11,1 meses. Además, el estudio fase III, CodeBreaK 200, en el que han participado 12 hospitales españoles, ha permitido comprobar tanto la eficacia como la seguridad del nuevo medicamento7. Los datos de esta investigación indican que, en comparación con el tratamiento estándar, sotorasib logra reducir el riesgo relativo de progresión de la enfermedad o muerte en un 34%, mejorando además la calidad de vida de los pacientes, quienes presentan síntomas menos graves y ven como transcurre más tiempo hasta el deterioro global de su salud. “Sin duda alguna, y tal y como está ahora mismo la investigación, sabemos que cualquier fármaco dirigido hacia una mutación mejora la supervivencia y, sobre todo, la calidad de vida de los pacientes. Porque, quizás, son medicamentos que directamente van encaminados a tener menos eventos adversos que los fármacos tradicionales. También es de resaltar que sotorasib pueda tomarse de forma oral, lo que facilita mucho su administración y, en consecuencia, ayuda a lograr una mayor adherencia terapéutica”, apunta Gaspar.
"Los datos obtenidos con el ensayo de fase III de sotorasib son alentadores. Ese 34% de reducción del riesgo relativo de progresión o muerte es significativo en el grave contexto del CPNM avanzado, y la disponibilidad de una terapia oral dirigida a la mutación KRASG12C como sotorasib marca un avance importante en el tratamiento de estos pacientes”, remarca el Dr. Luis Paz-Ares, investigador principal del ensayo CodeBreak 200 y jefe de servicio de Oncología Médica del Hospital Universitario 12 de Octubre (Madrid). Además, la llegada del nuevo medicamento "demuestra que es posible inhibir KRAS, algo que hasta hace no mucho creíamos que era imposible”, añade Paz-Ares.

(de izq. a dcha): Bernard Gaspar, presidente de la Asociación Española de Afectados de Cáncer de Pulmón; Dr. Luis Paz-Ares, investigador principal del ensayo CodeBreak 200 y jefe de servicio de Oncología Médica del Hospital Universitario 12 de Octubre (Madrid); Miquel Ballcels, director Médico de Amgen Iberia; Dr. Mariano Provencio, presidente del Grupo Español de Cáncer de Pulmón (GECP) y jefe del Servicio de Oncología Médica del Hospital Puerta de Hierro (Majadahonda, en Madrid), y Dr. Mariano Barbacid, jefe del grupo de oncología experimental del Centro Nacional de Investigaciones Oncológicas (CNIO)
Fuente: AMGEN / agencia Torres y Carrera
“Sotorasib, el primer hito de un esfuerzo colectivo que por fin ha dado sus frutos”
Para el Dr. Barbacid, jefe del grupo de oncología experimental del Centro Nacional de Investigaciones Oncológicas (CNIO), la llegada a España de sotorasib es motivo de orgullo: “me alegra enormemente ver materializado el trabajo que empezamos hace ya más de cuatro décadas en Estados Unidos y con el que seguimos investigando ahora en España. Sotorasib representa el primer hito de un esfuerzo colectivo de años que por fin ha dado sus frutos”.
“Las terapias personalizadas frente a KRAS suponen un gran avance en el tratamiento de los pacientes con cáncer de pulmón. Estoy convencido que este hito científico que hoy representa sotorasib va a abrir las puertas en un futuro no muy lejano al desarrollo de otros inhibidores selectivos de KRAS para el tratamiento de otros tumores como es el adenocarcinoma ductal de páncreas, el más mortal de todos los cánceres”, señala el bioquímico.
El tumor pulmonar maligno es la principal causa de muerte relacionada con los tumores malignos en España y es el responsable de tantas defunciones como el cáncer de colon, el cáncer de mama y el cáncer de próstata juntos6. Las tasas de supervivencia global del CPNM están mejorando, pero siguen siendo bajas para los pacientes con afección avanzada. De hecho, la supervivencia a 5 años es sólo del 9% para aquellos con enfermedad metastásica8. KRASG12C, que es la mutación de KRAS más frecuente en el CPNM, está presente en alrededor del 13% de los sujetos con esta patología5,9,10. Las necesidades médicas no cubiertas siguen siendo altas y las opciones de tratamiento son limitadas para los pacientes con CPNM con KRASG12C cuyo tratamiento de primera línea no ha funcionado o ha dejado de funcionar.
Amgen ha asumido uno de los retos más difíciles de los últimos 40 años en la investigación del cáncer al desarrollar sotorasib, un inhibidor del KRASG12C[1,5]. El nuevo fármaco, administrado oralmente una vez al día, ha demostrado un perfil beneficio-riesgo positivo con una actividad anticancerosa rápida, profunda y duradera en pacientes con CPNM localmente avanzado o metastásico previamente tratado y que presentan dicha mutación1,2,7. Amgen está avanzando en el mayor y más amplio programa de desarrollo de KRASG12C a nivel mundial con una velocidad sin precedentes y, en esta línea, está explorando más de 10 regímenes de combinación del medicamento, incluidos los tripletes, con la participación de centros de ensayos clínicos en los cinco continentes. Hasta la fecha se ha tratado a más de 15.000 enfermos en todo el mundo a través del programa de desarrollo clínico y el uso comercial11.
En mayo de 2021, sotorasib fue el primer antiKRASG12C en recibir la aprobación regulatoria en todo el mundo con su aprobación de forma acelerada en Estados Unidos10 y, de forma condicional, en la Unión Europea en enero de 20223.
Referencias
1. Sotorasib. Ficha técnica. https://cima.aemps.es/cima/dochtml/ft/1211603001/FT_1211603001.html
2. Skoulidis F, et al. N Engl J Med. 2021;384:2371-2381.
3. EMA: https://wwwext.amgen.com/newsroom/press-releases/2022/01/european-commission-approves-lumykras-sotorasib-for-patients-with-kras-g12cmutated-advanced-nonsmall-cell-lung-cancer
4. FDA: https://www.fda.gov/news-events/press-announcements/fda-approves-first-targeted-therapy-lung-cancer-mutation-previously-considered-resistant-drug
5. Canon J, et al. Nature. 2019;575: 217–223
6. SEOM. “Las cifras del cáncer 2023 en España”. Disponible en: https://seom.org/images/Las_cifras_del_Cancer_en_Espana_2023.pdf (Acceso enero 2024)
7. de Langen AJ, Johnson ML, Mazieres J, et al. Sotorasib versus docetaxel for previously treated non-small-cell lung cancer with KRAS(G12C) mutation: a randomised, open-label, phase 3 trial. Lancet 2023;401:733-46.
8. Lung Cancer Europe. Types of lung cancer and staging. Available at: https://www.lungcancereurope.eu/lung-cancer/types-of-lung-cancer-and-staging/ Accessed January 2023
9. Finn SP, Addeo A, Dafni U, et al. Prognostic Impact of KRAS G12C Mutation in Patients With NSCLC: Results From the European Thoracic Oncology Platform Lungscape Project. J Thorac Oncol 2021;16:990-1002.
10. Marin E, Teixido C, Carmona-Rocha E, et al. Usefulness of Two Independent DNA and RNA Tissue-Based Multiplex Assays for the Routine Care of Advanced NSCLC Patients. Cancers (Basel) 2020;12.
11. https://wwwext.amgen.com/newsroom/press-releases/2023/12/amgen-provides-regulatory-update-on-status-of-lumakras-sotorasib




