Redacción Farmacosalud.com
Pfizer anuncia que el Comité de Productos Médicos para Uso Humano (CPMH) de la Agencia Europea de Medicamentos (EMA, por sus siglas en inglés) ha adoptado una opinión positiva, recomendando Sirolimus (Rapamune®) para el tratamiento de pacientes con linfangioleiomiomatosis esporádica (S-LAM). Si se aprueba, Sirolimus podría usarse para tratar una enfermedad pulmonar rara y progresiva. Esto haría que Rapamune® sea la primera terapia aprobada para estabilizar la función pulmonar en pacientes con LAM esporádica en la Unión Europea.
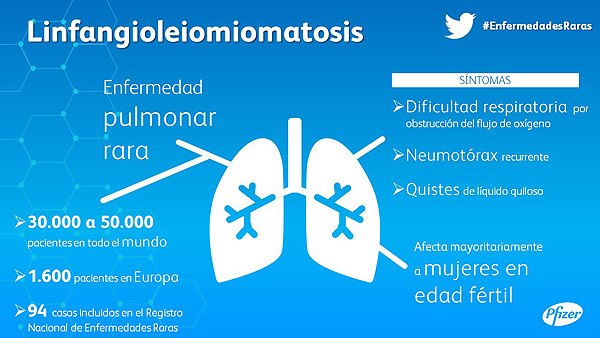
LAM es una enfermedad pulmonar rara y progresiva que se caracteriza por dificultad respiratoria, neumotórax recurrente y quistes de líquido quiloso. Mayoritariamente aparece en mujeres de edad fértil y es debida a la proliferación de células del músculo liso en los pulmones. Este crecimiento celular puede causar que el tracto respiratorio se constriña gradualmente, inhibiendo así el flujo de oxígeno. Se estima que su prevalencia a nivel mundial, es de cinco casos por millón de personas. Esto sugeriría que hay de 30.000 a 50.000 pacientes en todo el mundo. Aproximadamente 1.600 pacientes en Europa han sido diagnosticadas con esta enfermedad rara[1]. En España, hasta la fecha, hay 94 casos incluidos en el Registro Nacional de Enfermedades Raras[2].
Fuente: Pfizer /Agencia Ketchum / OmnicomPRGroup
Un agente inmunosupresor
La opinión positiva sobre Rapamune® para la terapia de la LAM esporádica se basa en los resultados del estudio MILES (en español: Multicentro Internacional sobre la eficacia de Sirolimus en la linfangioleiomiomatosis)[3]. Este estudio incluyó 89 pacientes de LAM con disfunción pulmonar moderada, la mayoría de las cuales tenía LAM esporádica. Las pacientes tratadas con Rapamune® durante un año experimentaron una estabilización de la función pulmonar (medida por el volumen espiratorio forzado en un segundo, FEV1) versus placebo.
Las reacciones adversas observadas en este ensayo fueron consistentes con el perfil de seguridad conocido en los pacientes con trasplante renal que recibieron Rapamune®.
Rapamune® es un agente inmunosupresor aprobado en Europa desde 2001 para la profilaxis del rechazo de órganos en pacientes adultos con trasplante de riñón con un riesgo inmunológico bajo o moderado.[4]
Referencias
1. Wirtz H; Lymphangioleiomyomatosis.ZentralblChir138(Suppl 1):59–74
2. Registro Nacional De Enfermedades Raras Del Instituto De Salud Carlos III. https://registroraras.isciii.es/Comun/Inicio0.aspx , acceso el 10 de julio de 2018.
3. McCormack FX, Inoue Y, Moss J, Singer LG, Strange C, Nakata K, et al. Efficacy and safety of sirolimus in lymphangioleiomyomatosis. N Engl J Med. 2011;364(17):1595-606
4. Ficha técnica de Rapamune, Febrero 2017




