Introducción.
Dr. Luis Alejandro Pérez de Llano
Asma y EPOC son dos enfermedades prevalentes en la población general (4-7% y 10% respectivamente) que pueden coincidir en un mismo individuo (1-2). Esta coincidencia se ha denominado ACOS (Asthma/COPD overlap syndrome) o FMEA (fenotipo mixto asma/EPOC). El fenotipo es cualquier característica detectable de un organismo (estructural, bioquímica, fisiológica o conductual) determinada por una interacción entre su genotipo y su medio. Se ha extendido el empleo de este término con el objetivo de agrupar pacientes que -dentro de una misma enfermedad- comparten atributos distintivos y establecer así características diferenciales que tengan significación clínica. Está claro que no estamos ante un “fenotipo” (entendido como subtipo) del asma o de la EPOC, sino ante la coexistencia de ambas enfermedades, y por ello se debe desestimar este vocablo para designar esta asociación. Por otra parte, “síndrome” se define como un conjunto de síntomas que se presentan juntos y son característicos de una enfermedad o de un cuadro patológico determinado provocado, en ocasiones, por la concurrencia de más de una enfermedad. De acuerdo con ello, parece más razonable hablar de un síndrome de solapamiento asma-EPOC (SSAE), pero para que ello tenga verdadero sentido, debería estar definido por una base biológica, presentar unas características clínicas y pronósticas diferenciales y precisar un tratamiento más o menos específico. En la cohorte de COPDGene, esta coexistencia se ha cifrado en un 12% (3), prácticamente la misma proporción que muestra el estudio PLATINO (4). Estas cifras se han obtenido de poblaciones enfocadas al estudio de la EPOC y podrían variar, ser menores con toda probabilidad, si procediesen de muestras de asmáticos.
Fundamento biológico.
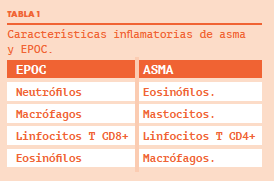
Tanto el asma como la EPOC son dos enfermedades inflamatorias de la vía aérea. Su naturaleza es, sin embargo, muy diferente.
Con la imprecisión que conlleva cualquier generalización, podría decirse que las respuestas inflamatorias características de asma y EPOC son del tipo Th2 y Th1 respectivamente. La coincidencia de ambas enfermedades en un individuo concreto debería caracterizarse por mostrar elementos inflamatorios propios de asma y EPOC. Es decir, debería manifestar un patrón “mixto”, con expresión de células o mediadores de la inflamación presentes en cada proceso. Esto no ha sido estudiado y no es sencillo hacerlo. Son obstáculos para ello: la dificultad técnica (biopsias bronquiales o recuento celular en el esputo), la ausencia de biomarcadores fiables de respuesta Th1 y Th2, la variabilidad intraindividual de los patrones inflamatorios a lo largo del tiempo (bien de forma espontánea o como resultado de cambios terapéuticos) y la plausible heterogeneidad inflamatoria en diferentes pacientes con SSAE (es lógico pensar que, por ejemplo, en pacientes más fumadores, o con EPOC más grave, el predominio del patrón Th1 será mayor). Por otra parte, cabe cuestionarse qué mínimo exigible de ambos tipos de respuesta inflamatoria es imprescindible para aceptar el diagnóstico de SSAE. Todas estas cuestiones permanecen abiertas.
Sabemos, según los resultados de un subanálisis del estudio SARP, que la coincidencia en el esputo de >2% de eosinófilos y de >40% de neutrófilos se relaciona con una peor función pulmonar, mayor morbilidad y más agudizaciones (5). Desde el otro punto de vista, los pacientes con EPOC y eosinofilia en el esputo tienen más frecuencia de positividad de los test cutáneos, mayores valores de FENO, un nivel de IgE más elevado en sangre y peor función pulmonar (6,7). Sin embargo, un análisis de la cohorte ECLIPSE concluyó que los pacientes con EPOC y eosinofilia persistente en sangre (definida como ≥ 2%) representaban un 37% del total y que este grupo se caracterizaba por mejor función pulmonar, un valor menor del BODE y menos síntomas (8). Además, existe una amplia evidencia de que los pacientes con EPOC y eosinofilia significativa responden mejor al tratamiento con corticoides que aquellos que no presentan esta característica (9-12). Se podría decir que la neutrofilia empeora el curso del asma pero el papel de la eosinofilia en la EPOC no está tan claro, aunque sí se puede asegurar que indica una mejor respuesta al tratamiento esteroideo.
Parece razonable pensar que el SSAE ocurriría en un paciente, más o menos sintomático, que tendría una inflamación asmática subyacente, posiblemente por un determinante genético. Al fumar, desarrollaría características típicas de la inflamación de EPOC que se superpondrían a las previas. Una posibilidad más remota sería que un paciente con EPOC ya consolidado sufriese un asma de inicio tardío, pero no está nada claro si los pacientes que desarrollan asma a edades avanzadas tenían previamente cierto componente inflamatorio en la vía aérea o éste es de nueva aparición.
Características clínicas diferenciales del síndrome asma/EPOC.
En la cohorte del COPDgene (3), se pudo comprobar que los pacientes del grupo overlap sufren más exacerbaciones graves que los que sólo padecen EPOC (33% vs 18%). Además estos pacientes, en un análisis multivariante ajustado por edad, sexo, raza y tabaquismo tenían peor calidad de vida (5.2 puntos más en el cuestionario SGRQ). Los resultados del estudio PLATINO son muy parecidos, los encuadrados en el grupo SSAE tenían un mayor riesgo de exacerbaciones (prevalence ratio [PR], 2.11; 95% CI, 1.08-4.12), hospitalizaciones (PR, 4.11; 95% CI, 1.45-11.67), y peor estado general de salud (PR, 1.47; 95% CI, 1.18-1.85). En el estudio EPI-SCAN, realizado en España en el que se clasifica como SSAE un 17% de los sujetos, éstos se caracterizan por presentar más disnea, sibilancias, peor calidad de vida, menor actividad física y agudizaciones frecuentes (13).
Diagnóstico.
La guía GESEPOC (14) propone un diagnóstico del SSAE basado en criterios clínicos (la presencia de dos criterios mayores o uno mayor y dos menores sería definitoria).

Sin embargo, este enfoque no se ha mostrado muy útil en la práctica clínica real. La nueva versión de la GINA propugna confrontar en un check-list las características clínicas y funcionales más típicas de EPOC y asma. Cuando en un paciente coinciden en un número suficiente aspectos propios de ambas enfermedades, estaríamos ante un SSAE (15).
Se podría proponer un enfoque más práctico, basado en pruebas utilizadas en la práctica clínica diaria de los dos procesos.
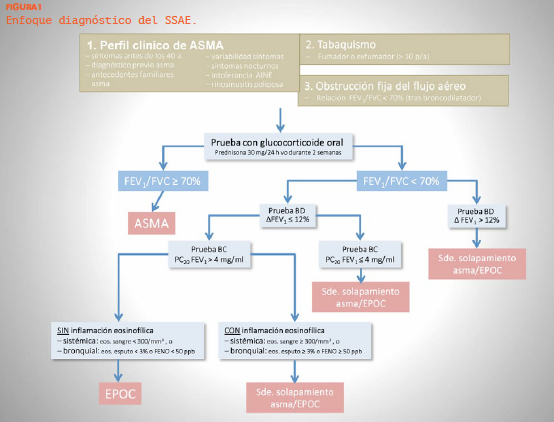
Fuente: Dr. Luís. A. Pérez de Llano
Por supuesto, este esquema diagnóstico plantea problemas: pacientes con EPOC pueden tener un test bd positivo, o un test de metacolina positivo, incluso sin que haya ninguna relación con el asma. El hecho de que se exijan síntomas sugestivos de asma, puede minimizar falsos positivos. Por otra parte, el patrón inflamatorio es variable espontáneamente o al cambiar las condiciones clínicas o terapéuticas. Si nos fijamos en los síntomas orientativos de asma, quizás los más valiosos sean el inicio temprano (ya que la EPOC no suele aparecer por debajo de los 40 años), los síntomas nocturnos y la variabilidad (que también pueden ocurrir en la EPOC) y la comorbilidad rinosinusal (que también puede ocurrir en la EPOC, aunque más raramente).
Lo ideal sería disponer de biomarcadores que identificasen los pacientes con SSAE. Recientemente, un grupo inglés (16) ha pretendido diferenciar a los pacientes con asma y EPOC según la presencia o no de ciertos biomarcadores (sorprendentemente, no hubo diferencias significativas en el número de neutrófilos y eosinófilos entre ambas enfermedades). Los mejores discriminadores de asma resultaron ser dos quimiocinas: CCL-5 (recluta células T, eosinófilos y basófilos) y CCL-11 (factor quimiotáctico de células T activadas). En el caso de la EPOC, lo fueron la IL-6 y el CCL2 (recluta monocitos, células dendríticas y células T). Encontraron un clúster de pacientes que reunía características biológicas comunes de asma y EPOC (en su mayoría con un patrón neutrofílico y elevados niveles en esputo de IL1β, IL8, IL10 y TNFα). Se debe reseñar que estos pacientes no podrían ser clínicamente catalogados como SSAE (sólo el 37% de los asmáticos reclutados había fumado alguna vez y el índice de paquetes/año era < 10). Otros biomarcadores como la periostina, la FENO o el nivel de eosinófilos en sangre no han sido validados en el SSAE.
Tratamiento.
El tratamiento deberá ir enfocado a reducir las exacerbaciones, mejorar la función pulmonar y disminuir los síntomas. Para lograr el primer objetivo, son indispensables los corticoides inhalados (CIs). Para mejorar los síntomas y la función pulmonar poca duda nos queda acerca de la eficacia de los LABA (formoterol y salmeterol), tanto en pacientes con EPOC como en asmáticos. El tiotropio ha demostrado ser capaz de reducir exacerbaciones en la EPOC (17) y también logró disminuir en un 21% las exacerbaciones graves en asmáticos insuficientemente controlados con una combinación de CI y LABA, al tiempo que mejoró la función pulmonar, aunque sin que se apreciase un impacto clínicamente relevante en síntomas y calidad de vida (18). No hay experiencia suficiente con otros broncodilatadores como el glicopirronio, aclidinio o indacaterol.
Fármacos biológicos como el omalizumab, mepolizumab o dupilumab se han mostrado eficaces para disminuir exacerbaciones en asmáticos graves, pero, dado que los pacientes con un hábito tabáquico significativo fueron excluidos de los ensayos clínicos, desconocemos su utilidad en el fenotipo mixto asma/EPOC y su uso no puede ser recomendado en este momento.
Conclusiones.
-No se conoce la naturaleza biológica del SSAE y, por lo tanto, toda definición es por fuerza inexacta y basada en datos clínicos o analíticos que son inespecíficos.
-Se piensa que aproximadamente el 12% de los pacientes con EPOC podrían ser encuadrados en el SSAE. Estos pacientes están más sintomáticos y tienen más riesgo de exacerbaciones.
-La neutrofilia empeora la evolución del asma. El papel de la eosinofilia en la EPOC es más controvertido, aunque indica buena respuesta a los corticoides.
-Es necesario desarrollar biomarcadores que permitan identificar el SSAE.
-Los pacientes con SSAE deben ser tratados con una combinación CI/LABA. El tiotropio puede ser útil si la respuesta es insuficiente. Es posible que, en un futuro, puedan beneficiarse de agentes biológicos.
Radiografía en 3D que muestra una enfermedad pulmonar obstructiva crónica.
Fuente: www.farmacosalud.com
Referencias.
- 1. Soriano JB, Ancochea J, Miravitlles M, y cols. Recent trends in COPD prevalence in Spain: a repeated cross-sectional survey 1997-2007. Eur Respir J. 2010 36(4): 758-65.
- 2. Urrutia I, Aguirre U, Sunyer J, y cols. Changes in the prevalence of asthma in the Spanish cohort of the European Community Respiratory Health Survey (ECRHS-II)]. Arch Bronconeumol. 2007; 43(8): 425-30.
- 3. Hardin M, Silverman E, Barr G, y cols, for the COPDGene Investigators. The clinical features of the overlap between COPD and asthma. Respiratory Research 2011, 12:127.
- 4. Menezes AM, Montes de Oca M, Pérez-Padilla R, y cols; PLATINO team. Increased risk of exacerbation and hospitalization in subjects with an overlap phenotype: COPS-Asthma. Chest 2014; 145 (2): 297-304.
- 5. Hastie AT, Moore WC, Meyers DA, y cols. Analyses of asthma severity phenotypes and inflammatory proteins in subjects stratified by sputum granulocytes. J Allergy Clin Immunol. 2010; 125(5): 1028-1036.
- 6. Chou KT, Su KC, Huang SF, y cols. Exhaled nitric oxide predicts eosinophilic airway inflammation in COPD. Lung. 2014; 192(4): 499-504.
- 7. Lams BE, Sousa AR, Rees PJ, y cols. Subepithelial immunopathology of the large airways in smokers with and without chronic obstructive pulmonary disease. Eur Respir J. 2000; 15(3): 512-6.
- 8. Singh D, Kolsum U, Brightling CE, y cols. Eosinophilic inflammation in COPD: prevalence and clinical characteristics. Eur Respir J. 2014; 44(6): 1697-700.
- 9. Brightling CE, McKenna S, Hargadon B, y cols. Sputum eosinophilia and the short term response to inhaled mometasone in chronic obstructive pulmonary disease. Thorax 2005; 60: 193–198.
- 10. Brightling CE, Monteiro W, Ward R, et al. Sputum eosinophilia and short-term response to prednisolone in chronic obstructive pulmonary disease: a randomised controlled trial. Lancet 2000; 356: 1480–1485.
- 11. Leigh R, Pizzichini MM, Morris MM, et al. Stable COPD: predicting benefit from high-dose inhaled corticosteroid treatment. Eur Respir J 2006; 27: 964–971. 4
- 12. Pizzichini E, Pizzichini MM, Gibson P, et al. Sputum eosinophilia predicts benefit from prednisone in smokers with chronic obstructive bronchitis. Am J Respir Crit Care Med 1998; 158: 1511–1517.
- 13. Miravitlles M, Soriano JB, Ancochea J, y cols. Characterisation of the overlap COPD-asthma phenotype. Focus on physical activity and health status. Respir Med. 2013; 107: 1053-60.
- 14. Grupo de trabajo de GESEPOC. Guía de práctica clínica para el diagnostico y tratamiento de pacientes con EPOC. Arch Bronconeumol. 2012; 48(Supl 1): 2-58.
- 15. http://www.ginasthma.org/documents/4.
- 16. Ghebre MA, Bafadhel M, Desai D, y cols. Biological clustering supports both "Dutch" and "British" hypotheses of asthma and chronic obstructive pulmonary disease. J Allergy Clin Immunol. 2015; 135(1): 63-72.
- 17. Tashkin DP, Celli B, Senn S, y cols; UPLIFT Study Investigators. A 4-year trial of tiotropium in chronic obstructive pulmonary disease. N Engl J Med. 2008; 359(15): 1543-54.
- 18. Kerstjens HA, Engel M, Dahl R, y cols. Tiotropium in asthma poorly controlled with standard combination therapy. N Engl J Med. 201; 367(13): 1198-207.