Redacción Farmacosalud.com
La compañía GSK ha presentado nuevos datos de su vacuna candidata frente al herpes zóster, Shingrix®, en la conferencia científica Infectious Disease Week (IDWeek) celebrada en Nueva Orleans, Luisiana (Estados Unidos). Los datos procedían de estudios que evaluaban la coadministración de la vacuna candidata de GSK con la vacuna frente a la gripe, una pauta vacunal flexible y el impacto de la vacuna en la calidad de vida.
Resumen de los nuevos datos
-Se evaluó el impacto de la vacuna en la calidad de vida de los adultos que participaron en el ZOE-50 (NCT01165177) y en el ZOE-70 (NCT01165229), dos estudios multicéntricos del programa clínico global de fase III de la vacuna candidata. Como se esperaba, gracias a la gran eficacia observada en todos los rangos de edad en estos dos ensayos pivotales, solo algunos sujetos del brazo vacunal desarrollaron casos de herpes zóster ‘breakthrough’ tras la vacunación. Empleando una sólida encuesta relacionada con el estado de salud, aquellos que habían desarrollado un herpes zóster mostraron niveles inferiores de dolor en comparación con el grupo control. El estudio concluyó que, además de prevenir el herpes zóster, la vacuna candidata también redujo la gravedad del herpes zóster en los pocos sujetos del grupo vacunal que desarrollaron la enfermedad.
-En el programa de desarrollo clínico de fase III, los adultos a partir de 50 años recibieron dos dosis de la vacuna candidata con un intervalo de dos meses de diferencia entre ambas. En un nuevo estudio (ZOSTER-026) en el que participaron 354 sujetos se demostró que la segunda dosis del preparado se podría administrar entre los dos y seis meses tras la primera dosis, con una respuesta inmune similar y un perfil de seguridad comparable.
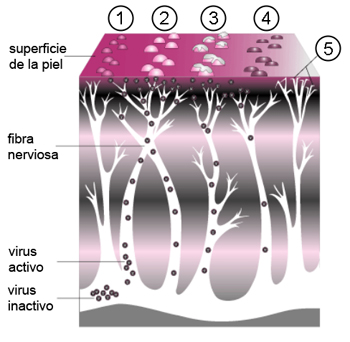
Evolución del herpes zóster: un grupo de pequeñas protuberancias (1) se convierten en ampollas (2) que se asemejan a lesiones de la varicela; las ampollas se llenan de pus, se abren (3), forman una costra (4), y finalmente desaparecen pudiendo producir daño a los nervios (5).
Autor/a de la imagen: A_Course_of_Shingles_diagram.png: Renee Gordon
derivative work: DPC (talk)
Fuente: Wikipedia / David Perez
-En un estudio (ZOSTER-004) llevado a cabo durante la temporada de gripe en el hemisferio norte en el año 2013 en adultos a partir de los 50 años se demostró que, cuando se administraba la vacuna candidata a la vez que la vacuna frente a la gripe estacional no adyuvada, ambas vacunas se toleraban bien y la respuesta inmune a cada una era similar tanto si se administraban al mismo tiempo como por separado.
En todo el programa de desarrollo clínico, el riesgo observado de que se produjesen acontecimientos adversos, enfermedades potencialmente mediadas por el sistema inmune o muertes, fue similar en personas que recibían Shingrix o placebo. La reacción adversa local notificada con mayor frecuencia fue el dolor en el lugar de la inyección y la reacción adversa sistémica notificada con mayor frecuencia fue el cansancio. La mayoría de reacciones adversas locales y sistémicas se produjeron en un plazo de siete días tras la vacunación, la mayoría duraron entre 1 y 3 días y, por lo general, eran de una intensidad leve o moderada.
GSK incluyó datos sobre la pauta vacunal flexible y la coadministración con la vacuna frente a la gripe estacional no adyuvada en su dossier de registro para la autorización de la vacuna candidata ante la Food and Drug Administration (FDA) el 24 de octubre de 2016. Los datos también formarán parte de las solicitudes de autorización en otras partes del mundo que están previstas para este año.
Un preparado vacunal que contiene glicoproteína E
Shingrix® es una vacuna de subunidades, adyuvada, para prevenir el herpes zóster y sus complicaciones, y contiene la glicoproteína E, una proteína que se encuentra en el virus de la varicela zóster (VVZ), causante del herpes zóster, y un sistema adyuvante, AS01B, cuyo objetivo es potenciar la respuesta inmune al antígeno[1]. GSK tiene intención de registrar el producto como Shingrix®, con sujeción a la aprobación por parte de los órganos de revisión normativa pertinentes. El nombre de Shingrix® todavía no está aprobado por las autoridades regulatorias para su uso en ningún país.
Referencias
1. Shingles (Herpes Zoster) Clinical Overview. US Centers for Disease Control and Prevention. Acceso en: http://www.cdc.gov/shingles/hcp/clinical-overview.html on 6 Sept 2016




