Redacción Farmacosalud.com
La Agencia Española del Medicamento y Productos Sanitarios (AEMPS) ha autorizado un estudio clínico con el dispositivo de ventilación de emergencia RESPIRA, diseñado por GAPInnnova. Es el segundo dispositivo desarrollado con el apoyo del conocimiento del Hospital Clínic, el Instituto de Investigación Germans Trias i Pujol (IGTP) y la Facultad de Medicina y Ciencias de la Salud de la Universidad de Barcelona, que recibe esta aprobación. Este estudio clínico inicialmente se hace en el Clínic y Can Ruti y se ampliará a otros hospitales del resto de España cuando se disponga de los datos de los primeros pacientes.
Fuente: Hospital Clínic
Esta iniciativa ha sido posible gracias al apoyo recibido por un gran número de particulares, empresas y entidades de la sociedad civil. También ha contado con el apoyo del Servicio Catalán de la Salud, que ha propiciado la incorporación de empresas y ha apoyado a los centros para encontrar este tipo de soluciones.
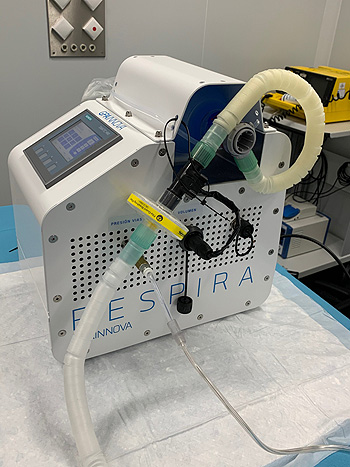
Control remoto de variables como la frecuencia y el volumen de aire y oxígeno
El dispositivo RESPIRA automatiza los dispositivos de reanimación manual (BMV o AMBU), presentes actualmente de forma generalizada en los centros sanitarios, y permite asistir de manera mecánica al paciente. Tiene unas prestaciones que permiten monitorizar en tiempo real las variables de los pacientes de forma personalizada y controlarlos de forma remota para facilitar su gestión en los hospitales. RESPIRA incorpora la electrónica necesaria para controlar de forma remota variables como la frecuencia y el volumen de aire y oxígeno aportados al paciente, que proporciona SIEMENS, y un aparato de impulsión de precisión fabricado por SMC.
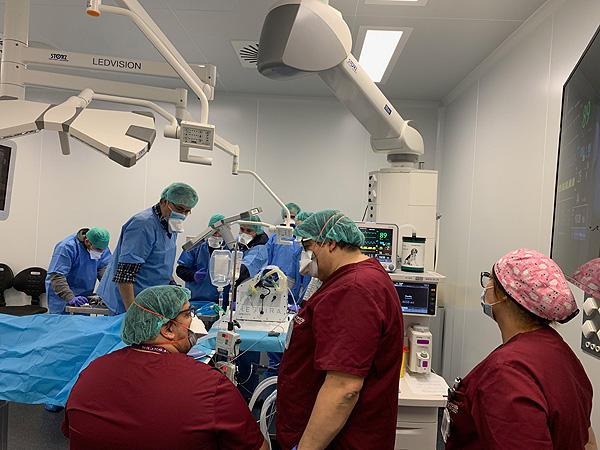
El pasado martes 31 de marzo terminaron las pruebas de validación en el Hospital Clínic de Barcelona con un simulador y el 1 de abril se realizaron con animales, en el Centro de Medicina Comparativa y Bioimagen (CMCiB) del Instituto de Investigación Germans Trias i Pujol. Paralelamente, tal como establecen las directrices de la AEMPS, se han realizado las pruebas de compatibilidad electromagnética para asegurar que el dispositivo no interfiere en el resto de dispositivos de las instalaciones sanitarias. Ahora ya se ha recibido la autorización de la AEMPS para el estudio clínico con pacientes afectados por el COVID-19.
El equipo que ha supervisado las simulaciones lo han formado el Dr. Josep M. Nicolás, especialista en medicina intensiva del Clínic y Prof. de la UB, el Dr. Ramón Farré, catedrático de Fisiología de la UB y jefe del grupo Biofísica respiratoria y bioingeniería del IDIBAPS, y el Dr. Manel Puig, del Instituto de Investigación y Hospital Germans Trias i Pujol. El proyecto también cuenta con la participación de Joan Grasas, emprendedor en tecnología de la salud y consultor en innovación vinculado al Instituto Catalán de la Salud (ICS) y los Drs. Jaume Pérez Payarols, Martí Pons, Maria Cols y Arnau Valls del Hospital de Sant Joan de Deu de Barcelona.
Fuente: Hospital Clínic
Ahora, el equipo de producción está preparado para comenzar su fabricación en el momento en que la AEMPS homologue el dispositivo. GPAInnova calcula que inicialmente se podrán producir más de 100 unidades diarias y entre 700 y 1.000 unidades semanales cuando su producción esté plenamente industrializada. La empresa catalana MAM colabora en la industrialización y producción, que se realizará en la fábrica de Santa Perpetua de Mogoda.




