Redacción Farmacosalud.com
La Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) informa de la retirada del mercado de los Sistemas de control de TP/INR (tiempo de protrombina/ratio normalizado internacional) Alere INRatio®/INRatio®2, utilizados para la determinación del tiempo de protombina en sangre en personas que toman anticoagulantes orales, y emite recomendaciones dirigidas a profesionales sanitarios y pacientes. La AEMPS ha tenido conocimiento a través de la Autoridad Competente de los Estados Unidos (FDA) de la retirada del mercado de los Sistemas de Control TP/INR Alere INRatio®, fabricados por Alere San Diego, Inc. EEUU. Esta retirada afecta tanto los medidores de TP/INR Alere INRatio®/INRatio®2 como a las tiras reactivas Alere INRatio®/INRatio®2.
El sistema de control de TP/INR (tiempo de protrombina/ratio normalizado internacional) Alere INRatio®/INRatio®2 se utiliza para la medición cuantitativa del tiempo de protrombina (TP) en sangre completa capilar fresca. Estos productos de diagnóstico in vitro están indicados para uso profesional o para autodiagnóstico en personas que toman anticoagulantes orales y que necesitan controlar el tiempo de coagulación de la sangre. En diciembre de 2014, Alere emitió una Nota sobre las limitaciones del sistema Alere INRatio® en pacientes con determinadas afecciones médicas e incluyó recomendaciones para la derivación de los pacientes y comprobación periódica del INR por un método de INR de laboratorio. La AEMPS distribuyó esta información a los centros sanitarios, a través de los puntos de Vigilancia de Productos Sanitarios de las Comunidades autónomas.

Sistemas para el control de la coagulación TP/INR Alere INRatio®/INRatio®2
Fuente: AEMPS
Recientemente, Alere ha decidido iniciar la retirada voluntaria del Sistema Alere INRatio® del mercado y dejar de fabricar esta línea de productos. La empresa continuará fabricando y distribuyendo las tiras reactivas Alere INRatio® durante un periodo de tiempo para que se pueda realizar la transición a un método de análisis de TP/INR alternativo, como puede ser el método de INR de laboratorio basado en plasma o un sistema de control de otro fabricante. Mientras se siga utilizando el sistema Alere INRatio® se deberán seguir las precauciones y recomendaciones indicadas en la nota de diciembre de 2014. La empresa está enviando dos notas de aviso a los distribuidores y profesionales sanitarios que distribuyen o disponen de los productos afectados en España en las que se incluyen las recomendaciones y acciones a seguir. Asimismo, está facilitando a los profesionales sanitarios una nota para entregar a los pacientes que estén utilizando estos sistemas para supervisar su INR de forma domiciliaria.
Producto afectado
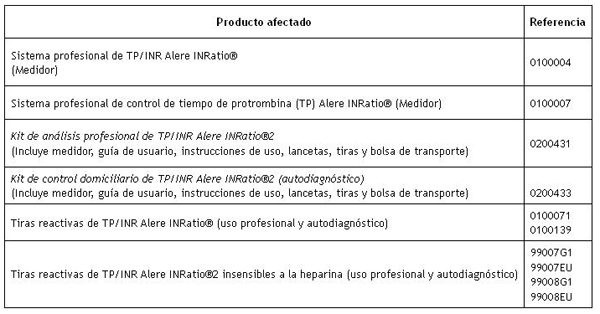
Fuente: AEMPS
Recomendaciones
Profesionales sanitarios de centros sanitarios
1. Si en su centro utilizan los sistemas de control de TP/INR Alere INRatio® cambie a un método alternativo y devuelva los medidores a la empresa.
2. Mientras continúe utilizando los sistemas de control de TP/INR Alere INRatio® siga las precauciones y recomendaciones indicadas en la nota de diciembre de 2014.
3. Contacte con los pacientes que estén utilizando estos sistemas en sus domicilios, realíceles una comprobación periódica del INR utilizando un método de INR de laboratorio, cámbieles a un método alternativo y facilíteles la nota de aviso de la empresa con las recomendaciones para la devolución del medidor.
Oficinas de farmacia
1. Si en su establecimiento utilizan los sistemas de control de TP/INR Alere INRatio® cambie a un método alternativo y devuelva los medidores a la empresa.
2. Si dispone de Kits de control domiciliario de TP/INR Alere INTatio®2 no los entregue a pacientes.
3. Si ha vendido medidores del sistema de control de TP/INR Alere INRatio®/INRatio®2 a pacientes, intente identificarlos para compartir con ellos esta información, entregarles la nota de la empresa e indicarles que acudan a su médico para que les cambie a otro método alternativo de análisis. Informe igualmente y entregue la nota de la empresa a cualquier paciente que le requiera las tiras reactivas.
Pacientes
Si usted, para el control de la terapia con anticoagulantes orales utiliza el sistema de control de TP/INR Alere INRatio®:
1. Contacte con su médico lo antes posible para que le cambie a un método de TP/INR alternativo. Mientras no disponga de otro método alternativo, puede continuar usando el sistema Alere INRatio®.
2. Una vez que su médico le haya cambiado a un método alternativo, contacte con Alere España en el teléfono 936008010, o por correo electrónico en la dirección bar.servicioclientes@alere.com para la devolución del medidor y deseche las tiras reactivas que no haya utilizado, indican desde la AEMPS.

Fuente: www.farmacosalud.com
No a la comercialización de los medicamentos veterinarios a base de colistina
Por otro lado, la AEMPS también informa que, con fecha de 14 de julio de 2016, la Comisión Europea adoptó la Decisión de Ejecución de la Comisión C(2016) 4708 final en el marco del artículo 35 de la Directiva 2001/82/CE del Parlamento Europeo y del Consejo, sobre el arbitraje de todos los medicamentos veterinarios a base de colistina en combinación con otras sustancias antimicrobianas para administración por vía oral. La Decisión establece la obligación a las Autoridades competentes nacionales de retirar las autorizaciones de comercialización de estos medicamentos veterinarios según las conclusiones científicas recogidas en su anexo II, en particular:
-Los titulares de las autorizaciones de comercialización no proporcionaron datos convincentes, de ensayos clínicos u otros estudios científicamente aceptables, en cuanto a los escenarios clínicos en los que los productos en combinación con colistina serían fundamentales para los animales productores de alimentos en la UE en comparación con los productos en monoterapia.
-Se consideró que incluso un uso limitado de productos en combinación con colistina produce un uso innecesario de colistina y podría contribuir potencialmente al desarrollo de resistencia antimicrobiana.
-El desarrollo de resistencia antimicrobiana a colistina es un riesgo para la salud humana, ya que colistina se usa también como último recurso en medicina humana en el contexto del tratamiento de infecciones bacterianas específicas muy resistentes a fármacos.
-La evaluación riesgo-beneficio en todos los medicamentos veterinarios que contienen colistina en combinación con otras sustancias antimicrobianas para administración por vía oral es negativa y que los productos podrían representar un riesgo para la salud humana.
Como consecuencia de la aprobación de la citada Decisión, la AEMPS adopta esta nota informativa dirigida a los titulares de las autorizaciones de comercialización en España de todos los medicamentos incluidos en el ámbito del arbitraje que contienen colistina en combinación con otras sustancias antimicrobianas para administración por vía oral. No se iniciarán actuaciones de retirada del mercado de los lotes de los medicamentos afectados, debido a que la Decisión no lo especifica ni insta a su inicio, y se permitirá la permanencia en el mercado de estos medicamentos durante un período máximo de 6 meses a contar desde la fecha de la resolución de la AEMPS de revocación de las correspondientes autorizaciones de comercialización. Transcurrido dicho periodo, los titulares deberán retirar del mercado todos los ejemplares existentes, apuntan desde la Agencia Española de Medicamentos y Productos Sanitarios.




