Dr. Yago González Lama / GETECCU
La asociación entre enfermedad inflamatoria intestinal (EII) y diferentes manifestaciones articulares se conoce desde hace décadas, aunque no fue hasta finales de los años noventa que se describió el patrón característico de afectación articular en el seno de la EII[1]. Cada día disponemos de mayor evidencia sobre la interrelación entre el intestino y articulaciones y del papel tan relevante de la microbiota intestinal en la patogenia de las espondiloartritis (EspA)[2].
1. CLASIFICACIÓN DE MANIFESTACIONES ARTICULARES
De acuerdo con la presentación clínica, los pacientes con EspA se pueden clasificar en dos grandes grupos: síntomas de predominio periférico (EspA-p) o axial (EspA-Ax)[3, 4], aunque ambos patrones pueden coexistir en un mismo paciente, y se pueden asociar a entesitis, dactilitis u otras manifestaciones extraarticulares, sobre todo uveítis. De forma típica, hasta un 10% de los pacientes tienen afectación cutánea que puede incluir el eritema nodoso, el pioderma gangrenoso o la estomatitis aftosa[1, 5-8]

Doctor Yago González Lama
Fuente: Dr. González Lama
1.1 Afectación axial
La afectación axial se caracteriza por la presencia de sacroilitis, a menudo asimétrica, con o sin afectación vertebral concomitante. Es algo más frecuente en Enfermedad de Crohn (EC) y en varones[1].
1.2. Artritis periférica
En general tiene curso no erosivo y no deformante. La característica clínica principal de la EspA-p es la presencia de artritis, dactilitis o entesitis. Se reconocen dos patrones diferentes, aunque en ocasiones pueden coexistir en el mismo paciente[5, 7, 9, 10, 11]:
a) Oligoartritis o tipo I (afectación de menos de cinco articulaciones)
Suele ser de curso agudo, de inicio en unas 24-48 horas y a menudo coincide con la actividad intestinal de la enfermedad, especialmente en la colitis ulcerosa (CU). Afecta sobre todo a grandes articulaciones, generalmente en las extremidades inferiores y con distribución asimétrica.
b) Poliartritis o tipo II (afectación de cinco o más articulaciones)
La poliartritis tiende a tener un curso persistente, clásicamente se considera independiente de la actividad inflamatoria intestinal de la enfermedad, y puede evolucionar a formas crónicas en alrededor del 40% de los casos. Se asocia de forma característica a uveítis pero no a otras manifestaciones extraarticulares.
1.3. Afectación articular secundaria a tratamiento
Algunos de los fármacos empleados en el tratamiento de la EII pueden producir efectos adversos articulares y que deben diferenciarse de las EspA. Los más relevantes son los ocasionados por los corticoides (osteoporosis, necrosis ósea avascular) o tiopurinas[11].
2. TRATAMIENTOS EMPLEADOS
El tratamiento convencional de las EspA incluye fundamentalmente medidas no farmacológicas y antiinflamatorios no esteroideos (AINE), ya sean clásicos o inhibidores específicos de la COX-2 (COXIB), aunque en el caso de las formas periféricas también se suele considerar la sulfasalazina (SSZ). El tratamiento biológico antiTNFα se reserva habitualmente para aquellos pacientes con EspA refractarios a la terapia convencional.
Fuente: Archivo
2.1 Medidas no farmacológicas
La piedra angular del tratamiento no farmacológico de la EspA es la educación del paciente y el ejercicio físico regular. Se debe adecuar el ejercicio al tipo de afectación articular y las características del paciente, pero en términos generales se recomiendan ejercicios de fortalecimiento muscular, mantenimiento de la forma física, estiramiento y fisioterapia cuando sea necesaria[1].
2.2. Antiinflamatorios no esteroideos clásicos e inhibidores específicos de la COX-2
Tanto los AINE clásicos como los COXIB están indicados como fármacos de primera línea para el tratamiento de los pacientes con EspA para el control del dolor y la rigidez matinal[12, 13, 14, 15].
Los analgésicos convencionales como el paracetamol se emplean con frecuencia como alternativa en pacientes en los que el uso de AINE clásicos o COXIB está contraindicado, habida cuenta de su buen perfil de seguridad especialmente desde el punto de vista gastrointestinal; sin embargo, no existe evidencia específica sobre su utilidad en EspA y un reciente metaanálisis sugiere que el uso de paracetamol en osteoartritis es inefectivo[12, 13, 16, 17].
La influencia de los AINE clásicos o de los COXIB en la actividad o aparición de recaídas en EII es controvertida, y la ficha técnica de la mayoría de los AINE recoge la recomendación de las autoridades reguladoras de no utilizarlos en las EII, lo que supone un importante condicionante en la toma de decisiones en la práctica clínica diaria. Los AINE son causa potencial de daño intestinal a nivel de intestino delgado o grueso, que no puede ser prevenido con el empleo concomitante de inhibidores de la bomba de protones y que puede ocurrir también en pacientes que no padecen EII. Si bien la toxicidad digestiva de los COXIB parece menor que la del resto de los AINE, su potencial toxicidad cardiovascular obliga a limitar su uso en el tiempo, fundamentalmente en pacientes de mayor riesgo. Diferentes estudios sugieren que los AINE se asocian a un discreto aumento del riesgo de recidiva de la EII. Aunque los datos disponibles son poco concluyentes, apuntan a que los COXIB podrían ser más seguros que los AINE clásicos en este escenario[18, 19, 20].

Fuente: Archivo
Así pues, considerando la actividad de la EII y el riesgo de toxicidad intestinal, parece prudente evitar en lo posible el empleo de los AINE clásicos e incluso de los COXIB en casos de EII activa o de difícil control. Se debe de alcanzar el control del proceso inflamatorio con los tratamientos disponibles, ya sean inmunomoduladores convencionales o biológicos, y emplear alternativas analgésicas (como el paracetamol o el tramadol) cuando sea posible. En aquellos casos en los que la EII esté bien controlada, es aceptable el uso cauteloso y durante el periodo de tiempo más corto posible de los COXIB[16, 18, 21, 22]. En caso de ser necesario el empleo de un AINE clásico por un proceso agudo intercurrente, sería conveniente escoger aquel con un mejor perfil de seguridad gastrointestinal (ibuprofeno o naproxeno)[16].
2.3. Sulfasalazina, mesalazina
Tanto SSZ como mesalazina tienen una eficacia contrastada en algunas formas de EII; sin embargo, no existe evidencia que apoye el empleo de SSZ en el manejo de la EspA-Ax, por lo que su uso no se puede recomendar. Tampoco hay datos que sugieran la utilidad de mesalazina para el tratamiento de la EspA-Ax[23, 24]. Sólo en las formas precoces de EspA-p y con elevación de la velocidad de sedimentación glomerular (VSG), SSZ parece beneficiosa, generalmente a dosis de entre 2 y 3 g al día[12, 25, 26].
2.4. Esteroides
El empleo de esteroides sistémicos a dosis bajas puede ser una opción en casos de EspA-p en los que exista contraindicación para el uso de AINE[39]. Además en formas oligoarticulares, entesíticas o dactilitis se puede aplicar en forma de infiltraciones cuyo uso viene avalado más por práctica clínica que por la evidencia científica[12, 27-29].
En los pacientes con EII que reciben corticoesteroides deben seguirse las recomendaciones para la prevención de osteoporosis inducida por corticoides[30-32].
2.5. Inmunomoduladores
Tanto metotrexato (MTX) como las tiopurinas -azatioprina (AZA) o mercaptopurina (MP)- son habitualmente empleados en el tratamiento de la EII pero no han demostrado ser efectivos en la EspA-Ax, ni en el control de los síntomas ni en la detención o retraso del daño estructural articular[23, 24]. MTX parece útil en las formas EspA-p[6,7,33], aunque la evidencia científica es escasa.

Autor/a: PublicDomainPictures
Fuente: Pixabay / Public Domain
Leflunomida también podría ser útil en la afectación periférica y la dactilitis de las EspA-p, aunque no existe evidencia de su utilidad en la afectación entesítica. Además, se ha comprobado que también podría ser útil en la EC[34, 35, 36]. Por otra parte, sus efectos secundarios, sobre todo la diarrea, limitan su uso especialmente en pacientes con EII.
Los inmunosupresores calcineurínicos como ciclosporina, de nuevo con escasa evidencia, podrían ser útiles en la EspA-p, al menos para aquellos pacientes con artritis y dactilitis, aunque no hay datos de eficacia en pacientes con entesitis[12, 13, 34].
2.6. Tratamientos biológicos antiTNFα
Los tratamientos biológicos antiTNFα en la EspA se suelen reservar para pacientes refractarios a la terapia convencional. Generalmente se considera que un paciente con EspA-Ax es refractario a terapia convencional cuando se han utilizado al menos dos AINE con potencia antinflamatoria demostrada durante un periodo de al menos cuatro semanas, a la dosis máxima recomendada o tolerada, excepto en aquellos pacientes en los que haya evidencia de toxicidad o contraindicación a los AINE. En el caso de la EspA-p, el concepto de refractariedad a la terapia convencional incluye además SSZ a dosis de 2-3g/d durante al menos 3 meses[13].
El tratamiento con antiTNFα para la EspA tiene distintas alternativas: etanercept, infliximab, adalimumab, golimumab y certolizumab, cuyas dosis y posología se resumen en la Tabla 1. En pacientes con EspA asociada a EII, deberían emplearse preferiblemente tratamientos biológicos útiles en ambas patologías: infliximab y adalimumab son eficaces en la inducción y el mantenimiento de la remisión en pacientes con EC, tanto luminal como perianal. En pacientes con CU, además de infliximab y adalimumab, golimumab también ha demostrado ser eficaz en la inducción y el mantenimiento de la remisión[37-42].
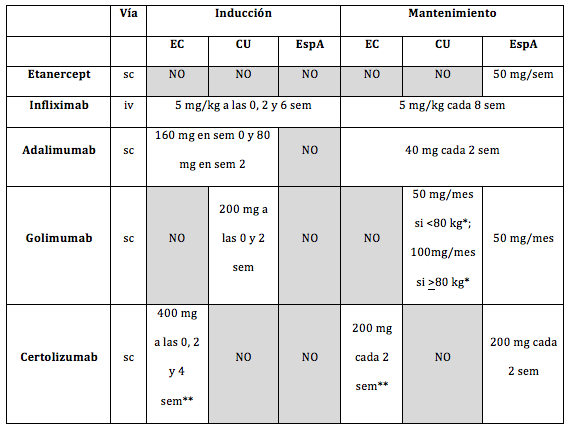
Tabla 1. Dosis y posología de los tratamientos AntiTNFα en sus diferentes indicaciones
EC: Enfermedad de Crohn / CU: Colitis Ulcerosa / EspA: Espondiloartritis / sc: administración subcutánea / iv: administración intravenosa / sem: semanas / * La dosis del tratamiento de mantenimiento aprobada para Golimumab en CU depende del peso del paciente / ** No aprobado en la Unión Europea, sólo bajo el programa de Uso Compasivo
La intensificación del tratamiento antiTNFα es una medida aceptada en casos de pérdida de eficacia, bien sea aumentando la dosis o acortando el intervalo de administración. En casos de fallo primario del tratamiento en pacientes con EspA, está aceptado igualmente el cambio de antiTNFα. En los aquellos pacientes con EspA en los que se alcanza una remisión clínica mantenida se acepta la reducción o espaciamiento de dosis, aunque se desaconseja la suspensión del tratamiento biológico, ya que existe evidencia suficiente como para considerar que la tasa de recaída es elevada[12, 13, 23, 24, 34, 43]. Por su parte, no existe evidencia que avale la retirada ni la reducción de la dosis de antiTNFα en los pacientes con EII que se encuentran en remisión.
2.7. Otros tratamientos biológicos
-Ustekinumab: su indicación para EspA y EC se encuentra en proceso de aprobación[44, 45].
-Secukinumab: ha demostrado eficacia en el tratamiento de las EspA y está recientemente autorizada su comercialización con esta indicación[46]. Sin embargo, no sólo no ha demostrado eficacia en la EII sino que además ha presentado altas tasas de efectos adversos comparado con placebo en este escenario[47].
-Vedolizumab: es útil para inducir y mantener la remisión en la EC y en la CU, pero por su acción específica en el tubo digestivo no sería esperable que fuera también útil en el tratamiento de las EspA[39, 48, 49].
3. SITUACIONES CLÍNICAS
3.1. Enfermedad inflamatoria intestinal y espondiloartritis axial activas
En pacientes con exposición previa a corticoterapia sistémica, la fractura vertebral debe ser siempre descartada[23, 24]. Los AINE son de utilidad en el manejo de la EspA-Ax, aunque deben emplearse con cautela en el tratamiento de la EspA asociada a la EII por su potencial toxicidad gastrointestinal, aunque puede ser aceptable el uso cuidadoso de COXIB durante periodos cortos[5, 7, 16, 40, 50].
Los corticoides sistémicos son eficaces en la inducción de la remisión de la EC luminal, pero no se recomiendan como tratamiento de mantenimiento ni a medio ni a largo plazo y no han demostrado ser eficaces en el control de la EspA-Ax asociada. Por otra parte, las tiopurinas (AZA o MP), habitualmente empleadas en la EII corticodependiente, no han demostrado eficacia en el control de la EspA-Ax; MTX puede ser eficaz en la EC, pero no ha demostrado eficacia en la CU ni en la EspA-Ax[12, 11, 23, 24, 42, 51].
Fuente: Archivo
Infliximab y adalimumab han demostrado ser eficaces en la inducción y el mantenimiento de la remisión tanto en la EC luminal y perianal, mientras que infliximab, adalimumab y golimumab en la CU y también en la EspA-Ax. Además, los tratamientos biológicos en la EspA-Ax están indicados en aquellos pacientes refractarios a AINE, los cuales no se pueden recomendar de manera general ni por largos periodos de tiempo en pacientes con EII. Por todo ello, se debe considerar esta alternativa de manera conjunta, gastroenterólogo y reumatólogo, e individualizada para cada paciente en el que coexistan ambas entidades, tal y como se recomienda en el primer consenso europeo sobre manifestaciones extraintestinales de la EII[5, 7, 10, 11]. Las dosis recomendables en este contexto son las que se han demostrado eficaces en la EII, ya que son mayores que las habitualmente empleadas en los pacientes que padecen exclusivamente EspA-Ax, y por tanto serían dosis eficaces para ambas patologías (Tabla 1).
3.2. Enfermedad inflamatoria intestinal y espondiloartritis periférica activas
La artritis periférica suele mejorar con AINE, pero no se pueden recomendar de manera general debido a su potencial toxicidad gastrointestinal. Los AINE deben evitarse en la medida de lo posible o al menos emplearse con cautela, siendo el empleo de ciclos cortos de inhibidores de la COX-2 aparentemente más apropiado por su perfil de seguridad en este tipo de pacientes[5, 7, 11, 22, 50].
Comúnmente se acepta que la artritis periférica (fundamentalmente la oligoartritis con o sin entesitis o dactilitis) se asocia a la actividad de la EII[5, 7, 22]. Por tanto, los esfuerzos terapéuticos deben ir encaminados a alcanzar la remisión de la EII ya sea con aminosalicilatos en el caso de la CU, corticoesteroides sistémicos o con fármacos biológicos antiTNFα, según la situación clínica[11, 22, 40, 52]. Con respecto a los tratamientos biológicos antiTNFα, las dosis y la posología se resumen en la Tabla 1.
Por otra parte, y si la afectación articular es limitante, es razonable llevar a cabo medidas específicas como el reposo, la fisioterapia o incluso la inyección local de esteroides. Aunque los aminosalicilatos no tienen una clara indicación en la EC, existen datos que justifican el tratamiento con SSZ en casos de EC y EspA-p, o incluso la sustitución de mesalazina por SSZ en pacientes con CU y EspA-p[5, 7, 23, 24].
MTX puede ser útil como tratamiento de la EC y existen datos que sugieren su utilidad en pacientes con EspA-p, por lo que puede considerarse como alternativa en la inducción de la remisión de la EC o en su mantenimiento en caso de EspA-p asociada, según las dosis y la posología que habitualmente se emplean en Reumatología, que son mayores que las que se suele utilizar en la EII. En caso de que se considere tratamiento combinado de un biológico con un inmunosupresor para la EII, podría ser razonable considerar MTX en lugar de AZA en pacientes con EspA-p asociada, teniendo en cuenta que cuando se emplea combinado con un antiTNF, parece que MTX es eficaz a partir de 12.5mg/semana[5, 7, 12, 22, 51, 53].

Autor/a: George Hodan
Fuente: www.publicdomainpictures.net
3.3. Espondiloartritis axial o periférica activa y enfermedad inflamatoria intestinal quiescente
Ante la presencia de síntomas de EspA en un paciente que no presenta síntomas digestivos evidentes, el caso debe ser evaluado por Gastroenterología para descartar actividad de la EII asociada. Si la EII se encuentra en remisión, el tratamiento debe estar orientado a conseguir la remisión de la EspA, teniendo en cuenta los tratamientos necesarios para la EII. Es útil la adopción de medidas específicas como la fisioterapia o incluso la inyección de esteroides locales[5, 7, 23, 24]. Los AINE deben emplearse con cautela, dado el riesgo de recidiva de la EII que pueden comportar, y la utilización de COXIB parece más apropiada [5, 7, 50, 54, 55]. Es conveniente emplear SSZ incluso en pacientes con EC o en lugar de mesalazina en pacientes con CU si se trata de EspA-p, no así en el caso de EspA-Ax.
El empleo de inmunosupresores para la EspA-p debe tener en cuenta la naturaleza y las necesidades terapéuticas de la EII concomitante. Así, MTX o leflunomida podrían ser alternativas razonables para controlar la EspA-p, aunque la EII puede suponer una limitación a su uso. La escasa experiencia con leflunomida en la EII así como su perfil de seguridad la hacen poco atractiva para este tipo de pacientes[13]. Por otra parte, en pacientes cuya EII se mantiene en remisión bajo tratamiento con AZA, su sustitución por MTX con la intención de controlar además los síntomas de la EspA-p debe considerarse con mucha cautela, especialmente en pacientes con CU ya que no se ha demostrado la eficacia de MTX en este tipo de pacientes[51].
En caso de que estas medidas no fueran útiles, está indicado el tratamiento biológico antiTNFα teniendo en cuenta que sería razonable su empleo según la pauta y las dosis de infliximab, adalimumab o golimumab recomendadas en Reumatología (Tabla 1), que son diferentes de las que se recomiendan para pacientes con EII[12, 23, 24]. Lo más razonable sería seleccionar el agente biológico antiTNFα que haya demostrado ser útil también en la EII que tenga cada paciente aunque ésta se encuentre inactiva. En este sentido, sólo debería considerarse golimumab en el caso de que la EII fuera CU y debería evitarse etanercept en este tipo de pacientes, no sólo porque su eficacia no se ha demostrado en EII, sino porque además se ha descrito como un posible factor desencadenante de la misma[56-58]. Dado que certolizumab no está aprobado para la EII en Europa, posiblemente tampoco sea la opción más apropiada.
Finalmente, si el paciente mantiene la EII en remisión gracias a un tratamiento antiTNFα, a pesar de lo cual la EspA permanece activa y se considera que MTX podría ser útil para controlar esta última, puede ser razonable asociar MTX al tratamiento biológico si éste se encontraba en monoterapia o incluso sustituir AZA por MTX, empleando las dosis y la vía de administración que se consideren adecuadas por parte de Reumatología. Si MTX no es útil para controlar la EspA, se puede considerar la intensificación o el cambio de biológico antiTNFα; la determinación de niveles de fármaco y anticuerpos pueden ser de ayuda en este escenario[59].
Autor/a: Виталий Смолыгин
Fuente: www.publicdomainpictures.net
3.4. Enfermedad inflamatoria intestinal activa y espondiloartritis, axial o periférica, quiescente
En aquellos casos en los que se emplean AINE para mantener la remisión de la EspA, este tratamiento debe evitarse y optar por otras alternativas como SSZ o infiltraciones locales de esteroides cuando sea posible[11, 16]. Cabe la posibilidad de que esta limitación obligue a considerar como alternativa el tratamiento antiTNFα, lo cual debe ser tenido en cuenta a la hora de plantear el tratamiento de la EII[12, 11, 23].
En el caso de la CU puede ser aconsejable incrementar las dosis de aminosalicilatos, lo cual no siempre es posible cuando se trata de SSZ, por lo que puede ser razonable optar por dosis altas de mesalazina, y añadir mesalazina tópica en los casos en los que resulte apropiado[42, 60].
Con respecto al uso de inmunomoduladores, no sería necesario cambiar de criterio si se pretende usar AZA para la EII, la alternativa más habitual, si la EspA no necesita de inmunosupresores para mantenerse en remisión[22]. Si el paciente que precisa inmunosupresores para la EII ya estaba recibiendo MTX por algún tipo de EspA-p, no es apropiada su sustitución por AZA ya que ésta no es útil en la EspA[5]. Si MTX no es útil en la inducción o el mantenimiento de la remisión de la EII a pesar de ser eficaz en el control de la EspA, estaría indicado el empleo de tratamientos biológicos, ya fueran antiTNFα o no. Por otra parte, si la EspA-p se controla con leflunomida y, dado que la diarrea es un efecto adverso frecuente, es razonable proponer una alternativa terapéutica en aquellos pacientes con actividad de la EII[7, 13].
En aquellos pacientes que mantienen la remisión de la EspA con tratamientos biológicos antiTNFα pero presentan actividad de la EII, es posible que las dosis que son suficientes para la EspA no lo sean para la EII[12, 23]. Estos pacientes se pueden beneficiar de un ajuste de dosis, pero también de la asociación de un inmunosupresor y en último término de un cambio de biológico. La posibilidad de determinar niveles de fármaco y anticuerpos puede ser de ayuda para tomar la mejor decisión[59]. Si el tratamiento antiTNFα empleado para mantener la remisión de la EspA no es apropiado para la EII, es razonable el cambio de biológico (Tabla 1). Por otra parte, si la EspA necesita de un tratamiento antiTNFα para mantenerse en remisión, es preciso evitar en la medida de lo posible el cambio de diana terapéutica en el tratamiento de la EII.
Bibliografía
1. Orchard TR, Wordsworth BP, Jewell DP. Peripheral arthropathies in inflammatory bowel disease: their articular distribution and natural history. Gut 1998; 42(3): 387-91.
2. Costello ME, Robinson PC, Benham H, Brown MA. The intestinal microbiome in human disease and how it relates to arthritis and spondyloarthritis. Best Pract Res Clin Rheumatol 2015; 29(2): 202-12.
3. Rudwaleit M, van der Heijde D, Landewe R, Akkoc N, Brandt J, Chou CT, et al. The Assessment of SpondyloArthritis International Society classification criteria for peripheral spondyloarthritis and for spondyloarthritis in general. Ann Rheum Dis 2011; 70(1): 25-31.
4. Rudwaleit M, van der Heijde D, Landewe R, Listing J, Akkoc N, Brandt J, et al. The development of Assessment of SpondyloArthritis international Society classification criteria for axial spondyloarthritis (part II): validation and final selection. Ann Rheum Dis 2009; 68(6): 777-83.
5. Olivieri I, Cantini F, Castiglione F, Felice C, Gionchetti P, Orlando A, et al. Italian Expert Panel on the management of patients with coexisting spondyloarthritis and inflammatory bowel disease. Autoimmun Rev 2014; 13(8): 822-30.
6. Salvarani C, Fries W. Clinical features and epidemiology of spondyloarthritides associated with inflammatory bowel disease. World J Gastroenterol 2009; 15(20): 2449-55.
7. Peluso R, Manguso F, Vitiello M, Iervolino S, Di Minno MN. Management of arthropathy in inflammatory bowel diseases. Ther Adv Chronic Dis 2015; 6(2): 65-77.
8. Peluso R, Di Minno MN, Iervolino S, Manguso F, Tramontano G, Ambrosino P, et al. Enteropathic spondyloarthritis: from diagnosis to treatment. Clin Dev Immunol 2013; 2013(631408.
9. Ditisheim S, Fournier N, Juillerat P, Pittet V, Michetti P, Gabay C, et al. Inflammatory Articular Disease in Patients with Inflammatory Bowel Disease: Result of the Swiss IBD Cohort Study. Inflamm Bowel Dis 2015; 21(11): 2598-604.
10. Gionchetti P, Calabrese C, Rizzello F. Inflammatory Bowel Diseases and Spondyloarthropathies. J Rheumatol Suppl 2015; 93(21-3.
11. Harbord M, Annese V, Vavricka SR, Allez M, Barreiro-de Acosta M, Boberg KM, et al. The First European Evidence-based Consensus on Extra-intestinal Manifestations in Inflammatory Bowel Disease. J Crohns Colitis 2016; 10(3): 239-54.
12. Juanola Roura X, Zarco Montejo P, Sanz Sanz J, Munoz Fernandez S, Mulero Mendoza J, Linares Ferrando LF, et al. [Consensus Statement of the Spanish Society of Rheumatology on the management of biologic therapies in spondyloarthritis except for psoriatic arthritis]. Reumatol Clin 2011; 7(2): 113-23.
13. Carmona Ortells L, Loza Santamaria E. [Management of spondyloarthritis (ESPOGUIA): methodology and general data from the document]. Reumatol Clin 2010; 6 Suppl 1(1-5.
14. Gossec L, Smolen JS, Gaujoux-Viala C, Ash Z, Marzo-Ortega H, van der Heijde D, et al. European League Against Rheumatism recommendations for the management of psoriatic arthritis with pharmacological therapies. Ann Rheum Dis 2012; 71(1): 4-12.
15. Coates LC, Kavanaugh A, Ritchlin CT. Systematic review of treatments for psoriatic arthritis: 2014 update for the GRAPPA. J Rheumatol 2014; 41(11): 2273-6.
16. Lanas A, Benito P, Alonso J, Hernandez-Cruz B, Baron-Esquivias G, Perez-Aisa A, et al. [Safe prescription recommendations for non steroidal anti-inflammatory drugs: Consensus document ellaborated by nominated experts of three scientific associations (SER-SEC-AEG)]. Gastroenterol Hepatol 2014; 37(3): 107-27.
17. da Costa BR, Reichenbach S, Keller N, Nartey L, Wandel S, Juni P, et al. Effectiveness of non-steroidal anti-inflammatory drugs for the treatment of pain in knee and hip osteoarthritis: a network meta-analysis. Lancet 2016.
18. Habib I, Mazulis A, Roginsky G, Ehrenpreis ED. Nonsteroidal anti-inflammatory drugs and inflammatory bowel disease: pathophysiology and clinical associations. Inflamm Bowel Dis 2014; 20(12): 2493-502.
19. Kefalakes H, Stylianides TJ, Amanakis G, Kolios G. Exacerbation of inflammatory bowel diseases associated with the use of nonsteroidal anti-inflammatory drugs: myth or reality? Eur J Clin Pharmacol 2009; 65(10): 963-70.
20. Hensley A, Beales IL. Use of Cyclo-Oxygenase Inhibitors Is Not Associated with Clinical Relapse in Inflammatory Bowel Disease: A Case-Control Study. Pharmaceuticals (Basel) 2015; 8(3): 512-24.
21. Feagins LA, Cryer BL. Do non-steroidal anti-inflammatory drugs cause exacerbations of inflammatory bowel disease? Dig Dis Sci 2010; 55(2): 226-32.
22. Van Assche G, Dignass A, Reinisch W, van der Woude CJ, Sturm A, De Vos M, et al. The second European evidence-based Consensus on the diagnosis and management of Crohn's disease: Special situations. J Crohns Colitis 2010; 4(1): 63-101.
23. van der Heijde D, Sieper J, Maksymowych WP, Dougados M, Burgos-Vargas R, Landewe R, et al. 2010 Update of the international ASAS recommendations for the use of anti-TNF agents in patients with axial spondyloarthritis. Ann Rheum Dis 2011; 70(6): 905-8.
24. Braun J, van den Berg R, Baraliakos X, Boehm H, Burgos-Vargas R, Collantes-Estevez E, et al. 2010 update of the ASAS/EULAR recommendations for the management of ankylosing spondylitis. Ann Rheum Dis 2011; 70(6): 896-904.
25. Braun J, Zochling J, Baraliakos X, Alten R, Burmester G, Grasedyck K, et al. Efficacy of sulfasalazine in patients with inflammatory back pain due to undifferentiated spondyloarthritis and early ankylosing spondylitis: a multicentre randomised controlled trial. Ann Rheum Dis 2006; 65(9): 1147-53.
26. Chen J, Liu C. Is sulfasalazine effective in ankylosing spondylitis? A systematic review of randomized controlled trials. J Rheumatol 2006; 33(4): 722-31.
27. Green M, Marzo-Ortega H, Wakefield RJ, Astin P, Proudman S, Conaghan PG, et al. Predictors of outcome in patients with oligoarthritis: results of a protocol of intraarticular corticosteroids to all clinically active joints. Arthritis Rheum 2001; 44(5): 1177-83.
28. Cunnane G, Brophy DP, Gibney RG, FitzGerald O. Diagnosis and treatment of heel pain in chronic inflammatory arthritis using ultrasound. Semin Arthritis Rheum 1996; 25(6): 383-9.
29. Rose S, Toloza S, Bautista-Molano W, Helliwell PS. Comprehensive treatment of dactylitis in psoriatic arthritis. J Rheumatol 2014; 41(11): 2295-300.
30. Grossman JM, Gordon R, Ranganath VK, Deal C, Caplan L, Chen W, et al. American College of Rheumatology 2010 recommendations for the prevention and treatment of glucocorticoid-induced osteoporosis. Arthritis Care Res (Hoboken) 2010; 62(11): 1515-26.
31. American Gastroenterological Association medical position statement: guidelines on osteoporosis in gastrointestinal diseases. Gastroenterology 2003; 124(3): 791-4.
32. Scott EM, Gaywood I, Scott BB. Guidelines for osteoporosis in coeliac disease and inflammatory bowel disease. British Society of Gastroenterology. Gut 2000; 46 Suppl 1(i1-8.
33. Fernandez Sueiro JL, Juanola Roura X, Canete Crespillo Jde D, Torre Alonso JC, Garcia de Vicuna R, Queiro Silva R, et al. [Consensus statement of the Spanish Society of Rheumatology on the management of biologic therapies in psoriatic arthritis]. Reumatol Clin 2011; 7(3): 179-88.
34. Coates LC, Kavanaugh A, Mease PJ, Soriano ER, Laura Acosta Felquer M, Armstrong AW, et al. Group for research and assessment of psoriasis and psoriatic arthritis: Treatment recommendations for psoriatic arthritis 2015. Arthritis Rheumatol 2016.
35. Haibel H, Rudwaleit M, Braun J, Sieper J. Six months open label trial of leflunomide in active ankylosing spondylitis. Ann Rheum Dis 2005; 64(1): 124-6.
36. Holtmann MH, Gerts AL, Weinman A, Galle PR, Neurath MF. Treatment of Crohn's disease with leflunomide as second-line immunosuppression : a phase 1 open-label trial on efficacy, tolerability and safety. Dig Dis Sci 2008; 53(4): 1025-32.
37. Sandborn WJ, Feagan BG, Marano C, Zhang H, Strauss R, Johanns J, et al. Subcutaneous golimumab induces clinical response and remission in patients with moderate-to-severe ulcerative colitis. Gastroenterology 2014; 146(1): 85-95; quiz e14-5.
38. Gilardi D, Fiorino G, Allocca M, Bravata I, Danese S. Golimumab: clinical update on its use for ulcerative colitis. Drugs Today (Barc) 2015; 51(3): 171-84.
39. Hazlewood GS, Rezaie A, Borman M, Panaccione R, Ghosh S, Seow CH, et al. Comparative effectiveness of immunosuppressants and biologics for inducing and maintaining remission in Crohn's disease: a network meta-analysis. Gastroenterology 2015; 148(2): 344-54.e5; quiz e14-5.
40. Dignass A, Van Assche G, Lindsay JO, Lemann M, Soderholm J, Colombel JF, et al. The second European evidence-based Consensus on the diagnosis and management of Crohn's disease: Current management. J Crohns Colitis 2010; 4(1): 28-62.
41. Gisbert JP, Gonzalez-Lama Y, Mate J. Systematic review: Infliximab therapy in ulcerative colitis. Aliment Pharmacol Ther 2007; 25(1): 19-37.
42. Dignass A, Lindsay JO, Sturm A, Windsor A, Colombel JF, Allez M, et al. Second European evidence-based consensus on the diagnosis and management of ulcerative colitis part 2: current management. J Crohns Colitis 2012; 6(10): 991-1030.
43. Gonzalez-Alvaro I, Martinez-Fernandez C, Dorantes-Calderon B, Garcia-Vicuna R, Hernandez-Cruz B, Herrero-Ambrosio A, et al. Spanish Rheumatology Society and Hospital Pharmacy Society Consensus on recommendations for biologics optimization in patients with rheumatoid arthritis, ankylosing spondylitis and psoriatic arthritis. Rheumatology (Oxford) 2015; 54(7): 1200-9.
44. Wendling D. Interleukin-17 targeted therapies in axial spondyloarthritis. Immunotherapy 2015; 7(11): 1125-8.
45. Gomollon F. [Treatment of inflammatory bowel diseases]. Gastroenterol Hepatol 2015; 38 Suppl 1(13-9.
46. Baeten D, Sieper J, Braun J, Baraliakos X, Dougados M, Emery P, et al. Secukinumab, an Interleukin-17A Inhibitor, in Ankylosing Spondylitis. Dermatol Ther (Heidelb) 2015; 373(26): 2534-48.
47. Hueber W, Sands BE, Lewitzky S, Vandemeulebroecke M, Reinisch W, Higgins PD, et al. Secukinumab, a human anti-IL-17A monoclonal antibody, for moderate to severe Crohn's disease: unexpected results of a randomised, double-blind placebo-controlled trial. Gut 2012; 61(12): 1693-700.
48. Gisbert JP, Domenech E. [Vedolizumab in the treatment of Crohn's disease]. Gastroenterol Hepatol 2015; 38(5): 338-48.
49. Bryant RV, Sandborn WJ, Travis SP. Introducing vedolizumab to clinical practice: who, when, and how? J Crohns Colitis 2015; 9(4): 356-66.
50. O'Brien J. Nonsteroidal anti-inflammatory drugs in patients with inflammatory bowel disease. Am J Gastroenterol 2000; 95(8): 1859-61.
51. Gomollon F, Rubio S, Charro M, Garcia-Lopez S, Munoz F, Gisbert JP, et al. [Reccomendations of the Spanish Working Group on Crohn's Disease and Ulcerative Colitis (GETECCU) on the use of methotrexate in inflammatory bowel disease]. Gastroenterol Hepatol 2015; 38(1): 24-30.
52. Cabriada JL, Vera I, Domenech E, Barreiro-de Acosta M, Esteve M, Gisbert JP, et al. [Recommendations of the Spanish Working Group on Crohn's Disease and Ulcerative Colitis on the use of anti-tumor necrosis factor drugs in inflammatory bowel disease.]. Gastroenterol Hepatol 2013.
53. Colman RJ, Rubin DT. Optimal doses of methotrexate combined with anti-TNF therapy to maintain clinical remission in inflammatory bowel disease. J Crohns Colitis 2015; 9(4): 312-7.
54. Laine L. The gastrointestinal effects of nonselective NSAIDs and COX-2-selective inhibitors. Semin Arthritis Rheum 2002; 32(3 Suppl 1): 25-32.
55. Voulgari PV. Rheumatological manifestations in inflammatory bowel disease. Ann Gastroenterol 2011; 24(3): 173-180.
56. Haraoui B, Krelenbaum M. Emergence of Crohn's disease during treatment with the anti-tumor necrosis factor agent etanercept for ankylosing spondylitis: possible mechanisms of action. Semin Arthritis Rheum 2009; 39(3): 176-81.
57. Sandborn WJ, Hanauer SB, Katz S, Safdi M, Wolf DG, Baerg RD, et al. Etanercept for active Crohn's disease: a randomized, double-blind, placebo-controlled trial. Gastroenterology 2001; 121(5): 1088-94.
58. Toussirot E, Houvenagel E, Goeb V, Fouache D, Martin A, Le Dantec P, et al. Development of inflammatory bowel disease during anti-TNF-alpha therapy for inflammatory rheumatic disease: a nationwide series. Joint Bone Spine 2012; 79(5): 457-63.
59. Ding NS, Hart A, De Cruz P. Systematic review: predicting and optimising response to anti-TNF therapy in Crohn's disease - algorithm for practical management. Aliment Pharmacol Ther 2016; 43(1): 30-51.
60. Gomollon F, Garcia-Lopez S, Sicilia B, Gisbert JP, Hinojosa J. [Therapeutic guidelines on ulcerative colitis: a GRADE methodology based effort of GETECCU]. Gastroenterol Hepatol 2013; 36(8): e1-47.




