Redacción Farmacosalud.com
Las quinolonas y fluoroquinolonas son antibióticos sintéticos utilizados para el tratamiento de un amplio espectro de infecciones bacterianas entre las que se incluyen infecciones de las vías urinarias y respiratorias, del aparato genital y gastrointestinal, así como infecciones cutáneas, óseas y articulares. Recientemente, el Comité para la Evaluación de Riesgos en Farmacovigilancia (PRAC) europeo ha evaluado el impacto que las reacciones adversas incapacitantes, de duración prolongada, y potencialmente irreversibles que afectan a los sistemas nervioso y musculoesquelético, podían ocasionar sobre la relación beneficio-riesgo de este grupo farmacológico, informa la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) mediante un comunicado.

Autor/a de la imagen: Enric Arandes / www.farmacosalud.com
Fuente: E. Arandes / www.farmacosalud.com
Entre las reacciones adversas que pueden darse figuran tendinitis, rotura tendinosa, mialgia, neuropatía periférica, psicosis, ansiedad… Durante la evaluación se tuvieron en cuenta los datos disponibles sobre las reacciones adversas referidas, así como la experiencia clínica aportada por el Grupo de trabajo sobre enfermedades infecciosas de la Agencia Europea de Medicamentos (EMA). De igual modo fueron oídas las opiniones de profesionales sanitarios y pacientes. Tras la evaluación realizada en el PRAC se ha concluido que los eventos secundarios musculoesqueléticos y del sistema nervioso, incapacitantes, de duración prolongada, y potencialmente irreversibles, afectan a todas las quinolonas y fluoroquinolonas, constituyendo un efecto de clase, por lo que se recomienda a los profesionales sanitarios:
• No utilizar quinolonas o fluroquinolonas en infecciones leves o autolimitadas salvo que otros antibióticos recomendados no puedan emplearse.
• Indicar a los pacientes que interrumpan el tratamiento con este tipo de antibióticos y acudan al médico, en caso de que aparezcan síntomas relacionados con las reacciones adversas detalladas en el comunicado de la AEMPS.
• Tener presente que los pacientes de edad avanzada, trasplantados o en tratamiento con corticoides presentan un mayor riesgo de sufrir lesiones tendinosas tras la administración de quinolonas y fluoroquinolonas.
Más información clicando aquí.
Ozurdex 700 microgramos implante intravítreo en aplicador
Por otro lado, la AEMPS informa en otro comunicado sobre la situación del medicamento Ozurdex 700 microgramos implante intravítreo en aplicador, Nº Reg: 10638001, y establece recomendaciones en su prescripción, a raíz de la retirada de lotes afectados por un defecto de calidad. Ozurdex 700 microgramos implante intravítreo en aplicador (dexametasona) es un medicamento indicado en adultos para el tratamiento de: deterioro de la visión debido a edema macular diabético (EMD) en pacientes pseudofáquicos, en pacientes en los que se considera que presentan una respuesta insuficiente, o en los que no es apropiada la terapia no-corticoidea; edema macular después de una oclusión de rama venosa retiniana (ORVR) u oclusión venosa retiniana central (OVCR), inflamación del segmento posterior del ojo que se presenta como uveítis no infecciosa.
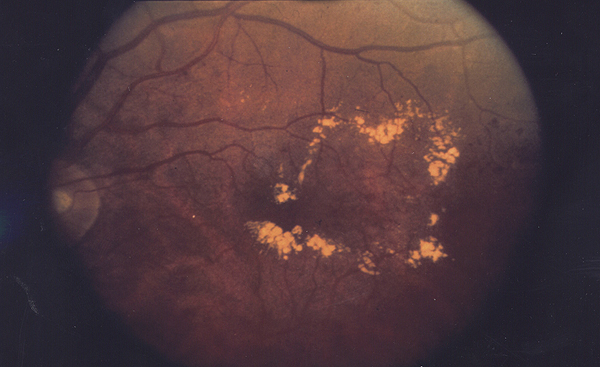
Edema macular diabético. La mácula está rodeada de un anillo de exudados duros de color amarillento
Autor/a de la imagen: National Eye Institute, National Institutes of Health (photographer credit not given) - National Eye Institute photography page
Fuente: Wikipedia
Durante una inspección rutinaria se detectó, en algunos implantes de Ozurdex, la liberación de una partícula de silicona proveniente del manguito de la aguja. Con fecha 3 de octubre de 2018 fueron retirados del mercado aquellos lotes en los que se había confirmado el defecto en alguna de sus unidades. No obstante, siguen disponibles aquellos lotes en los que no se han detectado partículas en las unidades muestreadas, si bien no se puede descartar la presencia del defecto en los mismos. Estos lotes, serán retirados cuando estén disponibles los nuevos lotes fabricados, y se haya comprobado que están libres del defecto de calidad.
Allergan S.A., responsable de Ozurdex en España, ha informado que no dispondrá de estos nuevos lotes hasta enero de 2019, por lo que se aconseja a los médicos, tras valorar la condición clínica individual de cada paciente, consideren los tratamientos alternativos disponibles y solo utilicen Ozurdex si no hay ningún tratamiento alternativo adecuado, y tras haber informado al paciente del posible defecto y sus riesgos potenciales.
En el caso que se considere necesario el uso de Ozurdex, y se agoten los lotes en los que no se había detectado el defecto de calidad, los facultativos podrán solicitar de forma individualizada unidades de los lotes afectados por el defecto de calidad, a Allergan S.A.[1] para continuar el tratamiento y siempre que la valoración del beneficio/riesgo indique la conveniencia del tratamiento. En todos los casos en los que se decida el tratamiento con Ozurdex, tanto si se usan los lotes afectados como si se usan los lotes en los que no se ha confirmado el defecto de calidad, son necesarios controles regulares y un seguimiento riguroso del paciente, debiendo notificar cualquier reacción adversa que se detecte.
Para más datos sobre las alternativas terapéuticas a Ozurdex 700 microgramos implante intravítreo en aplicador, clicar aquí.
Referencias
1. Alergan S.A. Representante local en España de Ozurdex 700 microgramos implante intravítreo en aplicador (dexametasona). Teléfono: 918076130 email: MA-Regulatory@Allergan.com.




