Redacción Farmacosalud.com
OncoDNA, compañía especializada en medicina de precisión para el tratamiento y diagnóstico del cáncer, ha presentado su nuevo Package Plus: pruebas adicionales por tipo de tumor que se combinan con el análisis por ultrasecuenciación de 313 genes. Entre ellas están las pruebas por IHC asociadas a terapias dirigidas, quimioterapias y hormonoterapias, la metilación del ADN, inestabilidad de microsatélites (MSI) y el estudio de fusiones (incluido NTRK). Se trata de un servicio completo, adaptado al tumor del paciente, que tiene como objetivo ofrecer a oncólogos y patólogos toda la información posible de las peculiaridades de cada cáncer, explicada de forma clara. Todo ello para dar de forma rápida y sencilla con el tratamiento más eficaz y menos tóxico para cada paciente.

Fuente: OncoDNA / Alive Comunicación
Hasta la fecha han sido más de 1.000 personas de 30 países localizados en cuatro continentes las que han sido tratadas en función de la información aportada por las pruebas del Package Plus. De hecho, el 92% de los oncólogos que han optado por esta vía aseguran que los datos han creado una mejor visión clínica de sus pacientes.
Análisis OncoDEEP y OncoSTRAT&GO
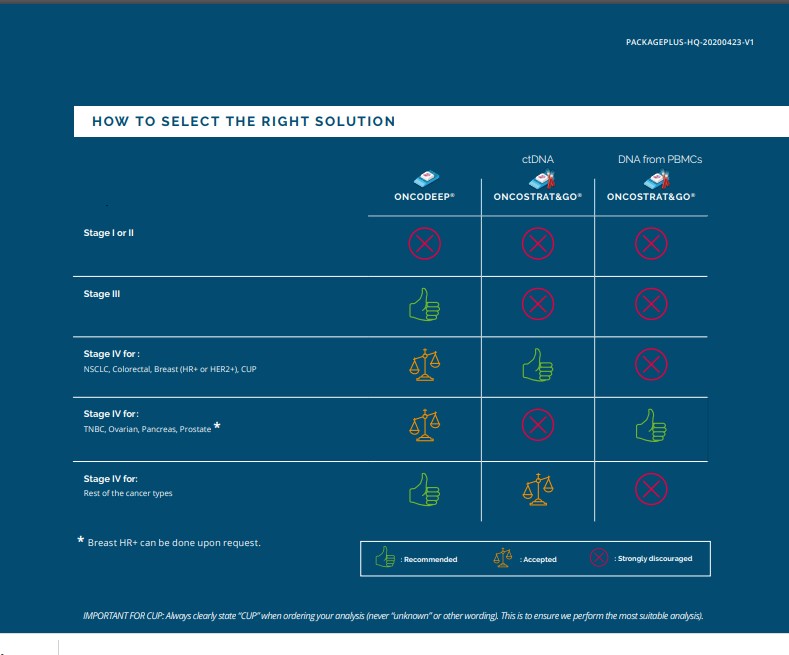
La versión actualizada del Package Plus, que se realiza en combinación con los análisis OncoDEEP y OncoSTRAT&GO, incluye pruebas específicas de IHC para quimioterapia, inmunoterapia y otras terapias dirigidas. Y también otras pruebas moleculares para determinar los tratamientos más avanzados. En función de cada tipo de tumor, OncoDNA realiza un conjunto específico de IHC y análisis moleculares para completar los resultados de la secuenciación (NGS) y dar una información más precisa sobre el perfil tumoral: receptores hormonales, infiltración de células T CD8, expresión de PD-L1, HER2, PTEN, MSI, etc.
Por otra parte, utiliza un panel de fusión de ARN específico para detectar eventos de omisión del exón 14 EGFRvIII y MET junto con fusiones principales en ALK, BRAF, FGFR, NRG1, NTRK, RET y ROS1 y selecciona mutaciones puntuales en 14 objetivos genéticos clave.
Es especialmente eficaz (más del 75% de tasa de respuesta) en aquellos casos en los que se estudian tumores con fusión NTRK positiva usando un inhibidor de NTRK.
“En OncoSTRAT&GO, la fusión de NTRK se analiza a nivel de ARN para todos los tipos de tumores. En OncoDEEP, la fusión de ARN de NTRK se analiza para cinco tipos de tumores: cáncer de pulmón de células no pequeñas (NSCLC), cáncer de vejiga (urotelial), colangiocarcinoma, cáncer de tiroides y glioblastoma pediátrico”, explica Adriana Terrádez, directora de OncoDNA para España, Portugal y Latam. Para otros tumores, se lleva a cabo la IHC para NTRK y si el resultado es positivo, se informa al oncólogo y se le ayuda a encontrar el fármaco más adecuado.
Fuente: OncoDNA / Alive Comunicación
Nueva clasificación del mosaicismo genético
Hoy sabemos que todas las personas somos mosaicos complejos con múltiples genotipos adquiridos desde el desarrollo embrionario hasta la edad adulta. En este mecanismo genético, las alteraciones causantes de las enfermedades no están presentes en cada una de las células de un individuo, como sucede en las heredadas por línea germinal, ya que la mutación puede ocurrir en cualquier tipo de célula y en cualquier momento del desarrollo. Un estudio internacional coordinado por investigadores del Centro de Investigación Biomédica en Red de Enfermedades Raras (CIBERER) propone una nueva clasificación sistemática del mosaicismo genético1.
Esta clasificación, publicada en la prestigiosa revista ‘Genetics in Medicine’, además de establecer un lenguaje estandarizado de comunicación, ayudará a mejorar el conocimiento sobre la fisiopatología molecular del mosaicismo, lo que podrá utilizarse para definir la historia natural de estos trastornos, mejorar el tratamiento médico, refinar las estimaciones de riesgo de recurrencia y guiar las decisiones terapéuticas. “De este modo, podremos prevenir la morbilidad y mortalidad de los trastornos asociados a mosaicismo”, subraya Pablo Lapunzina, coordinador del trabajo e investigador del CIBERER y el Instituto de Genética Médica y Molecular (INGEMM) del IdiPAZ-Hospital La Paz.
El mosaicismo tiene una distribución y efecto fenotípico de enorme variabilidad. De hecho, “aunque algunas alteraciones genéticas solo son compatibles con la vida en forma de mosaicismo genético, en teoría, cualquier enfermedad genética de origen germinal puede presentarse de forma parcial o segmentaria debido a este mecanismo”, apunta Víctor Martínez, primer firmante del artículo e investigador del CIBERER y el INGEMM. Esto constituye una dificultad añadida tanto para el diagnóstico como para entender por qué muchas enfermedades tienen una expresión variable. Los intentos por clasificar los mosaicismos genéticos hasta la fecha han sido parciales. Por ello, este trabajo propone una nueva categorización sistemática del mosaicismo que es aplicable a todos los tipos de tejidos, incluida la consideración no solo del tejido afectado y el patrón y distribución del mosaicismo, sino también la causa, la dirección del cambio y el mecanismo de mutación.

(de izq. a dcha): los científicos Marta Feito, Jair Tenorio, Raúl de Lucas, Julián Nevado, Pablo Lapunzina, Víctor Martínez, Gema Gordo, Lara Rodríguez y Antonio Torrelo
Fuente: CIBER de Enfermedades Raras (CIBERER)
Atezolizumab + cobimetinib y vemurafenib para el melanoma avanzado
Por otra parte, Roche ha anunciado que la Agencia Americana del Medicamento (FDA, por sus siglas en inglés) ha aprobado Tecentriq® (Atezolizumab) más Cotellic® (cobimetinib) y Zelboraf® (vemurafenib) para el tratamiento de pacientes con melanoma avanzado con mutación BRAF V600. El perfil de seguridad observado en la combinación fue coherente con los ya conocidos de los tres fármacos. La solicitud de licencia biológica suplementaria (sBLA) para Tecentriq fue concedida bajo revisión prioritaria.
La aprobación de la nueva combinación se ha basado en los resultados del estudio fase III IMspire150, en el que la adición de Tecentriq a Cotellic y Zelboraf ayudó a los pacientes a vivir más tiempo sin que su enfermedad empeorase o falleciesen, en comparación con el placebo más Cotellic y Zelboraf (mediana de SLP 15,1 meses frente a 10,6 meses respectivamente; cociente de riesgos, HR=0,78; intervalo de confianza: 0,63-0,97; P=0,025). Los efectos secundarios más comunes (tasa ≥20%) en los pacientes que recibieron Tecentriq más Cotellic y Zelboraf fueron erupción cutánea (75%), dolor musculoesquelético (62%), fatiga (51%), hepatotoxicidad (50%), pirexia (49%), náuseas (30%), prurito (26%), edema (26%), estomatitis (23%), hipotiroidismo (22%) y fotosensibilidad (21%).
Referencias
1. Martínez-Glez V, Tenorio J, Nevado J, Gordo G, Rodríguez-Laguna L, Feito M, et al. A six-attribute classification of genetic mosaicism. Genet Med. 2020. https://doi.org/10.1038/s41436-020-0877-3




