Redacción Farmacosalud.com
La compañía PharmaMar ha hecho públicos los resultados finales de su ensayo clínico APLICOV-PC1 con Aplidin® (plitidepsina) para el tratamiento de pacientes adultos con COVID-19 que requieren ingreso hospitalario, ensayo que alcanzó el objetivo primario de seguridad mostrando eficacia clínica. En los resultados obtenidos en este estudio, destacan los datos observados en 23 pacientes con enfermedad moderada, de los cuales el 74% recibieron el alta hospitalaria en la primera semana de tratamiento.
En APLICOV-PC se evaluaron tres cohortes de pacientes hospitalizados con enfermedad leve, moderada o severa1, con tres niveles de dosis diferentes de plitidepsina (1,5mg – 2,0mg – 2,5mg), administrados durante tres días consecutivos. De los 45 pacientes tratados en el ensayo, el 86,7% tenían enfermedad moderada o severa. El 91% tenían neumonía, siendo un 71% los afectados por neumonía bilateral. Como puede verse en la gráfica de pacientes que ingresaron con COVID-19 moderado, los que recibieron la dosis de 2,5 mg presentaron la mayor probabilidad de ser dados de alta durante la primera semana del ingreso.
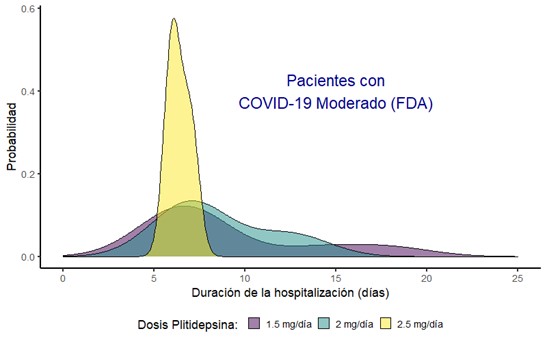
Fuente: PharmaMar
Mejora del sistema inmunitario
En este mismo grupo de pacientes se ha observado que cuanto más alta es la dosis de plitidepsina, mayor es el recuento de linfocitos en el tiempo, un indicador de mejora del sistema inmunitario. Asimismo, se observa un paralelismo entre la disminución de la carga viral, la mejoría clínica y la caída de parámetros de inflamación, como la Proteína C-reactiva. Esto sugiere que, además de su efecto antiviral, plitidepsina podría está ejerciendo efectos antiinflamatorios, favoreciendo la respuesta inmune frente al coronavirus SARS-CoV-2.
Esta publicación también reafirma las hipótesis iniciales sobre la transversalidad de plitidepsina frente a otras cepas o variantes de coronavirus, ya que actúa bloqueando la proteína eEF1A, presente en las células humanas, y que es utilizada por diferentes tipos de coronavirus para reproducirse e infectar a otras células. Los datos obtenidos en este estudio han llevado a la compañía a poner en marcha el nuevo estudio de fase III NEPTUNO, que determinará la eficacia de plitidepsina para el tratamiento de pacientes hospitalizados con infección moderada de COVID-19.
“Una noticia muy esperanzadora para el manejo terapéutico de la neumonía COVID-19”
“Seguimos necesitando de fármacos eficaces frente a la COVID-19. Plitidepsina es un fármaco muy prometedor con un desarrollo preclínico sólido. Ha completado el estudio fase I/II con buenos datos de seguridad y unos primeros datos clínicos de adecuada eficacia en la neumonía moderada de la COVID-19. En las próximas semanas, con la apertura del reclutamiento del ensayo NEPTUNO y un grupo de comparación directo, podremos saber con mayor precisión cuál es el papel y la eficacia clínica precisa de plitidepsina en la COVID-19”, explica el Dr. Pablo Guisado Vasco, médico adjunto de Medicina Interna del Hospital Universitario Quirónsalud Madrid.
Para el Dr. José F. Varona, médico del departamento de Medicina Interna del Hospital Universitario HM Montepríncipe de Madrid, “los positivos resultados de plitidepsina en el ensayo clínico APLICOV-PC, tanto en términos de seguridad como en térmicos de eficacia, suponen una noticia muy esperanzadora para el manejo terapéutico de la neumonía COVID-19 que precisa ingreso hospitalario”. A lo que agrega: “en este sentido, hay que destacar tanto su mecanismo de acción específico, que le confiere un valor añadido frente a las distintas variantes del SARS-CoV-2, como su buen perfil de seguridad, con excelente tolerabilidad”.
Atención de pacientes con COVID-19 en el Área de Vigilancia Intensiva (AV) del Hospital Clínic de Barcelona (IMAGEN DE ARCHIVO)
Autoría y fuente: Francisco Àvia / Hospital Clínic
Por su parte, el Dr. Vicente Estrada, responsable de la Unidad de Enfermedades Infecciosas del Hospital Clínico San Carlos de Madrid, subraya que “plitidepsina posee una acción antiviral muy potente in vitro, y en el ensayo APLICOV-PC el fármaco mostró una seguridad suficiente, con pocos efectos adversos, en su mayoría gastrointestinales y controlables en gran medida con premedicación. En el futuro, si los resultados del estudio NEPTUNO son favorables, podría usarse en el tratamiento precoz de esta enfermedad de pacientes con compromiso respiratorio”.
Referencias
1. Definición de pacientes con enfermedad leve, moderada o severa, según el criterio establecido por la FDA: https://www.fda.gov/media/137926/download




