Redacción Farrmacosalud.com
MSD ha anunciado la presentación de los datos de las tres cohortes del ensayo de registro fase 2 KEYNOTE-059 que investiga el uso de KEYTRUDA® (pembrolizumab), la terapia anti PD-1 de la compañía, en pacientes con adenocarcinoma gástrico o de la unión gastroesofágica avanzados (UGE), incluyendo nuevos datos en pacientes que no han recibido tratamiento previo. En general, los resultados mostraron una actividad antitumoral y durabilidad de la respuesta con KEYTRUDA® a lo largo de las múltiples líneas de tratamiento, con unas tasas de respuesta superiores en los pacientes PD-L1 positivos (CPS ≥1):
• En los pacientes muy tratados previamente, la monoterapia con pembrolizumab (Cohorte 1) mostró una tasa de respuesta global (TRG) del 12 % (95 % IC: 8-17) en todos los pacientes y del 16 % (95 % IC: 11-23) en los pacientes con tumores PD-L1 positivos.
• En los pacientes no tratados previamente, pembrolizumab en combinación con quimioterapia (Cohorte 2) mostró una tasa de respuesta global (TRG) del 60 % (95 % IC: 39-79) en todos los pacientes y del 69 % (95 % IC: 41-89) en los pacientes con tumores PD-L1 positivos.
• En los pacientes no tratados previamente con tumores PD-L1 positivos, la monoterapia con pembrolizumab (Cohorte 3) mostró una TRG del 26 % (95 % IC: 12-45).

Fuente: www.farmacosalud.com / Archivo
Gentileza del Centro Nacional de Microbiología. Instituto de Salud Carlos III de Madrid
Abstract #LBA28_PR)
Los resultados se han presentado en el Congreso de la Sociedad Europea de Oncología (ESMO, por sus siglas en inglés), celebrado en Madrid (Abstract #LBA28_PR). “Los resultados pueden variar de manera significativa entre los pacientes con cáncer gástrico o UGE, a lo largo de todos los estadios de la enfermedad y basándose en diferentes composiciones biológicas y moleculares de los tumores”, afirma el Dr. Charles S. Fuchs, MPH, investigador principal y director del Centro Oncológico de Yale (Yale Cancer Center). “KEYNOTE-059 se ha diseñado para proporcionar un importante conocimiento de los diferentes escenarios de tratamiento de forma simultánea. Estos resultados muestran una actividad prometedora de pembrolizumab tanto en los pacientes que han recibido tratamiento previo como en los no pretratados, especialmente en aquellos cuyo tumor expresa un alto nivel de PD-L1”.
Los resultados presentados del estudio KEYNOTE-059 se basaron en un análisis de eficacia, seguridad y expresión PD-L1 en 315 pacientes a lo largo de las tres cohortes del estudio. Los pacientes se consideraron como PD-L1 positivos si tenían una puntuación positiva PD-L1 combinada de uno o más (CPS ≥1). Los resultados mostraron:
• Cohorte 1: pembrolizumab en monoterapia en pacientes cuya enfermedad progresó tras dos líneas o más de terapia previa (n=259). El 48 % de estos pacientes recibieron tres o más líneas de tratamiento previo. El análisis de eficacia en todos los pacientes, con o sin expresión PD-L1, mostró una TRG del 12 % (95 % IC: 8-17) con respuestas completas (RC) en el 3% (95 % IC: 1-6) y respuestas parciales (RP) en el 9% (95 % IC: 6-13) de los pacientes. En los pacientes cuyos tumores expresaban PD-L1 (n=148), la TRG fue del 16 % (95 % IC: 11-23), con RC en el 3% (95 % CI, 1-8) y RP en el 13 % (95 % CI, 8-19) de los pacientes. En los pacientes con PD-L1 negativo (n=109), la TRG fue del 6 % (95 % IC: 3-13), con RC en el 3 % (95 % IC: 1-8) y RP en el 4 % (95 % IC: 1-9) de los pacientes. La mediana de seguimiento fue de 5,6 meses (intervalo: 0,5-24,7). El 42% (n=95) de los pacientes mostraron una reducción del tamaño de las lesiones diana. La mediana de duración de la respuesta fue de 14,2 meses (intervalo: 2,4-19,4+).
En todos los pacientes, la mediana de supervivencia libre de progresión (SLP) fue de dos meses (95 % IC: 2,0-2,1), con una tasa de SLP a los seis meses del 14,6 %, la mediana de supervivencia global (SG) fue de 5,5 meses (95 % IC: 4,2-6,5), con una tasa SG a los 6 meses del 45,7 %. En los pacientes cuyos tumores expresaban PD-L1, la mediana de SLP fue de 2,1 meses (95 % IC: 2,0-2,1), con una tasa de SLP a los seis meses del 18,2 %; la mediana de supervivencia global en estos pacientes fue de 5,8 meses (95 % IC: 4,4-7,8), con una tasa SG a los seis meses del 48,4 %. En los pacientes PD-L1 negativo, la mediana de SLP fue de dos meses (95 % IC: 1,9-2,0), con una tasa de SLP a los seis meses del 9,9 %, la mediana de SG fue de 4,6 meses (95 % IC: 3,2-6,5), con una tasa SG a los seis meses del 42,9 %.
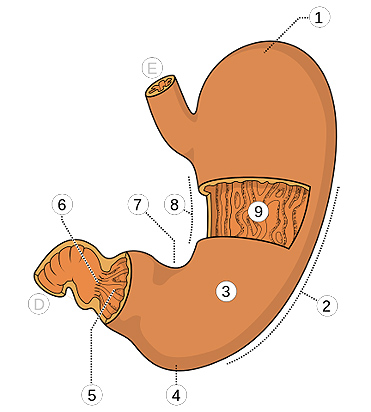
Estructuras del estómago:
1. Fundus 2. Curvatura mayor 3. Cuerpo 4. Antro pílorico 5. Región pilórica 6. Canal pilórico 7. Incisura angular 8. Curvatura menor 9. Pliegues gástricos E. Esófago D. Duodeno
Autor/a de la imagen: Olek Remesz (wiki-pl: Orem, commons: Orem) - Own work, based on Image:Illu stomach.jpg
Fuente: Wikipedia
• Cohorte 2: pembrolizumab en combinación con quimioterapia en pacientes no tratados previamente (n=25). El análisis de eficacia en todos los pacientes mostró una TRG del 60 % (95 % IC: 39-79) con RC en el 4% (95 % IC: 0-20) y respuesta parcial (RP) en el 56 % (95 % IC: 35-76) de los pacientes. En los pacientes cuyos tumores expresaban PD-L1 (n=16), la TRG fue del 69 % (95 % IC: 41-89), con ninguna respuesta completa (95 % IC: 0-22) y RP en el 69 % (95 % IC: 41-89) de los pacientes. En los pacientes PD-L1 negativo (n=8), la TRG fue del 38 % (95 % IC: 9-76), con RC en el 13 % (95 % IC: 0-53) y RP en el 25 % (95 % IC: 3-65) de los pacientes. La mediana de seguimiento fue de 13,8 meses (intervalo: 1,8-24,1). El 96 % (n=24) de los pacientes mostraron una reducción del tamaño de las lesiones diana. La mediana de duración de la respuesta fue de 4,6 meses (intervalo: 2,6-20,3+). En todos los pacientes, la mediana de SLP fue de 6,6 meses (95 % IC: 5,9-10,6), con una tasa de SLP a los 6 meses del 68%; la mediana de SG fue de 13,8 meses (95 % IC: 8,6 - no alcanzado), y con una tasa SG a los seis meses del 76 %.
• Cohorte 3: pembrolizumab como monoterapia para el tratamiento de pacientes no tratados previamente cuyos tumores expresaban PD-L1 (n=31). El análisis de eficacia mostró una TRG del 26 % (95 % IC: 12-45) con RC en el 7% (95 % IC: 1-21) y RP en el 19 % (95 % IC: 8-38) de los pacientes. La mediana de seguimiento fue de 17,5 meses (intervalo: 1,7-20,7). El 77% de los pacientes (n=24) mostraron una reducción del tamaño de las lesiones diana. La mediana de duración de la respuesta fue de 9,6 meses (intervalo: 2,1-17,8+). La mediana de SLP fue de 3,3 meses (95 % IC: 2,0-6,0), con una tasa de SLP a los seis meses del 34,9 %, una mediana de SG de 20,7 meses (95 % IC: 9,2-20,7), y una tasa SG a los seis meses del 72,9 %.
El perfil de seguridad de pembrolizumab fue consistente con el observado en estudios previos. En las Cohortes 1, 2, y 3, ocurrieron acontecimientos adversos relacionados con el tratamiento (AART) de grado 3-5 en 46 (18 %), 19 (76 %) y 7 (23 %) de los pacientes, respectivamente. En la Cohorte 1, los AART de grado 3-5 fueron anemia (3 %), fatiga (2 %) y deshidratación (1 %); los AART dieron lugar a la suspensión de tratamiento en siete pacientes (3 %) y al fallecimiento de dos pacientes (1 %). En la Cohorte 2, entre los AART de grado 3-4, se observó neutropenia (24 %), estomatitis (20 %), anemia (8 %), descenso del recuento de plaquetas (8 %), descenso del apetito (8 %) y fatiga (8 %). Los AART en la Cohorte 2 dieron lugar a la suspensión del tratamiento en tres pacientes (12 %) y no hubo ningún fallecimiento relacionado con este. En la Cohorte 3, los AART de grado 3-5 se observaron en siete pacientes (23 %). Hubo un fallecimiento relacionado con el tratamiento (3 %) y ninguna suspensión debido a AART.
En las Cohortes 1, 2, y 3, los acontecimientos adversos grado 3 o mayor mediados por el sistema inmune ocurrieron en trece, cuatro y tres pacientes, respectivamente. En la Cohorte 1, los efectos adversos grado 3 mediados por el sistema inmune fueron colitis (n=3), neumonitis (n=2), tiroiditis (n=1) e hipotiroidismo (n=1); no se produjeron efectos adversos Grado 4-5 inmunomediados. En la Cohorte 2, los efectos adversos grado 3 mediados por el sistema inmune fueron eritrodisestesia palmoplantar (n=2), síndrome nefrótico (n=1), erupción (n=1) y erupción maculopapular (n=1); no hubo efectos adversos grado 4-5 inmunomediados. En la Cohorte 3, los efectos adversos grado 3 mediados por el sistema inmune fueron colitis (n=1) y erupción (n=1); y hubo un evento adverso grado 5 (neumonitis).
Pembrolizumab y el cáncer de cabeza y cuello

Autor/a: George Hodan
Fuente: www.publicdomainpictures.net
Por otro lado, MSD ha anunciado los resultados del ensayo fase 3 KEYNOTE-040 en el que se evaluó KEYTRUDA® (pembrolizumab), en comparación con el tratamiento estándar (metotrexato, docetaxel o cetuximab) en pacientes con carcinoma de células escamosas de cabeza y cuello (CCECC), recurrente o metastásico que presentaron progresión de la enfermedad durante o después de haber recibido quimioterapia basada en platino (fallo post-platino). Como se comunicó previamente, el estudio no cumplió su criterio de valoración primario pre-especificado de supervivencia global (SG). Los hallazgos incluyen datos de supervivencia actualizados que muestran una reducción del 19% del riesgo de muerte respecto al tratamiento estándar en la población con intención de tratar (HR, 0,81 [95% IC: 0,66-0,99]; p unilateral = 0,0204), siendo el valor de p pre-especificado exigido para la significación estadística de 0,0175, y una mediana de SG de 8,4 meses con KEYTRUDA® (95% IC: 6,5-9,4) en comparación con 7,1 meses con el tratamiento estándar (95% IC: 5,9-8,1). Los resultados completos se presentaron por primera vez en ESMO Madrid, en una presentación oral (Abstract #LBA45_PR).
“Estos datos, incluidos los relativos a la supervivencia libre de progresión y la tasa de respuestas globales, muestran la actividad y la eficacia de pembrolizumab en esta enfermedad y son consistentes con los estudios previos de pembrolizumab en el carcinoma de células escamosas de cabeza y cuello recurrente,” dijo Ezra Cohen, M.D., director asociado de investigación traslacional del Moores Cancer Center y co-director del San Diego Center for Precision Immunotherapy de la Universidad de California, San Diego. “El ensayo KEYNOTE-40 refuerza la justificación de realizar nuevos estudios y la expansión hacia líneas de tratamiento más precoces en la enfermedad”.
Los datos presentados en ESMO se basan en resultados en la población con intención de tratar (n=495) e incluyen un análisis de criterios de valoración de la eficacia basados en la expresión de PD-L1 usando dos formas de medir: CPS de PD-L1 >1 (n=387) y TPS de PD-L1 >50% (n=129). Los datos mostraron que, en la población con intención de tratar, la mediana de SG fue de 8,4 meses con pembrolizumab (95% IC: 6,5-9,4) en comparación con 7,1 meses con el tratamiento estándar (95% IC: 5,9-8,1) (HR, 0,81 [95% IC 0,66-0,99]; p unilateral = 0,0204); la tasa de SG a los 12 meses fue del 37,3% con pembrolizumab en comparación con el 27,2% con el tratamiento estándar. Análisis posteriores del criterio de valoración primario basado en la expresión de PD-L1 mostraron:
• En pacientes con CPS de PD-L1 >1, la mediana de SG fue de 8,7 meses con pembrolizumab (95% IC: 6,9-11,4) y de 7,1 meses con el tratamiento estándar (95% IC: 5,7-8,6) (HR, 0,75 [95% IC: 0,59-0,95]; p = 0,0078); la tasa de SG a los 12 meses fue del 40,1% con pembrolizumab en comparación con el 26,7% con el tratamiento estándar.
• En pacientes con TPS de PD-L1 >50%, la mediana de SG fue de 11,6 meses con pembrolizumab (95% IC: 8,3-19,5) y de 7,9 meses con el tratamiento estándar (95% IC: 4,8-9,3) (HR, 0,54 [95% IC: 0,35-0,82]; p = 0,0017); la tasa de SG a los 12 meses fue del 46,6% con pembrolizumab en comparación con el 25,8% con el tratamiento estándar.

Fuente: www.farmacosalud.com / Archivo
Gentileza del Centro Nacional de Microbiología. Instituto de Salud Carlos III de Madrid
La tasa de respuesta global (TRG) en la población con intención de tratar fue del 14,6% en el grupo de pembrolizumab en comparación con el 10,1% en el grupo de tratamiento estándar (p = 0,0610). En pacientes con CPS de PD-L1 >1, la TRG fue del 17,3% con pembrolizumab en comparación con el 9,9% con el tratamiento estándar (p = 0,0171). En pacientes con TPS de PD-L1 >50%, la TRG fue del 26,6% con pembrolizumab en comparación con el 9,2% con el tratamiento estándar (p = 0,0009).
El perfil de seguridad, consistente
La mediana de supervivencia libre de progresión (SLP) fue de 2,1 meses en la población con intención de tratar con pembrolizumab (95% IC: 2,1-2,3) y de 2,3 meses con el tratamiento estándar (95% IC: 2,1-2,8) (HR, 0,95 [95% IC: 0,79-1,16]; p = 0,3037). En pacientes con CPS de PD-L1 >1, la mediana de SLP fue de 2,2 meses con pembrolizumab (95% IC: 2,1-3,0) y de 2,3 meses con el tratamiento estándar (95% IC: 2,1-3,3) (HR, 0,89 [95% IC: 0,72-1,11]; p = 0,1526). En pacientes con TPS de PD-L1 >50%, la mediana de SLP fue de 3,5 meses con pembrolizumab (95% IC: 2,1-6,3) y de 2,2 meses con el tratamiento estándar (95% IC: 2,0-2,5) (HR, 0,58 [IC del 95%, 0,39-0,87]; p = 0,0034).
El perfil de seguridad de pembrolizumab fue consistente con el observado en estudios publicados previamente. Se produjeron acontecimientos adversos relacionados con el tratamiento (AART) de cualquier grado en 155 pacientes (63,0%) en el grupo de pembrolizumab y en 196 pacientes (83,8%) en el grupo del tratamiento estándar. En el conjunto de los grupos, los AART con una incidencia del 10% o más incluyeron hipotiroidismo, fatiga, diarrea, erupción cutánea, astenia, anemia, náuseas, inflamación de las mucosas, estomatitis, disminución del recuento de neutrófilos y alopecia. Los acontecimientos adversos mediados por el sistema inmunitario, de cualquier grado, que se produjeron en el grupo de pembrolizumab fueron hipotiroidismo, neumonitis, reacciones a la infusión, reacciones cutáneas severas, hipertiroidismo, colitis, síndrome de Guillain-Barre y hepatitis. Se produjo suspensión debida a AART en 15 pacientes (6,1%) en el grupo de pembrolizumab y en 12 pacientes (5,1%) en el grupo de tratamiento estándar. Se produjeron muertes debidas a acontecimientos adversos relacionados con el tratamiento en cuatro pacientes (1,6%) en el grupo de pembrolizumab y dos pacientes (0,9%) en el grupo de tratamiento estándar.




