Redacción Farmacosalud.com
AveXis, una compañía de Novartis, ha anunciado que la Comisión Europea (CE) ha otorgado la autorización condicional de onasemnogene abeparvovec (Zolgensma®) para el tratamiento de pacientes con atrofia muscular espinal (AME). Tiempo atrás se comentó que onasemnogene abeparvovec era el fármaco más caro del mundo al costar la única dosis que se da para toda la vida del paciente algo más dos millones de dólares (unos 1,87 millones de euros) en Estados Unidos. De todos modos, Alicia Folgueira, directora general de AveXis en España, aboga por no sacar conclusiones precipitadas en relación a este aspecto, en tanto que, según viene a decir, el tiempo demostrará que onasemnogene abeparvovec “es un ahorro” para la Sanidad. En Europa, actualmente la AME supone una carga importante para el sistema sanitario con una estimación de costes sanitarios acumulados por niño comprendidos entre los 2,5 y 4 millones de euros sólo durante los primeros 10 años1.

Alicia Folgueira
Fuente: AveXis / Novartis / Atrevia
“Es cierto que llevamos un tiempo asistiendo a un debate sobre el precio de Zolgensma (onasemnogene abeparvovec) con esa etiqueta de medicamento más caro del mundo -comenta Folgueira-. Creemos que es necesario hacer una diferenciación entre precio y valor. Las terapias génicas como Zolgensma tienen el potencial de reducir la carga de enfermedad y de tratamiento para los pacientes, las familias y los sistemas de salud en general al reemplazar las terapias repetidas de por vida por un tratamiento que se facilita en una dosis única. Además, Zolgensma ofrece una aportación muy significativa para los sistemas de salud; de hecho, los análisis de coste-efectividad realizados por ICER, un grupo de investigación independiente, han determinado que el coste de Zolgensma ‘se alinea con los beneficios para estos niños y sus familias’. En definitiva, a nadie se le escapa que nuestro tratamiento supone en el medio y largo plazo un ahorro para los sistemas de salud pública. Dicho esto, lógicamente, nuestro propósito es llegar a un acuerdo razonable con las autoridades sanitarias españolas que permita el acceso a este tratamiento en el plazo de tiempo más breve posible”.
Un cambio de paradigma: el nuevo tratamiento se dirige a la ausencia del gen SMN1
“Somos conscientes de las expectativas que ha despertado Zolgensma (onasemnogene abeparvovec) y conocemos bien que las familias de niños afectados por AME esperan ansiosamente la aprobación en España. Como sabe, en última instancia, la decisión de aprobar y garantizar el acceso recae en las autoridades sanitarias locales de cada país. Nuestra intención es que, lógicamente, Zolgensma (onasemnogene abeparvovec) esté disponible para los pacientes españoles que lo necesiten con la mayor brevedad posible ahora que ya tenemos la aprobación de la Comisión Europea”, remarca.
La CE ha otorgado la autorización condicional de onasemnogene abeparvovec para el tratamiento de pacientes con atrofia muscular espinal (AME) 5q con mutación bialélica en el gen SMN1 y un diagnóstico clínico de AME Tipo I; o para pacientes con AME 5q con mutación bialélica en el gen SMN1 y con hasta tres copias del gen SMN2. La aprobación cubre a niños con AME de hasta 21 kg de acuerdo con la guía de dosificación aprobada.
Según la directora general de AveXis en España, la aprobación de la nueva terapia por parte de la CE “supone un hito decisivo que nos sitúa más cerca de una mejor opción para el tratamiento de los niños afectados de AME. Solo en Europa, estimamos que cada año nacen entre 550 y 600 niños con esta enfermedad. Desgraciadamente, la AME tipo 1, la más grave, conlleva la muerte o a la necesidad de recurrir a ventilación asistida permanente antes de los 2 años en el 90% de los casos si los niños no reciben tratamiento. La gran novedad de onasemnogene abeparvovec es que supone un cambio de paradigma porque se dirige a la causa de la enfermedad, la ausencia del gen SMN1”. Así pues, con la incorporación del fármaco en las motoneuronas de la médula espinal se consigue restaurar la producción de la proteína SMN1 deficitaria, y en una única administración intravenosa.
Fuente: AveXis / Novartis / Atrevia
Reimaginar el valor de los tratamientos y el diagnóstico, atención y costes asociados a la asistencia
"La aprobación de la CE de Zolgensma es un hito importante para la comunidad con AME y subraya aún más el valor clínico sustancial de la única terapia génica para la AME, albergando nuevas esperanzas para aquellos afectados por esta enfermedad rara pero devastadora”, apunta Dave Lennon, presidente de AveXis. De hecho, onasemnogene abeparvovec es el segundo tratamiento específico en la historia para la AME y la primera terapia génica para tratar la afección2. El otro fármaco existente, nusinersen, es un oligonucleótido antisentido (ASO) que corrige la deficiencia de la proteína SMN aumentando la producción de SMN3. Nusinersen es un tratamiento crónico; en concreto, después de recibirse cuatro dosis de carga (separadas catorce días las tres primeras y 35 días después la cuarta), la dosis de mantenimiento se administra cada cuatro meses4.
“Onasemnogene abeparvovec es una terapia génica que aborda la causa genética de la AME y que se administra mediante una infusión intravenosa de apenas una hora de duración. Es la única terapia capaz de aportar una copia funcional del gen SMN1 al paciente, lo que ayuda a detener la progresión de la AME”, argumenta Folgueira. A lo que añade: “La introducción de una terapia génica en dosis única requiere reimaginar cómo definimos el valor de los tratamientos y también cómo nuestro sistema de salud maneja el diagnóstico, la atención y los costes asociados a la asistencia para los pacientes que sufren enfermedades minoritarias. Actualmente, los sistemas de atención sanitaria están diseñados para facilitar el tratamiento crónico durante muchos años o décadas, con los costes que eso acarrea a lo largo del tiempo. Nusinersen es un tratamiento que se administra mediante punción lumbar y que requiere 4 dosis de carga seguidas de una dosis intratecal cada cuatro meses de forma crónica. Frente a ese estándar, con onasemnogene abeparvovec podemos mejorar considerablemente al paciente con AME y con una única administración intravenosa”.
La AME es una dolencia neuromuscular genética poco frecuente causada por la ausencia de un gen funcional SMN1. Esto provoca la pérdida rápida e irreversible de las neuronas motoras, lo que afecta a las funciones musculares, incluyendo la respiración, la deglución y el movimiento5-7. Zolgensma está diseñada para abordar la causa genética raíz de la enfermedad reemplazando la función del gen SMN1 defectuoso o inexistente. Este tratamiento se administra mediante una sola infusión intravenosa (IV) que aporta una nueva copia funcional del gen SMN1 en las células del paciente con el fin de detener la progresión de la patología. Según el estudio de historia natural de la AME del Pediatric Neuromuscular Clinical Research (PNCR), casi todos los pacientes menores de cinco años pesaron menos de 21 kg y algunos pacientes de 6, 7 u 8 años pesaron menos de 21 kg8.

Fuente: www.farmacosalud.com / Archivo
Gentileza del Centro Nacional de Microbiología. Instituto de Salud Carlos III de Madrid
“Los resultados del ensayo muestran una tasa de supervivencia impresionante”
"La aprobación supone un progreso tangible en el aprovechamiento del poder transformador de la terapia génica", declara el Dr. Eugenio Mercuri, Prof. de Neurología Pediátrica en la Universidad Católica de Roma, Italia. “Los resultados del ensayo clínico STR1VE que hemos observado para Zolgensma hasta la fecha -prosigue- muestran una tasa de supervivencia impresionante al final del estudio, ya que la mayoría de los pacientes han logrado hitos importantes, como sentarse sin apoyo, algo que no se hubiera conseguido en los niños no tratados”.
Por su parte, "la asociación de pacientes SMA Europe recibe con gran emoción la noticia de la aprobación por parte de la Comisión Europea de una terapia génica para tratar a una parte de nuestra comunidad", señala Mencía de Lemus, presidenta de SMA Europe y FUNDAME en España. “Se han depositado muchas esperanzas en esta terapia tan esperada. Ahora dependerá de todos los interesados involucrados asegurar que los médicos, junto con los padres, puedan tomar la mejor opción terapéutica en función del beneficio que cada una de ellas puede aportar a cada individuo. Recopilar más datos sobre cómo Zolgensma impacta en la vida de los pacientes será extremadamente importante para comprender mejor el potencial de esta nueva terapia”, destaca De Lemus.
La decisión de la Comisión Europea se basa en los ensayos finalizados de Fase III STR1VE-US y de Fase I START que evaluaron la eficacia y la seguridad de una sola infusión intravenosa del nuevo fármaco en pacientes sintomáticos con AME Tipo 1 con <6 meses de edad en el momento de la administración con una o dos copias del gen backup (de respaldo) SMN2, o dos copias del gen backup SMN2, respectivamente. STR1VE-EU, un estudio comparable de Fase III, sigue en curso. Zolgensma demostró una prolongada supervivencia libre de eventos, una mejora rápida de la función motora, a menudo durante el mes siguiente a la dosificación, y un logro de un hito sostenido, incluyendo la capacidad de sentarse sin apoyo, gatear y caminar de forma independiente, hitos nunca logrados en pacientes con Tipo 1 no tratados9.
Los datos de apoyo adicionales incluyeron resultados provisionales del ensayo SPR1NT en curso, un estudio abierto de Fase III, de brazo único, de una única infusión IV de Zolgensma en pacientes presintomáticos (<6 semanas de edad en el momento de administrar la dosis) genéticamente definidos por deleción bialélica de SMN1 con 2 o 3 copias de SMN2. Estos datos demuestran una mejora importante, rápida y adecuada para la edad, lo que refuerza la importancia crítica de la intervención temprana en pacientes con AME1.
Los efectos secundarios más frecuentes observados después del tratamiento fueron elevación de las enzimas hepáticas y vómitos. Se pueden producir lesiones hepáticas agudas graves y un aumento de las aminotransferasas. Los pacientes con insuficiencia hepática preexistente pueden sufrir un mayor riesgo. Antes de la infusión, los médicos deben evaluar la función hepática de todos los enfermos mediante exámenes clínicos y pruebas de laboratorio. Asimismo, deben administrar corticosteroides a todos los pacientes antes y después del tratamiento, y posteriormente seguir monitorizando la función hepática durante al menos 3 meses después de la infusión9. Existe experiencia limitada en pacientes a partir de 2 años o con un peso corporal superior a 13,5 kg. No se ha evaluado la seguridad y eficacia de Zolgensma en estos pacientes.
AveXis tiene una licencia exclusiva mundial con el Nationwide Children’s Hospital para la administración intravenosa e intratecal de la terapia génica AAV9 para tratar todos los tipos de AME; tiene una licencia exclusiva mundial de REGENXBIO para cualquier vector AAV recombinante de su cartera de propiedad intelectual para el tratamiento con terapia génica in vivo de la AME en humanos; un acuerdo de licencia exclusivo mundial con Généthon para la administración in vivo del vector AAV9 en el sistema nervioso central para tratar la AME, y un acuerdo de licencia no exclusivo mundial con AskBio para el uso de su tecnología de ADN autocomplementaria para tratar la AME.
Acerca de la Atrofia Espinal Muscular (AME)
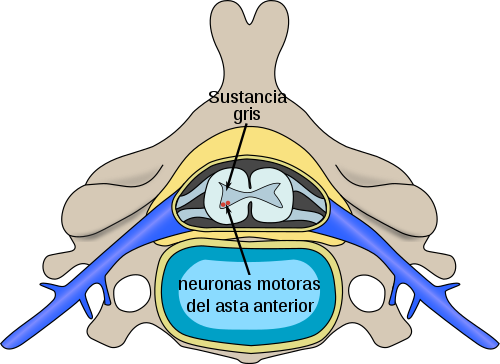
Localización, en la médula espinal, de neuronas afectadas por la atrofia muscular espinal
Fuente: Cervical vertebra blank.svg: Fred the Oyster Polio spinal diagram.PNG: DO11.10 Polio spinal diagram es.png: Rαge Derived: Angelito7 - Cervical vertebra blank.svg Polio spinal diagram.PNG Polio spinal diagram es.png [Wikipedia]
La AME es la principal causa genética de muerte infantil6,7. De no tratarse, la AME Tipo 1 provoca la muerte o la necesidad de ventilación permanente a la edad de dos años en más del 90% de los casos10,11. Es preciso diagnosticar la AME y comenzar el tratamiento lo antes posible, incluyendo los cuidados paliativos proactivos, para detener la pérdida irreversible de neuronas motoras y la progresión de la enfermedad12. Esto cobra especial relevancia en la AME Tipo 1, en la que la degeneración de la neurona motora comienza antes del nacimiento y aumenta rápidamente.
La pérdida de las neuronas motoras no se puede revertir, por lo que los sujetos con AME con síntomas en el momento del tratamiento probablemente requieran cuidado respiratorio, nutricional y/o musculoesquelético de apoyo para maximizar las capacidades funcionales13. Más del 30% de los pacientes con AME Tipo 2 fallecerán a los 25 años de edad14.
Acerca de Zolgensma® (onasemnogene abeparvovec)
Zolgensma está diseñada para abordar la raíz genética de la AME al aportar una copia funcional del gen humano SMN con el fin de detener la progresión de la afección mediante la expresión sostenida de la proteína SMN en una sola infusión intravenosa. Zolgensma representa el primer producto terapéutico aprobado en la plataforma registrada de la compañía para tratar enfermedades monogénicas raras usando terapias génicas5. Aproximadamente 500 pacientes han sido tratados con Zolgensma, incluyendo ensayos clínicos, comercialmente y a través del programa de acceso temprano. AveXis está intentando registrarse en más de una treintena de países con decisiones regulatorias anticipadas en Suiza, Canadá, Australia, Argentina, Corea del Sur y Brasil a finales de 2020 o principios de 20215.
En mayo de 2019, la Food and Drug Administration de EE.UU. aprobó Zolgensma para el tratamiento en pacientes pediátricos menores de dos años afectos de AME con mutaciones bialélicas en el gen SMN115. En EE.UU., casi todos los pacientes con indicaciones autorizadas han recibido aprobación de su gestor sanitario para acceder al nuevo tratamiento. El 19 de marzo de 2020, Zolgensma fue aprobado por el Ministerio de Salud, Trabajo y Bienestar (MHLW) de Japón para el tratamiento de la AME en pacientes menores de dos años, incluidos aquellos que son presintomáticos en el momento del diagnóstico16. La aprobación de la CE se aplica a los 27 estados miembros de la Unión Europea, así como a Islandia, Noruega, Liechtenstein y el Reino Unido.
Referencias
1. Estim. 10-year cumulative SMA costs for major EU markets based on available data including local healthcare resource utilizations studies, local databases and public information from previous SMA therapy economic assessments, as of February 21, 2020.
2. De Lemus Belmonte M (presidenta FundAME). La Comisión Europea autoriza la comercialización de Zolgensma®, el segundo tratamiento específico en la historia para la AME. FundAME. 2020. https://www.fundame.net/investigacion-ame/ultimas-noticias/528-la-comisio-n-europea-autoriza-la-comercializacio-n-de-zolgensma-el-segundo-tratamiento-especi-fico-en-la-historia-para-la-ame.html
3. www.farmacosalud.com Nusinersen recibe la opinión positiva para tratar la atrofia muscular espinal. 2017. https://farmacosalud.com/nusinersen-recibe-la-opinion-positiva-para-tratar-la-atrofia-muscular-espinal/
4. AEMPS. Informe de PosicionamientoTerapéutico de nusinersen (Spinraza®) en atrofia muscular espinal. Web AEMPS. 2018. IPT, 5/2018. V1. https://www.aemps.gob.es/medicamentosUsoHumano/informesPublicos/docs/IPT-nusinersen-Spinraza-atrofia-muscular-espinal.pdf
5. Data on file.
6. Anderton RS and Mastaglia FL. Expert Rev Neurother. 2015;15(8):895-908.
7. National Organization for Rare Disorders (NORD). Spinal Muscular Atrophy. http://rarediseases.org/rarediseases/spinal-muscular-atrophy/. Accessed October 9, 2018
8. PNCR, Pediatric Neuromuscular Clinical Research. PNCR Database: Weights (kg) by Patient Ages (Months) for SMA Types I, II, and III All Visits. Accessed March 13, 2020. WHO, World Health Organization. Growth reference 5-19 years. Weight-for-age (5-10 years). Accessed March 29, 20.
9. STR1VE-US, START and SPR1NT clinical data on file.
10. Finkel RS, et al. Neurology. 2014;83(9):810-817.
11. Verhaart IEC, et al. J Neurol. 2017;264(7):1465-1473.
12. Soler‐Botija C, et al. Brain. 2002;125(7):1624-1634.
13. Wang CH, et al. J Child Neurol. 2007;22(8):1027-1049.
14. Darras BT, Finkel RS Spinal Muscular Atrophy. Chapter 25 - Natural History of Spinal Muscular Atrophy. Octubre de 2017.
15. U.S. FDA approval of Zolgensma: https://www.fda.gov/vaccines-blood-biologics/zolgensma.
16. Japanese MHLW approval of Zolgensma: https://www.novartis.com/news/media-releases/novartis-receives-approval-from-japanese-ministry-health-labour-and-welfare-zolgensma-only-gene-therapy-patients-spinal-muscular-atrophy-sma.




