Redacción Farmacosalud.com
Obinutuzumab, comercializado como Gazyvaro® (Roche), reduce en un 61% el riesgo de progresión o muerte en comparación con el actual tratamiento estándar para la leucemia linfática crónica (LLC), “la leucemia más frecuente en la edad adulta en nuestro medio. Es una enfermedad que se caracteriza por la acumulación y proliferación de linfocitos maduros clonales B CD5 positivos en la sangre, médula ósea y ganglios linfáticos. Actualmente, la mayoría de los pacientes con LLC se diagnostican por el hallazgo incidental de un recuento linfocitario elevado sin presentar síntomas derivados de la enfermedad”, explica el doctor Pau Abrisqueta, médico adjunto del Servicio de Hematología del Hospital Universitario Vall d’Hebron de Barcelona.
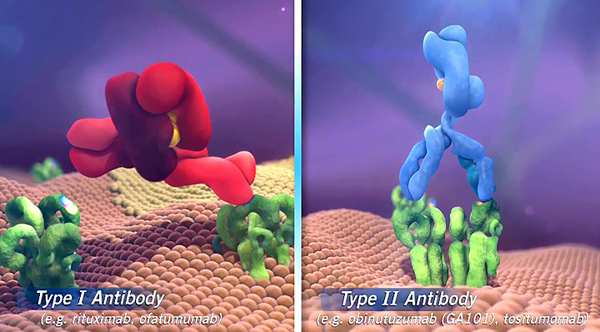
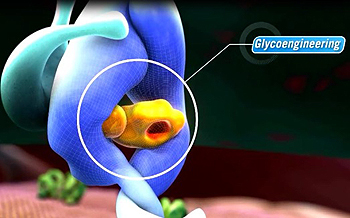
El éxito terapéutico de obinutuzumab reside en el hecho de que es el primer anticuerpo monoclonal de tipo II anti-CD20 diseñado por glicoingeniería que se une a la proteína CD20 de las células B cancerosas, causantes de la LLC. El fármaco “ha demostrado una mayor depleción de linfocitos B, así como una mayor eficacia antitumoral en comparación con rituximab. Actualmente se hallan en curso diversos ensayos clínicos con obinutuzumab en otros síndromes linfoproliferativos B donde será de gran relevancia determinar su posible beneficio frente a los anti-CD20 mayoritariamente utilizados hasta la fecha, principalmente el rituximab”, señala Abrisqueta.
-¿A grandes rasgos, qué diferencia la leucemia linfática crónica (LLC) de los otros tipos de leucemias?
En primer lugar, cabe resaltar que la LLC es la leucemia más frecuente en la edad adulta en nuestro medio. Es una enfermedad que se caracteriza por la acumulación y proliferación de linfocitos maduros clonales B CD5 positivos en la sangre, médula ósea y ganglios linfáticos. Actualmente, la mayoría de los pacientes con LLC se diagnostican por el hallazgo incidental de un recuento linfocitario elevado sin presentar síntomas derivados de la enfermedad.
Representación 3D de un linfocito B
(Imagen modificada) Autor/a del original: BruceBlaus. When using this image in external sources it can be cited as: Blausen.com staff. "Blausen gallery 2014". Wikiversity Journal of Medicine. DOI:10.15347/wjm/2014.010. ISSN 20018762.
Fuente: Wikipedia
La mediana de supervivencia de los pacientes es de alrededor de 10 años, aunque su curso clínico es heterogéneo: mientras que algunos pacientes presentan una evolución indolente con una larga supervivencia, otros progresan de forma precoz y fallecen por causas relacionadas con la enfermedad. Finalmente, mencionar que en la población sana se pueden identificar pequeñas poblaciones clonales u oligoclonales de linfocitos B con fenotipo de LLC. Esta situación, definida como linfocitosis B monoclonal, precedería a la LLC y se puede hallar hasta en el 3,5% de los individuos mayores de 40 años de edad.
-No existe una causa clara de la LLC. ¿Se sospecha si puede haber algún componente genético en la aparición de la afección?
La patogenia de la LLC sigue sin ser todavía bien conocida. No se ha determinado con exactitud cuál es el origen de la célula tumoral ni los mecanismos involucrados en su transformación neoplásica. Dicho esto, se pueden detectar alteraciones cromosómicas hasta en el 80% de los pacientes por técnicas de FISH (hibridación in situ con sondas fluorescentes), siendo la más común la deleción de 13q, que ocurre en más del 50% de los pacientes. Además, estas alteraciones tienen impacto pronóstico; por ejemplo, la deleción de 17p se asocia a un curso desfavorable de la enfermedad. Además, durante los últimos años y mediante las técnicas de secuenciación masiva de nueva generación se han hallado diferentes mutaciones recurrentes en diversos genes con una probable implicación en la patogenia y en el curso clínico de la enfermedad, como NOTCH1, SF3B1, o BIRC3.
Sin embargo, a pesar de todo ello no se ha encontrado todavía una mutación común causante de la LLC, y aun considerando los 50 genes más frecuentemente mutados en esta enfermedad, no se halla ninguna de esas mutaciones en una proporción importante de pacientes. Finalmente, cabe destacar que en el desarrollo de la LLC juegan un papel importante no sólo eventos de la propia célula tumoral, genéticos y epigenéticos, sino también factores externos a ella, como los estímulos antigénicos y el microambiente celular no tumoral.

Doctor Pau Abrisqueta
Fuente: Dr. Abrisqueta
-Com usted apuntaba, habitualmente esta patología se diagnostica mediante una analítica rutinaria porque los pacientes suelen estar asintomáticos. ¿De todas formas, existe/n algún/os síntoma/s que pueda/n dar a entender que puede estarse ante un caso de leucemia linfática crónica?
La presentación clínica de la LLC es variable. Como bien dice, la gran mayoría de diagnósticos se realizan en pacientes asintomáticos por el hallazgo casual de una linfocitosis en una analítica de rutina. A pesar de ello, algunos pacientes pueden referir síntomas, tanto al diagnóstico como durante la evolución de la enfermedad. Los pacientes pueden presentar crecimiento adenopático*, organomegalias**, como hepatomegalia o esplenomegalia, hipertrofia amigdalar y/o alteraciones cutáneas, y aunque de forma infrecuente, pueden también referir síntomas B como son sudoración nocturna, fiebre, o pérdida de peso, así como cansancio e intolerancia física progresiva. Además, pueden presentar infecciones de repetición, favorecidas por la hipogammaglobulinemia que se encuentra de forma frecuente en estos pacientes (60%).
-¿Qué pruebas procede practicar para diagnosticar una leucemia linfática crónica y para determinar el alcance de la enfermedad en el momento de la detección?
Actualmente, para el diagnóstico de la LLC se requiere la presencia en sangre periférica de ≥ 5x109/L linfocitos clonales con un inmunofenotipo de LLC durante al menos 3 meses. La clonalidad de los linfocitos circulantes debe confirmarse por citometría de flujo. En ausencia de adenopatías, visceromegalias, citopenias o síntomas relacionados con la enfermedad, la presencia de menos de 5x109/L linfocitos clonales se define como una linfocitosis B monoclonal. Si existen citopenias causadas por infiltración medular debe considerarse una LLC con independencia del número de linfocitos B en sangre periférica.
En la LLC existen dos sistemas de estadiaje utilizados de forma universal: los sistemas de Rai y de Binet. Los dos sistemas describen tres subgrupos de pacientes con supervivencias claramente diferenciadas: estadio inicial (Rai 0, Binet A), estadio intermedio (Rai I/II, Binet B) y estadio avanzado (Rai III/IV, Binet C). Ambos sistemas son muy sencillos y pueden aplicarse de forma amplia. Ambos se fundamentan en la exploración física y en un test de hemograma, sin requerir técnicas de imagen. Fueron los primeros factores pronósticos usados de forma extensa en la LLC y continúan siendo actualmente una valiosa herramienta que, de forma sencilla y poco costosa, predicen la supervivencia de los pacientes.
Sin embargo, a pesar de su utilidad, cabe destacar que existe una gran heterogeneidad en el comportamiento clínico de los pacientes dentro de cada una de las categorías. Además, a esta limitación se le suma el hecho de que la mayoría de los pacientes actualmente se diagnostican en estadios iniciales, Rai 0 y Binet A, con lo que el estadio por sí mismo no predice adecuadamente el riesgo de progresión para un paciente concreto.
-Las fases iniciales de esta patología no suelen requerir tratamiento, incluso durante años. ¿Cuándo hay que empezar a aplicar una terapia?
Actualmente, existe un consenso generalizado en mantener una conducta expectante en los pacientes asintomáticos y con enfermedad estable, con independencia de la presencia o no de factores biológicos de pronóstico adverso, hasta que se observen signos claros de actividad de la enfermedad.
El tratamiento en estadios iniciales no modifica la historia natural de la enfermedad ni la expectativa de vida de los pacientes. Por lo tanto, estos pacientes no deben tratarse salvo que existan signos claros de actividad de la enfermedad, como son los siguientes criterios recomendados por el International Workshop on Chronic Lymphocytic Leukemia (IWCLL): síntomas generales tales como fiebre, sudoración nocturna o pérdida de peso, linfadenopatías sintomáticas, de crecimiento progresivo o masivo, esplenomegalia*** sintomática, de crecimiento progresivo o de gran tamaño, fallo medular progresivo, linfocitosis progresiva con un tiempo de duplicación linfocitario corto (inferior a 6 meses), o anemia hemolítica o trombocitopenia inmune que no respondan al tratamiento corticoesteroideo.
-La LLC es un cáncer sanguíneo caracterizado por un exceso de linfocitos B, un tipo de glóbulo blanco que interviene a la hora de combatir las infecciones. En los casos de leucemia linfática crónica, el deficiente funcionamiento del sistema inmunológico es terreno abonado para las infecciones. ¿Cómo se puede evitar eso?
Los pacientes con LLC presentan un mayor riesgo de sufrir infecciones, lo que conlleva un aumento de la morbi-mortalidad de los enfermos. Los defectos de la inmunidad humoral de los pacientes favorece las infecciones por gérmenes encapsulados tales como Streptococcus pneumoniae. Asimismo, los defectos en la función de los linfocitos T puede aumentar el riesgo de reactivaciones virales, fundamentalmente de la familia herpesvirus. Por todo ello, debe prestarse una especial atención a estos enfermos en el momento de la aparición de signos de infección sistémica o fiebre. Tanto la vacuna antineumocócica como la de la gripe están recomendadas en estos pacientes.
Finalmente, la administración de inmunoglobulinas intravenosas de forma profiláctica puede tener un papel en un subgrupo de enfermos con hipogammaglobulinemia e infecciones graves recurrentes. Sin embargo, cabe señalar que su uso no ha demostrado mejorar la supervivencia de estos enfermos, y no está exenta de posibles toxicidades.
Fuente: Roche / Planner Media
-¿Qué otras posibles complicaciones deben preocupar a los médicos? ¿Qué medidas procede aplicar para combatir los problemas añadidos?
Otros fenómenos asociados a la enfermedad son las alteraciones autoinmunes, de entre las cuales las más frecuentes son la anemia hemolítica (10% a 25% de los casos) y la trombocitopenia (2%). De forma más infrecuente (<1%) los pacientes pueden desarrollar una eritroblastopenia****. Finalmente, los pacientes con LLC pueden presentar una transformación a un síndrome linfoproliferativo de alto grado. Entre un 2% - 8% de los pacientes pueden desarrollar un linfoma difuso de células grandes B, síndrome de Richter, y de forma muy infrecuente, un linfoma de Hodgkin, <1%. Otra consideración a tener en cuenta es una mayor asociación a segundas neoplasias.
-El fármaco obinutuzumab reduce en un 61% el riesgo de progresión o muerte en comparación con el actual tratamiento estándar para la LLC. ¿Este destacado avance está indicado para todos los pacientes?
Las combinaciones de inmunoquimioterapia basadas en fludarabina, particularmente FCR, siguen considerándose actualmente como el tratamiento estándar de primera línea en los pacientes con LLC que requieren tratamiento y presentan un estado físico adecuado para recibir esta terapia. Sin embargo, la LLC es una enfermedad que predomina en personas de edad avanzada, con lo que una proporción significativa de estos pacientes presentan comorbilidades que pueden condicionar una mayor toxicidad a estos procedimientos terapéuticos.
Durante años el tratamiento de los pacientes no candidatos a recibir fludarabina se ha dirigido al control de los síntomas derivados de la enfermedad mediante el uso de agentes de quimioterapia menos tóxicos, principalmente el clorambucilo, aunque sin conseguir prácticamente ningún impacto sobre la historia natural de la enfermedad. Es en esta población de enfermos donde la combinación de obinutuzumab junto con clorambucilo ha demostrado mejorar tanto la supervivencia libre de progresión como la supervivencia global de los enfermos en comparación con clorambucilo, sin un aumento significativo de la toxicidad del tratamiento. Estos resultados han motivado la aprobación de la combinación de obinutuzumab junto con clorambucilo tanto por la US Food and Drug Administration (FDA) como por la European Medicines Agency (EMA) como tratamiento de primera línea en la LLC en los pacientes no candidatos a tratamiento con fludarabina.
Fuente: Roche / Planner Media
-Obinutuzumab es el primer anticuerpo monoclonal de tipo II anti-CD20 diseñado por glicoingeniería que se une a la proteína CD20 de las células B cancerosas, causantes de la LLC y también de ciertas formas de linfoma no Hodgkin (LNH). ¿El mecanismo de acción del nuevo fármaco podría inspirar su uso en otro tipo de procesos tumorales?
En comparación con los anticuerpos de tipo I, obinutuzumab ha demostrado una mayor citotoxicidad celular dependiente de anticuerpo y citotoxicidad directa, y una menor citotoxicidad dependiente de complemento. La modificación por glicoingeniería de la porción Fc de obinutuzumab aumenta su afinidad por los receptores FcγIII de las células efectoras inmunes como los linfocitos natural killer, los macrófagos y los monocitos, lo que mejora la citotoxicidad celular dependiente de anticuerpo.
Estas diferencias en el mecanismo de acción de obinutuzumab en comparación con otros anticuerpos monoclonales como el rituximab se traducen en los estudios ex vivo en una mayor depleción de linfocitos B. Estos resultados van en consonancia con los obtenidos de los estudios clínicos con LLC, donde obinutuzumab ha demostrado una mayor depleción de linfocitos B, así como una mayor eficacia antitumoral en comparación con rituximab. Actualmente se hallan en curso diversos ensayos clínicos con obinutuzumab en otros síndromes linfoproliferativos B donde será de gran relevancia determinar su posible beneficio frente a los anti-CD20 mayoritariamente utilizados hasta la fecha, principalmente el rituximab.
-Otra opción terapéutica para la LLC es el trasplante de médula ósea o de células madre. Este procedimiento puede ofrecer una cura potencial pero también hay unos riesgos. ¿Cuál el perfil de paciente susceptible de someterse al trasplante?
Clásicamente, en la LLC se ha reservado el trasplante únicamente a un subgrupo concreto de pacientes de especial mal pronóstico, fundamentalmente aquellos sujetos con características biológicas de muy alto riesgo, esencialmente pacientes con alteraciones de P53, o a los pacientes refractarios a los análogos de las purinas o con una respuesta corta tras ellos.
En estas situaciones el trasplante alogénico de intensidad reducida consigue mantener respuestas a largo plazo en un 30% a 60% de los pacientes, según las diferentes series. Sin embargo, los buenos resultados obtenidos con los nuevos fármacos introducidos recientemente en el tratamiento de la LLC, particularmente los inhibidores de BTK, PI3K, o de BCL2, han abierto el debate sobre la necesidad de este procedimiento, que sigue asociado a una morbi-mortalidad no despreciable, dado que a pesar de los avances obtenidos con los regímenes de intensidad reducida todavía se mantiene una mortalidad no asociada a la recaída de alrededor de un 20%. En el momento actual no pueden darse recomendaciones firmes a este respecto; en la valoración de una u otra opción debe tenerse en cuenta varios factores tales como las características del paciente y donante, la situación de la enfermedad (primera línea – recaída/refractariedad) y la presencia de factores de riesgo biológico, como la deleción de 17p.
* Crecimiento adenopático: aumento anormal del tamaño de los ganglios linfáticos
** Organomegalia: agrandamiento anormal de los órganos
*** Esplenomegalia: agrandamiento patológico del bazo
**** Eritroblastopenia: disminución o ausencia de la formación de glóbulos rojos




