Redacción Farmacosalud.com
En el presente informe se reseñan los medicamentos ya evaluados por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS), considerados de mayor interés para el profesional sanitario. Se trata de opiniones técnicas positivas de la AEMPS correspondientes al mes de julio que son previas a la autorización y puesta en el mercado del medicamento, lo que sucederá dentro de algunos meses, informa este organismo mediante un comunicado. Una vez los nuevos fármacos se hayan autorizado, toda la información de cada uno de ellos (desde la ficha técnica y prospecto, hasta sus condiciones de prescripción, uso y disponibilidad real en el mercado) se podrá consultar en la web de la AEMPS, dentro de la sección CIMA: Centro de Información Online de Medicamentos de la AEMPS.
Vitrakvi (LAROTRECTINIB)
Indicación aprobada: Vitrakvi en monoterapia está indicado para el tratamiento de pacientes adultos y pediátricos con tumores sólidos que presentan una fusión del gen del receptor tirosina quinasa neurotrófico (NTRK) que tienen enfermedad localmente avanzada, metastásica o cuando la resección quirúrgica puede dar lugar a morbilidad severa, y no tienen opciones de tratamiento satisfactorias. Vitrakvi estará disponible como solución oral (20 mg/ml) y como cápsulas duras (25 y 100 mg).

Autor de la imagen: J
Fuente: J / www.farmacosalud.com
Epidyolex (CANNABIDIOL)
Indicación aprobada: Epidyolex está indicado para su uso como tratamiento adyuvante de las convulsiones asociadas al síndrome de Lennox-Gastaut (SLG) o al síndrome de Dravet (SD), junto con clobazam, para pacientes de 2 años de edad o mayores. Epidyolex estará disponible como solución oral de 100 mg/ml. La sustancia activa es cannabidiol, un antiepiléptico.
Trogarzo (IBALIZUMAB)
Indicación aprobada: Trogarzo, en combinación con otros antirretrovirales, está indicado para el tratamiento de adultos infectados con VIH-1 multirresistente, para quienes de otra forma no es posible realizar una terapia antiviral supresiva. Trogarzo estará disponible como concentrado para solución para infusión (200 mg).
Inbrija (LEVODOPA)
Indicación aprobada: Inbrija está indicado para el tratamiento intermitente de fluctuaciones motoras episódicas (episodios OFF) en pacientes adultos con enfermedad de Parkinson (EP) tratados con levodopa/inhibidor de dopa-descarboxilasa. Inbrija estará disponible como cápsulas duras conteniendo polvo para inhalación (33 mg) para ser utilizadas con un inhalador oral.
Cambios de especial interés sanitario en medicamentos ya autorizados
Nuevas indicaciones con dictamen positivo para su autorización
Autor/a de la imagen: Enric Arandes
Fuente: E. Arandes / www.farmacosalud.com
Para las indicaciones ya autorizadas se recomienda consultar el texto completo de las mismas en las fichas técnicas disponibles en la web de la AEMPS, dentro de la sección CIMA: Centro de Informa-ción Online de Medicamentos de la AEMPS.
Lonsurf (TRIFLURIDINA/TIPIRACIL)
Extensión de la indicación (en negrita): Cáncer colorrectal. Lonsurf está indicado en monoterapia para el tratamiento de pacientes adultos con cáncer colorrectal metastásico (CCRm) que hayan sido previamente tratados o no se les considere candidatos al tratamiento con terapias disponibles, incluidas quimioterapia basada en fluoropirimidinas, oxaliplatino e irinotecán, agentes anti-VEGF y agentes anti-EGFR. Cáncer gástrico: Lonsurf está indicado en monoterapia para el tratamiento de pacientes adultos con cáncer gástrico metastásico incluyendo el adenocarcinoma de la unión gastroesofágica, que han sido previamente tratados con al menos dos regímenes terapéuticos sistémicos para enfermedad avanzada.
Tecentriq (ATEZOLIZUMAB)
Extensión de la indicación (en negrita): Carcinoma urotelial. Tecentriq en monoterapia está indicado para el tratamiento de pacientes adultos con carcinoma urotelial (CU) localmente avanzado o metastásico: después de quimioterapia previa que contenga platino o en los que no son considerados aptos para el tratamiento con cisplatino y cuyos tumores tengan una expresión de PD-L1 > 5%.
Cáncer de pulmón no microcítico. Tecentriq, en combinación con bevacizumab, paclitaxel y carboplatino, está indicado para el tratamiento de primera línea de cáncer de pulmón no microcítico (CPNM) no escamoso metastásico en pacientes adultos. En pacientes con mutaciones de EGFR o ALK positivo, Tecentriq en combinación con bevacizumab, paclitaxel y carboplatino está indicado solamente tras fallo de las terapias dirigidas. Tecentriq en monoterapia está indicado para el tratamiento de pacientes adultos con CPNM localmente avanzado o metastásico después de quimioterapia previa. Los pacientes con mutaciones de EGFR o ALK positivo deben haber sido tratados también con terapias dirigidas antes de ser tratados con Tecentriq. Tecentriq, en combinación con nabpaclitaxel y carboplatino, está indicado como tratamiento de primera línea de adultos con CPNM no escamoso metastásico sin mutaciones EGFR o CPNM ALK positivo.
Perfusor de medicamentos
Autor/a de la imagen: Enric Arandes
Fuente: E. Arandes / www.farmacosalud.com / Gentileza del Hospital Sagrat Cor de Barcelona
Cáncer de pulmón microcítico. Tecentriq, en combinación con carboplatino y etopósido, está indicado para el tratamiento de primera línea de pacientes adultos con cáncer de pulmón microcítico en estadio extenso. Cáncer de mama. Tecentriq en combinación con nabpaclitaxel está indicado para el tratamiento de paciente adultos con cáncer de mama triple negativo (CMTN) irresecable, localmente avanzado o metastásico, con expresión de PD-L1 ≥ 1% y que no han recibido previamente quimioterapia para la enfermedad metastásica.
Zerbaxa (CEFTOLOZANO/TAZOBACTAM)
Extensión de la indicación (en negrita): Zerbaxa está indicado para el tratamiento de las siguientes infecciones en adultos: Infecciones intraabdominales complicadas. Pielonefritis aguda. Infecciones del tracto urinario complicadas. Neumonía nosocomial, incluida la neumonía asociada a ventilación.
Stelara (USTEKINUMAB)
Extensión de la indicación (en negrita): Psoriasis en placas. Stelara está indicado para el tratamiento de la psoriasis en placas, de moderada a grave, en los adultos que no responden, tienen contraindicados o no toleran otros tratamientos sistémicos, incluyendo la ciclosporina, el metotrexato (MTX) o PUVA (psoraleno y ultravioleta A). Psoriasis pediátrica en placas. Stelara está indicado para el tratamiento de la psoriasis en placas de moderada a grave en pacientes adolescentes de 12 años de edad en adelante, que hayan presentado una respuesta inadecuada, o que son intolerantes a otras terapias sistémicas, o fototerapias.
Artritis psoriásica (PsA). Stelara, sólo o en combinación con MTX, está indicado para el tratamiento de la artritis psoriásica activa en pacientes adultos cuando la respuesta a tratamientos previos no biológicos con medicamentos antirreumáticos modificadores de la enfermedad (FARME) ha sido inadecuada. Enfermedad de Crohn. Stelara está indicado para el tratamiento de la enfermedad de Crohn activa, de moderada a grave, en pacientes adultos que hayan tenido una respuesta inadecuada, presenten pérdida de respuesta o sean intolerantes al tratamiento convencional o a antagonistas de TNFalfa o presenten contraindicaciones médicas a esos tratamientos. Colitis ulcerosa. Stelara está indicado para el tratamiento de la colitis ulcerosa activa, de moderada a grave, en pacientes adultos que hayan tenido una respuesta inadecuada, presenten pérdida de respuesta o sean intolerantes al tratamiento convencional o biológico o presenten contraindicaciones médicas a esos tratamientos.
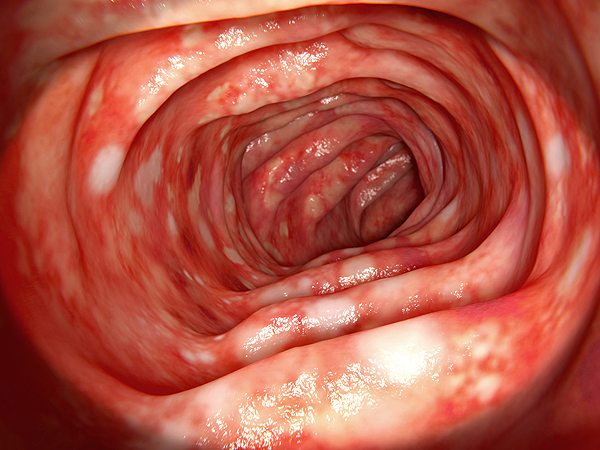
Colon afectado por colitis ulcerosa. Representación endoscópica en 3D
Fuente: Archivo www.farmacosalud.com
Empliciti (ELOTUZUMAB)
Extensión de la indicación (en negrita): Empliciti está indicado en combinación con lenalidomida y dexametasona para el tratamiento de pacientes adultos con mieloma múltiple que han recibido al menos un tratamiento previo. Empliciti está indicado en combinación con pomalidomida y dexametasona para el tratamiento de pacientes adultos con mieloma múltiple refractario y en recaída, que han recibido al menos un tratamiento previo, incluyendo lenalidomida y un inhibidor del proteasoma y que han demostrado progresión de la enfermedad en el último tratamiento.
Keytruda (PEMBROLIZUMAB)
Extensión de la indicación (en negrita): Keytruda en monoterapia está indicado para el tratamiento del melanoma avanzado (irresecable o metastásico) en adultos. Keytruda en monoterapia está indicado para el tratamiento adyuvante en adultos con melanoma en estadio III y con afectación de los ganglios linfáticos que hayan sido sometidos a resección completa.
Keytruda en monoterapia está indicado para el tratamiento de primera línea del cáncer de pulmón no microcítico (CPNM) metastásico en adultos cuyos tumores expresen PD-L1 con una proporción de marcador tumoral (TPS, por sus siglas en inglés) ≥50% sin mutaciones tumorales positivas de EGFR o ALK. Keytruda, en combinación con pemetrexed y quimioterapia basada en platino está indicado para el tratamiento de primera línea del CPNM no escamoso metastásico en adultos cuyos tumores no tengan mutaciones tumorales positivas de EGFR o ALK. Keytruda en monoterapia está indicado para el tratamiento del CPNM localmente avanzado o metastásico en adultos cuyos tumores expresen PD-L1 con una TPS ≥1% y que hayan recibido al 3 menos un tratamiento de quimioterapia previo. Los pacientes con mutaciones tumorales positivas de EGFR o ALK deben haber recibido también terapia dirigida antes de recibir Keytruda.
Fuente: Archivo
Keytruda en monoterapia está indicado para el tratamiento de pacientes adultos con linfoma de Hodgkin clásico (LHc) en recaída o refractario, que no han respondido a un trasplante autólogo de progenitores hematopoyéticos (TAPH) y a brentuximab vedotina (BV), o que no son candidatos a trasplante y no han respondido a BV. Keytruda en monoterapia está indicado para el tratamiento del carcinoma urotelial localmente avanzado o metastásico en adultos que hayan recibido quimioterapia previa basada en platino. Keytruda en monoterapia está indicado para el tratamiento del carcinoma urotelial localmente avanzado o metastásico en adultos que no son candidatos a quimioterapia basada en cisplatino y cuyos tumores expresen PD-L1 con una puntuación positiva combinada (CPS, por sus siglas en inglés) ≥ 10.
Keytruda en monoterapia está indicado para el tratamiento del carcinoma de células escamosas de cabeza y cuello (CCECC) recurrente o metastásico en adultos cuyos tumores expresen PD-L1 con una TPS ≥ 50% y que progresen durante o después de quimioterapia basada en platino. Keytruda, en combinación con axitinib, está indicado en adultos para el tratamiento de primera línea de carcinoma de células renales (CCR) avanzado.
Soliris (ECULIZUMAB)
Extensión de la indicación (en negrita): Soliris está indicado en adultos y niños para el tratamiento de: Hemoglobinuria paroxística nocturna (HPN). La evidencia de beneficio clínico se ha demostrado en pacientes con hemólisis, con uno o más síntomas clínicos indicativos de una alta actividad de la enfermedad, independientemente de los antecedentes de transfusiones. Síndrome hemolítico urémico atípico (SHUa). Soliris está indicado en adultos para el tratamiento de: Miastenia gravis generalizada (MGg) refractaria en pacientes con anticuerpos positivos frente a receptores de la acetilcolina (AchR). Trastorno del espectro de neuromielitis óptica (NMO) en pacientes con resultado positivo a anticuerpos anti-aquaporina-4 (AQP4) y en recaída de la enfermedad.
Lucentis (RANIBIZUMAB)
Extensión de la indicación (en negrita): Lucentis está indicado en adultos para: El tratamiento de la degeneración macular asociada a la edad (DMAE) neovascular (exudativa). El tratamiento de la alteración visual debida a neovascularización coroidea (NVC). El tratamiento de la alteración visual debida al edema macular diabético (EMD). El tratamiento de la alteración visual debida al edema macular secundario a la oclusión de la vena retiniana (OVR) (oclusión de la rama venosa retiniana u oclusión de la vena central retiniana). Lucentis está indicado en prematuros para: El tratamiento de la retinopatía del prematuro (ROP) con zona I (estadio 1+, 2+, 3 o 3+), zona II (estadio 3+) o enfermedad AP-ROP (ROP posterior agresiva).




