Redacción Farmacosalud.com
En el presente informe correspondiente al mes de diciembre de 2017, se reseñan los fármacos ya evaluados por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS), considerados de mayor interés para el profesional sanitario, informa este organismo mediante un comunicado. Se trata de opiniones técnicas positivas de la AEMPS que son previas a la autorización y puesta en el mercado del medicamento, lo que sucederá dentro de algunos meses. Una vez los fármacos se hayan autorizado, toda la información de cada uno de ellos (desde la ficha técnica y prospecto, hasta sus condiciones de prescripción, uso y disponibilidad real en el mercado) se podrá consultar en la web de la AEMPS, dentro de la sección CIMA: Centro de Información Online de Medicamentos de la AEMPS.
NUEVOS MEDICAMENTOS
Opiniones positivas
Alofisel (DARVADSTROCEL)
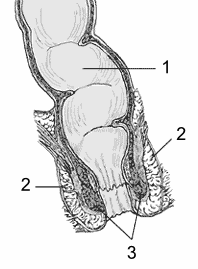
Diagrama del ano y el recto. 1: recto 2: esfínter exterior 3: esfínter interior.
Autor/a de la imagen: U.S. Government National Institutes of Health
http://digestive.niddk.nih.gov/ddiseases/pubs/fecalincontinence/images/anorectum.gif
Fuente: Wikipedia
Indicación aprobada: Tratamiento de las fistulas perianales complejas en pacientes adultos con enfermedad de Crohn luminal leve o inactiva, cuando las fístulas no han respondido adecuadamente a al menos un tratamiento convencional o terapia biológica. Estará disponible como suspensión para perfusión (5 millones células/ml). El principio activo es darvadstrocel, que contiene células madre del tejido adiposo que, una vez activadas, impiden la proliferación de linfocitos y reducen la liberación de citoquinas pro-inflamatorias en los lugares de inflamación.
Alkindi (HIDROCORTISONA)
Nueva formulación para uso exclusivo pediátrico. Indicación aprobada: Tratamiento de sustitución en insuficiencia suprarrenal en lactantes, niños y adolescentes (desde el nacimiento hasta <18 años). Estará disponible en una formulación apropiada para uso exclusivo en niños en dosis de 0,5 mg, 1,0 mg, 2,0 mg y 5,0 mg, como gránulos recubiertos.
Crysvita (BUROSUMAB)
Indicación aprobada: Tratamiento de la hipofosfatemia ligado al cromosoma X con evidencia radiográfica de lesiones óseas en niños mayores de 1 año y adolescentes con esqueleto en crecimiento. Estará disponible como solución para perfusión (10 mg/ml, 20 mg/ml y 30 mg/ml).
Herzuma (TRASTUZUMAB)
Indicación aprobada: Cáncer de mama
Cáncer de mama metastásico. Indicado para el tratamiento de pacientes adultos con cáncer de mama metastásico (CMM) HER2 positivo: En monoterapia, para el tratamiento de aquellos pacientes que hayan recibido al menos dos regímenes quimioterápicos para su enfermedad metastásica. La quimioterapia previa debe haber incluido al menos una antraciclina y un taxano a menos que estos tratamientos no estén indicados en los pacientes. Los pacientes con receptores hormonales positivos también deben haber fracasado al tratamiento hormonal a menos que este no esté indicado.
En combinación con paclitaxel, para el tratamiento de aquellos pacientes que no hayan recibido quimioterapia para su enfermedad metastásica y en los cuales no esté indicado un tratamiento con antraciclinas. En combinación con docetaxel, para el tratamiento de aquellos pacientes que no hayan recibido quimioterapia para su enfermedad metastásica. En combinación con un inhibidor de la aromatasa, para el tratamiento de pacientes posmenopáusicas con CMM y receptor hormonal positivo, que no hayan sido previamente tratadas con trastuzumab.
Fuente: IRB Barcelona (Archivo)
Cáncer de mama precoz. Indicado para el tratamiento de cáncer de mama precoz (CMP) en pacientes adultos con HER2 positivo: Después de cirugía, quimioterapia (adyuvante o neoadyuvante) y radioterapia (si procede). Después de quimioterapia adyuvante con doxorubicina y ciclofosfamida, en combinación con paclitaxel o docetaxel. En combinación con quimioterapia adyuvante consistente en docetaxel y carboplatino. En combinación con quimioterapia neoadyuvante seguido de tratamiento en adyuvancia con Herzuma para enfermedad localmente avanzada (incluyendo enfermedad inflamatoria) o tumores > 2 cm de diámetro.
Debe emplearse únicamente en pacientes con cáncer de mama metastásico o cáncer de mama precoz, cuyos tumores sobreexpresen HER2 o tengan amplificación del gen HER2 determinados mediante un método exacto y validado.
Cáncer gástrico metastásico. En combinación con capecitabina o 5-fluoracilo y cisplatino, está indicado para el tratamiento de pacientes adultos con adenocarcinoma gástrico o unión gastroesofágica metastásico, HER2-positivo, que no hayan recibido un tratamiento previo para metástasis. Debe emplearse únicamente en pacientes con cáncer gástrico metastásico (CGM), cuyos tumores sobreexpresen HER2, definida por IHQ2+ y confirmada por un resultado SISH o FISH o por un resultado IHQ3+. Se deben emplear métodos de valoración exactos y validados.
Estará disponible como dosis de 150 mg de polvo para concentrado para solución para perfusión. Herzuma es un medicamento biosimilar con un alto grado de similitud con el producto de referencia Herceptin que fue autorizado en la UE el 28 de agosto de 2000.
Ozempic (SEMAGLUTIDA)
Indicación aprobada: Indicado para el tratamiento de pacientes adultos con diabetes tipo II insuficientemente controlada, como adyuvante a la dieta y el ejercicio: En monoterapia cuando la metformina se considera inapropiada debido a intolerancia o contraindicaciones. Añadida a otros medicamentos para el tratamiento de la diabetes. Estará disponible en dosis de 1,34 mg/ml solución inyectable.
Cambios de especial interés sanitario en medicamentos ya autorizados
Nuevas indicaciones con dictamen positivo para su autorización
Para las indicaciones ya autorizadas se recomienda consultar el texto completo de las mismas en las fichas técnicas disponibles en la web de la AEMPS, dentro de la sección CIMA: Centro de Información Online de Medicamentos de la AEMPS.

(Imagen modificada) Autor/a del original: nacu
Fuente: morguefile.com (free)
Taltz (IXEKIZUMAB)
Nueva indicación: Artritis psoriásica. Solo o en combinación con metotrexato, está indicado para el tratamiento de la artritis psoriásica activa en pacientes adultos que no han respondido adecuadamente o que no toleran una o más terapias antirreumáticas modificadora de la enfermedad (DMARD). Indicaciones ya autorizadas: Psoriasis en placas. Indicado para el tratamiento de la psoriasis en placas de moderada a grave en adultos que son candidatos a tratamientos sistémicos.
Truvada (EMTRICITABINA /TENOFOVIR DISOPROXILO)
Nueva indicación (extensión de las indicaciones ya autorizadas): Tratamiento de la infección por VIH-1. Indicado en la terapia antirretroviral combinada para el tratamiento de adultos infectados por el virus de la inmunodeficiencia humana VIH-1. También está indicado para el tratamiento de adolescentes infectados por VIH-1 con resistencia a los inhibidores de la transcriptasa inversa análogos de nucleósidos (ITIAN) o toxicidades que impidan el uso de fármacos de primera línea. Profilaxis pre-exposición (PrEP). Indicado en combinación con prácticas sexuales más seguras para la profilaxis de preexposición para reducir el riesgo de infección por VIH-1 adquirida sexualmente en adultos y adolescentes con alto riesgo.
Indicaciones ya autorizadas: Tratamiento de la infección por VIH-1: Truvada está indicado en la terapia antirretroviral combinada para el tratamiento de adultos infectados por el virus de la inmunodeficiencia humana VIH-1. Truvada, también, está indicado para el tratamiento de adolescentes de 12 a <18 años infectados por VIH-1 con resistencia a los inhibidores de la transcriptasa inversa análogos de nucleósidos (ITIAN) o toxicidades que impidan el uso de fármacos de primera línea. Profilaxis pre-exposición (PrEP): Truvada está indicado en combinación con prácticas sexuales más seguras para la profilaxis de preexposición para reducir el riesgo de infección por VIH-1 adquirida sexualmente en adultos con alto riesgo.
Yervoy (IPILIMUMAB)
Nueva indicación (extensión de la indicación ya autorizada): Indicado para el tratamiento del melanoma avanzado (irresecable o metastásico) en adultos y adolescentes de 12 años o mayores. Indicación ya autorizada: Indicado para el tratamiento del melanoma avanzado (irresecable o metastásico) en adultos.




