Redacción Farmacosalud.com
En el presente informe correspondiente al mes de marzo se reseñan los medicamentos ya evaluados por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS), considerados de mayor interés para el profesional sanitario. Se trata de opiniones técnicas positivas de la AEMPS que son previas a la autorización y puesta en el mercado del fármaco, lo que sucederá dentro de algunos meses, informa la AEMPS mediante un comunicado. Una vez los fármacos se hayan autorizado, toda la información de cada uno de ellos (desde la ficha técnica y prospecto, hasta sus condiciones de prescripción, uso y disponibilidad real en el mercado) se podrá consultar en la web de la AEMPS, dentro de la sección CIMA: Centro de Información Online de Medicamentos de la AEMPS.
NUEVOS MEDICAMENTOS
Opiniones positivas
Juluca (DOLUTEGRAVIR / RILPIVIRINA)
Indicación aprobada: Tratamiento de la infección por el virus de la inmunodeficiencia humana tipo 1 (VIH 1) en adultos con supresión virológica (niveles de ARN del VIH-1 < 50 copias/mL) en tratamiento antirretroviral estable durante al menos 6 meses sin historia de fallo virológico y sin sospecha ni conocimiento de resistencia a ningún inhibidor de la transcriptasa inversa no-nucleósido o inhibidor de integrasa. Estará disponible como comprimidos recubiertos con película (50 mg/25 mg).
Autor/a: Enric Arandes
Fuente: E. Arandes / www.farmacosalud.com
Kanjinti (TRASTUZUMAB)
Indicación aprobada: Cáncer de mama. Cáncer de mama metastásico. Indicado para el tratamiento de pacientes adultos con cáncer de mama metastásico (CMM) HER2 positivo: En monoterapia, para el tratamiento de aquellos pacientes que hayan recibido al menos dos regímenes quimioterápicos para su enfermedad metastásica. La quimioterapia previa debe haber incluido al menos una antraciclina y un taxano a menos que estos tratamientos no estén indicados en los pacientes. Los pacientes con receptores hormonales positivos también deben haber fracasado al tratamiento hormonal a menos que este no esté indicado. En combinación con paclitaxel, para el tratamiento de aquellos pacientes que no hayan recibido quimioterapia para su enfermedad metastásica y en los cuales no esté indicado un tratamiento con antraciclinas. En combinación con docetaxel, para el tratamiento de aquellos pacientes que no hayan recibido quimioterapia para su enfermedad metastásica. En combinación con un inhibidor de la aromatasa, para el tratamiento de pacientes posmenopáusicas con CMM y receptor hormonal positivo, que no hayan sido previamente tratadas con trastuzumab.
Cáncer de mama precoz. Indicado para el tratamiento de cáncer de mama precoz (CMP) en pacientes adultos con HER2 positivo: Después de cirugía, quimioterapia (adyuvante o neoadyuvante) y radioterapia (si procede). Después de quimioterapia adyuvante con doxorubicina y ciclofosfamida, en combinación con paclitaxel o docetaxel. En combinación con quimioterapia adyuvante consistente en docetaxel y carboplatino. En combinación con quimioterapia neoadyuvante seguido de tratamiento en adyuvancia con Kanjinti para enfermedad localmente avanzada (incluyendo enfermedad inflamatoria) o tumores > 2 cm de diámetro.
Debe emplearse únicamente en pacientes con cáncer de mama metastásico o cáncer de mama precoz, cuyos tumores sobreexpresen HER2 o tengan amplificación del gen HER2 determinados mediante un método exacto y validado.
Cáncer gástrico metastásico. En combinación con capecitabina o 5-fluoracilo y cisplatino, está indicado para el tratamiento de pacientes adultos con adenocarcinoma gástrico o unión gastroesofágica metastásico, HER2-positivo, que no hayan recibido un tratamiento previo para metástasis. Debe emplearse únicamente en pacientes con cáncer gástrico metastásico (CGM), cuyos tumores sobreexpresen HER2, definida por IHQ2+ y confirmada por un resultado SISH o FISH o por un resultado IHQ3+. Se deben emplear métodos de valoración exactos y validados. Estará disponible como dosis de 150 mg y de 420 mg de polvo para concentrado para solución para perfusión. Kanjinti es un medicamento biosimilar con un alto grado de similitud con el producto de referencia Herceptin.
Perfusor de medicamentos
Autor/a de la imagen: Enric Arandes
Fuente: E. Arandes / www.farmacosalud.com / Gentileza del Hospital Sagrat Cor de Barcelona
Rubraca (RUCAPARIB)
Indicación aprobada: Tratamiento en monoterapia de pacientes adultas con cáncer de ovario epitelial seroso de alto grado, trompa de Falopio o peritoneal primario, con mutación BRCA (germinal y/o somática), sensible a platino, recurrente o progresivo, que hayan sido tratadas previamente con dos o más pautas de quimioterapia basadas en platino, y que no toleren más quimioterapia basada en platino. Estará disponible como comprimidos recubiertos de película de 200 mg, 250 mg y 300 mg.
Zessly (INFLIXIMAB)
Indicación aprobada: Artritis reumatoide. Zessly, en combinación con metotrexato, está indicado en la reducción de los signos y síntomas, así como en la mejoría de la función física en: Pacientes adultos con enfermedad activa, cuando la respuesta a los fármacos antirreumáticos modificadores de la enfermedad (FAMEs), incluido el metotrexato, ha sido inadecuada. Pacientes adultos con enfermedad grave, activa y progresiva no tratados previamente con metotrexato u otros fármacos modificadores de la enfermedad (FAME).
Enfermedad de Crohn en adultos. Zessly está indicado en: El tratamiento de la enfermedad de Crohn activa, de moderada a grave, en pacientes adultos que no han respondido a pesar de un curso de terapia completo y adecuado con un corticosteroide y/o un inmunosupresor; o que sean intolerantes o presenten contraindicaciones médicas a dichas terapias. El tratamiento de la enfermedad de Crohn activa, fistulizante, en pacientes adultos que no han respondido a pesar de un curso de tratamiento completo y adecuado con tratamiento convencional (incluidos antibióticos, drenaje y terapia inmunosupresora). Enfermedad de Crohn en pediatría. Zessly está indicado en el tratamiento de la enfermedad de Crohn activa grave, en niños y adolescentes entre 6 y 17 años, que no han respondido a la terapia convencional incluidos un corticosteroide, un inmunomodulador y terapia nutricional primaria; o que sean intolerantes o presenten contraindicaciones a dichas terapias. Infliximab solamente se ha estudiado en combinación con terapia inmunosupresora convencional.
Fuente: Archivo
Colitis ulcerosa. Zessly está indicado en el tratamiento de la colitis ulcerosa activa, de moderada a grave, en pacientes adultos que han presentado una respuesta inadecuada a la terapia convencional, incluidos corticosteroides y 6-mercaptopurina (6-MP) o azatioprina (AZA), o que presenten intolerancia o contraindicaciones a dichas terapias. Colitis ulcerosa en pediatría. Zessly está indicado en el tratamiento de la colitis ulcerosa activa grave, en niños y adolescentes entre 6 y 17 años, que han tenido una respuesta inadecuada a la terapia convencional incluyendo corticosteroides y 6-MP o AZA, o que son intolerantes o tienen contraindicaciones médicas a dichas terapias. Espondilitis anquilosante: Zessly está indicado en el tratamiento de la espondilitis anquilosante activa, grave, en pacientes adultos que han respondido de forma inadecuada a la terapia convencional. Artritis psoriásica: Zessly está indicado en el tratamiento de la artritis psoriásica activa y progresiva en pacientes adultos cuando la respuesta a la terapia previa con FAME no ha sido adecuada.
Zessly se debe administrar: en combinación con metotrexato, o en monoterapia en pacientes que presenten intolerancia a metotrexato o en los que esté contraindicado metotrexato.
Psoriasis. Zessly está indicado en el tratamiento de la psoriasis en placas, de moderada a grave, en pacientes adultos que no han respondido, o que tienen contraindicación, o que presentan intolerancia a otra terapia sistémica, entre ellos ciclosporina, metotrexato o psoraleno-ultravioleta A (PUVA). Estará disponible en polvo para concentrado para solución para infusión (100 mg). Zessly es un medicamento biosimilar con un alto grado de similitud con el producto de referencia Remicade.
Cambios de especial interés sanitario en medicamentos ya autorizados
Nuevas indicaciones con dictamen positivo para su autorización
Para las indicaciones ya autorizadas se recomienda consultar el texto completo de las mismas en las fichas técnicas disponibles en la web de la AEMPS, dentro de la sección CIMA: Centro de Información Online de Medicamentos de la AEMPS.
Cabometyx (CABOZANTINIB)
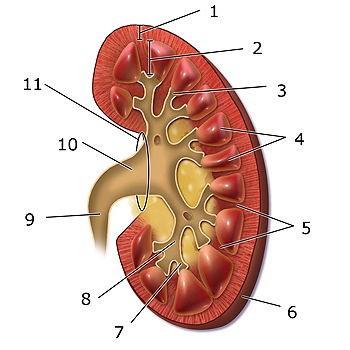
Esquema del riñón: 1. Corteza renal, 2. Médula renal, 3. Papila renal, 4, Pirámide renal, 5. Columna renal, 6. Cápsula fibrosa, 7. cáliz menor, 8. cáliz mayor, 9. Uréter, 10. Pelvis renal, 11. Hilio renal
Autor/a de la imagen: Modificado de BruceBlaus - Wikimedia Commons file:Blausen 0593 KidneyAnatomy 02.png
Fuente: Wikipedia
Nueva indicación (extensión de la indicación ya autorizada): Cabometyx está indicado para el tratamiento del carcinoma de células renales (CCR) avanzado: En adultos no tratados con riesgo de bajo a moderado. En adultos después del tratamiento con una terapia previa dirigida al factor de crecimiento del endotelio vascular (VEGF). Indicación ya autorizada: Cabometyx está indicado para el tratamiento del carcinoma de células renales (CCR) avanzado en adultos después del tratamiento con una terapia previa dirigida al factor de crecimiento del endotelio vascular (VEGF).
Ivemend (FOSAPREPITANT)
Nueva indicación (extensión de la indicación ya autorizada: Prevención de las náuseas y vómitos asociados a quimioterapia antineoplásica moderada y altamente emetógena en adultos y niños con 6 meses de edad o mayores. Ivemend 150 mg se administra como parte de un tratamiento combinado. Indicación ya autorizada: Prevención de las náuseas y los vómitos agudos y diferidos asociados a quimioterapia antineoplásica altamente emetógena basada en cisplatino en adultos. Prevención de las náuseas y los vómitos asociados a quimioterapia antineoplásica moderadamente emetógena en adultos. Ivemend 150 mg se administra como parte de un tratamiento combinado.
Repatha (EVOLOCUMAB)
Nueva indicación: Enfermedad cardiovascular aterosclerótica establecida. Repatha está indicado en adultos con enfermedad cardiovascular aterosclerótica establecida (infarto de miocardio, accidente cerebrovascular o enfermedad arterial periférica) para reducir el riesgo cardiovascular por medio de la reducción de los niveles de LDL-C, como adyuvante para la corrección de otros factores de riesgo: en combinación con la dosis máxima tolerada de estatinas con o sin otros hipolipemiantes o, solo o en combinación con otros hipolipemiantes en pacientes intolerantes a estatinas o en los que las estatinas están contraindicadas. Hipercolesterolemia familiar homocigótica. Repatha está indicado en adultos y adolescentes a partir de 12 años con hipercolesterolemia familiar homocigótica en combinación con otros tratamientos hipolipemiantes.
Indicación ya autorizada: Hipercolesterolemia y dislipidemia mixta. Repatha está indicado en adultos con hipercolesterolemia primaria (familiar heterocigótica y no familiar) o dislipidemia mixta, como complemento a la dieta: en combinación con una estatina o con una estatina y otros tratamientos hipolipemiantes en pacientes que no consiguen alcanzar los niveles objetivo de C-LDL con la dosis máxima tolerada de estatina, o bien solo o en combinación con otros tratamientos hipolipemiantes en pacientes intolerantes a las estatinas o en los que las estatinas están contraindicadas.
Hipercolesterolemia familiar homocigótica. Repatha está indicado en adultos y adolescentes a partir de 12 años con hipercolesterolemia familiar homocigótica en combinación con otros tratamientos hipolipemiantes. El efecto de Repatha en la morbilidad y mortalidad cardiovascular aún no se ha determinado.




