Redacción Farmacosalud.com
A continuación se indican los medicamentos evaluados por el Comité de Medicamentos de Uso Humano (CHMP, por sus siglas en inglés) de la Agencia Europea de Medicamentos (EMA), en el que participa la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS), considerados de interés para el profesional sanitario. Se trata de opiniones del CHMP, previas a la autorización por la Comisión Europea y a la puesta en el mercado del medicamento, lo que sucederá dentro de algunos meses, informa la AEMPS mediante su boletín del mes de octubre de 2020. Una vez los fármacos se hayan autorizado e iniciado el proceso para su comercialización en España, la ficha técnica y prospecto, así como sus condiciones de prescripción, uso y disponibilidad real en el mercado, se podrán consultar en la web de la AEMPS, dentro de la sección CIMA: Centro de Información Online de Medicamentos de la AEMPS.
Fintepla (FENFLURAMINA)
Indicación aprobada: Indicado, en combinación con otros antiepilépticos, en el tratamiento de las convulsiones asociadas al Síndrome de Dravet en pacientes de 2 años y mayores. Fintepla estará disponible como solución oral (2,2 mg/ml). Fintepla fue designado medicamento huérfano el 16 de enero de 2014.

Autor/a de la imagen: Enric Arandes
Fuente: E. Arandes / www.farmacosalud.com
Leqvio (INCLISIRÁN)
Indicación aprobada: Indicado como complemento a la dieta en adultos con hipercolesterolemia primaria (sea o no del tipo familiar heterocigoto) o dislipidemia mixta: En combinación con una estatina o con una estatina y otra medicación hipolipemiante, en pacientes que no consigan alcanzar los objetivos de colesterol LDL con la dosis máxima tolerada de una estatina; solo o en combinación con otras terapias hipolipemiantes, en pacientes con intolerancia a las estatinas o en los que el uso de estatinas esté contraindicado. Leqvio estará disponible como solución inyectable (284 mg).
Libmeldy (CULTIVO CELULAR AUTÓLOGO DE CD34+, ENRIQUECIDO CON CÉLULAS MADRE Y CÉLULAS PROGENITORAS HEMATOPOYÉTICAS TRANSDUCIDAS EX VIVO USANDO UN VECTOR LENTIVIRAL (LENTIVIRUS) CON EL GEN HUMANO ARILSULFATASA A)
Indicación aprobada: Indicado en el tratamiento de la leucodistrofia metacromática (LMC), caracterizada por una mutación bialélica en el gen de la arilsulfatasa A (ARSA) que se traduce en una reducción en la actividad de la enzima ARSA, en niños con: LMC infantil tardía o juvenil sin manifestaciones clínicas de la enfermedad, LMC juvenil con manifestaciones clínicas tempranas, que todavía pueden caminar de forma independiente y en los que aún no ha empezado el deterioro cognitivo. Como consecuencia del déficit de la enzima ARSA se acumulan sulfátidos en el cerebro, el sistema nervioso y otros órganos. Libmeldy se administra vía intravenosa una única vez. Libmeldy fue designado medicamento huérfano el 13 de abril de 2007.
Oxlumo (LUMASIRAN)
Indicación aprobada: Indicado en el tratamiento de hiperoxaluria tipo 1 en todos los grupos de edad. Oxlumo estará disponible como solución inyectable (189 mg/ml). Oxlumo fue designado medicamento huérfano el 21 de marzo de 2016.
Palforzia (POLVO DESENGRASADO DE CACAHUETE – ARACHIS HYPOGAEA L., SEMEN)

Autor de la imagen: J
Fuente: J / www.farmacosalud.com
Indicación aprobada: Indicado en el tratamiento de pacientes de 4 a 17 años con un diagnóstico confirmado de alergia al cacahuete. Palforzia puede continuar administrándose en pacientes de 18 años y mayores. Este medicamento debe ser utilizado en combinación con una dieta libre de cacahuete y bajo la supervisión de profesional sanitario cualificado en el diagnóstico y tratamiento de enfermedades alérgicas. Palforzia estará disponible como polvo oral en sobres de 300 mg y en cápsulas de apertura manual de 0,5 mg, 1 mg, 10 mg, 20 mg y 100 mg, para su mezcla con alimentos.
Rekambys (RILPIVIRINA)
Indicación aprobada: Indicado, en combinación con cabotegravir inyectable, para el tratamiento de la infección por el virus de inmunodeficiencia humano tipo 1 (VIH-1) en adultos con carga viral indetectable (HIV-1 RNA < 50 copias/mL) que siguen un régimen antirretroviral estable sin evidencia, ya sea actual o previa, de resistencia o fracaso virológico a inhibidores de la transcriptasa inversa no análogos de los nucleósidos (ITINN) e inhibidores de la integrasa (INI). Rekambys estará disponible como suspensión inyectable de liberación prolongada (600 y 900 mg).
Tecartus (CÉLULAS CD3+ AUTÓLOGAS TRANSDUCIDAS ANTI CD-19)
Indicación aprobada: Indicado en el tratamiento de pacientes adultos con linfoma refractario o recurrente de células del manto (MCL) después de dos o más líneas de tratamiento sistémico que incluyan un inhibidor de la tirosina quinasa de Bruton (BTK). Tecartus debe ser prescrito por médicos con experiencia en el tratamiento del linfoma de células del manto. Además, tiene que ser administrado en un centro de tratamiento cualificado por un médico con experiencia en el tratamiento de tumores hematológicos y formado para la administración y manejo de pacientes en tratamiento con Tecartus. Tecartus es una inmunoterapia de células T autólogas que estará disponible como dispersión para perfusión (0,4 – 2 x 108 células).
Trixeo Aerosphere (5 µG FORMOTEROL / 9 µG BROMURO DE GLICOPIRRONIO / 160µG BUDESONIDA)
Indicación aprobada: Trixeo está indicado como tratamiento de mantenimiento en pacientes adultos con enfermedad pulmonar obstructiva crónica (EPOC) de moderada a severa, que no han sido adecuadamente tratados con: Una combinación de corticoides inhalados y agonistas beta2 adrenérgicos de larga duración, una combinación de agonistas beta2 adrenérgicos de larga duración y antagonistas muscarínicos de larga duración. Trixeo estará disponible como suspensión para inhalación en envase a presión.

Fuente: Archivo
Vocabria (CABOTEGRAVIR)
Indicación aprobada: Vocabria inyectable está indicado, en combinación con rilpivirina inyectable, para el tratamiento de la infección por el virus de inmunodeficiencia humano tipo 1 (VIH-1) en adultos con carga viral indetectable (HIV-1 RNA < 50 copias/mL) que siguen un régimen antirretroviral estable sin evidencia, ya sea previa o actual, de resistencia o fracaso virológico con inhibidores de la transcriptasa inversa no análogos de los nucleósidos (ITINN) e inhibidores de la integrasa (INI). Vocabria estará disponible en comprimidos recubiertos con película (30 mg), y en suspensión inyectable de liberación prolongada (400 y 600 mg).
Cambios de especial interés sanitario en medicamentos ya autorizados
Nuevas indicaciones con dictamen positivo para su autorización
Para las indicaciones ya autorizadas se recomienda consultar el texto completo de las mismas en las fichas técnicas disponibles en la web de la AEMPS, dentro de la sección CIMA: Centro de Información Online de Medicamentos de la AEMPS. Se indican los medicamentos que han recibido una opinión del Comité de Medicamentos de Uso Humano (CHMP) de la Agencia Europea de Medicamentos.
Blincyto (BLINATUMOMAB)
Extensión de la indicación (en negrita): Blincyto está indicado en adultos en monoterapia para el tratamiento de leucemia linfoblástica aguda (LLA) de precursores B CD19 positivo en situación refractaria o en recaída. Los pacientes con LLA de precursores B con cromosoma Filadelfia positivo deberán haber fallado al menos a dos inhibidores de tirosina quinasa y no tener otras alternativas de tratamiento. Blincyto está indicado en adultos en monoterapia para el tratamiento de LLA de precursores B con cromosoma Filadelfia negativo, CD19 positivo en primera o segunda remisión completa y con enfermedad mínima residual (EMR) igual o superior al 0,1%. Blincyto está indicado para el tratamiento de pacientes pediátricos a partir de 1 año de edad en monoterapia con LLA de precursores B con cromosoma Filadelfia negativo, CD19 positivo y en situación refractaria o en recaída tras haber recibido al menos dos tratamientos anteriores o en recaída tras haber recibido un trasplante alogénico de células madre hematopoyéticas.
Autor/a: Максим Кукушкин
Fuente: www.publicdomainpictures.net
Dupixent (DUPILUMAB)
Extensión de la indicación (en negrita): Dermatitis atópica. Dupixent está indicado para el tratamiento de la dermatitis atópica de moderada a grave en pacientes adultos y adolescentes a partir de 12 años que son candidatos a tratamiento sistémico. Niños de 6 a 11 años. Duxipent está indicado en el tratamiento de dermatitis atópica severa en niños de 6 a 11 años que son candidatos a tratamiento sistémico. Asma. Dupixent está indicado en adultos y adolescentes a partir de 12 años como tratamiento de mantenimiento adicional para el asma grave con inflamación de tipo 2 caracterizada por eosinófilos elevados en sangre y/o FeNO elevado, que no están adecuadamente controlados con corticosteroides inhalados (CEI) en dosis altas en combinación con otro medicamento para el tratamiento de mantenimiento. Rinosinusitis crónica con poliposis nasal (RSCcPN). Dupixent está indicado como tratamiento adicional a los corticosteroides intranasales para el tratamiento de adultos con RSCcPN grave para quienes la terapia con corticosteroides sistémicos y/o cirugía no proporciona un control adecuado de la enfermedad.
Edistride (DAPAGLIFLOZINA)
Extensión de la indicación (en negrita): Diabetes mellitus tipo 2. Edistride está indicado en adultos para el tratamiento de diabetes mellitus tipo 2 insuficientemente controlada en combinación con la dieta y el ejercicio: monoterapia cuando no se considere adecuado el uso de la metformina debido a intolerancia, en adición a otros medicamentos para el tratamiento de la diabetes tipo 2. Insuficiencia cardiaca. Edistride está indicado en adultos para el tratamiento de insuficiencia cardiaca crónica sintomática con fracción de eyección reducida.
Forxiga (DAPAGLIFLOZINA)
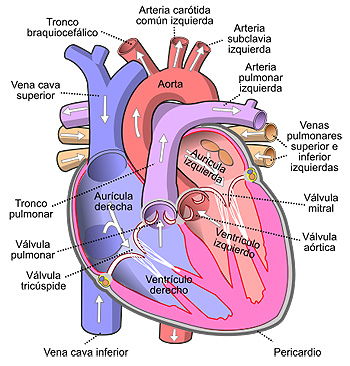
Vista frontal de un corazón humano. Las flechas blancas indican el flujo normal de la sangre
Autor/a de la imagen: Diagram_of_the_human_heart_(cropped)_pt.svg: Rhcastilhos derivative work: Ortisa (talk) - Este archivo deriva de: Diagram of the human heart (cropped) pt.svg
Fuente: Wikipedia
Extensión de la indicación (en negrita): Diabetes mellitus tipo 2. Forxiga está indicado en adultos para el tratamiento de diabetes mellitus tipo 2 insuficientemente controlada en combinación con la dieta y el ejercicio: monoterapia cuando no se considere adecuado el uso de la metformina debido a intolerancia, en adición a otros medicamentos para el tratamiento de la diabetes tipo 2. Diabetes mellitus tipo 1. Forxiga está indicado en adultos para el tratamiento de diabetes mellitus tipo 1 insuficientemente controlada como complemento a la insulina en pacientes con un IMC ≥ 27 kg/m2, cuando la insulina sola no proporciona un control glucémico adecuado a pesar de un tratamiento insulínico óptimo. Insuficiencia cardiaca. Forxiga está indicado en adultos para el tratamiento de insuficiencia cardiaca crónica sintomática con fracción de eyección reducida.
Humira (ADALIMUMAB)
Extensión de la indicación (en negrita): Artritis reumatoide. Humira en combinación con metotrexato, está indicado para: el tratamiento de la artritis reumatoide activa moderada a grave en pacientes adultos, cuando la respuesta a fármacos antirreumáticos modificadores de la enfermedad incluyendo metotrexato haya sido insuficiente; el tratamiento de la artritis reumatoide activa, grave y progresiva en adultos no tratados previamente con metotrexato. Humira puede ser administrado como monoterapia en caso de intolerancia al metotrexato o cuando el tratamiento continuado con metotrexato no sea posible. Psoriasis. Humira está indicado para el tratamiento de la psoriasis en placas crónica de moderada a grave en pacientes adultos que sean candidatos para un tratamiento sistémico.
Hidradenitis supurativa (HS). Humira está indicado para el tratamiento de la hidradenitis supurativa activa (acné inverso) de moderada a grave en pacientes adultos y adolescentes a partir de 12 años de edad con una respuesta insuficiente al tratamiento sistémico convencional de hidradenitis supurativa. Enfermedad de Crohn. Humira está indicado para el tratamiento de la enfermedad de Crohn activa de moderada a grave, en pacientes adultos que no hayan respondido a un tratamiento, completo y adecuado, con corticoesteroides y/o inmunosupresores, o que son intolerantes o tienen contraindicaciones médicas para dichos tratamientos. Enfermedad de Crohn pediátrica. Humira está indicado para el tratamiento de la enfermedad de Crohn activa de moderada a grave en pacientes pediátricos (a partir de los 6 años de edad) que han presentado una respuesta insuficiente al tratamiento convencional incluyendo tratamiento nutricional primario y un corticoesteroide y/o un inmunomodulador, o que son intolerantes o tienen contraindicados dichos tratamientos.
Colitis ulcerosa. Humira está indicado en el tratamiento de la colitis ulcerosa activa, de moderada a grave, en pacientes adultos que han presentado una respuesta inadecuada al tratamiento convencional, incluidos corticosteroides y 6-mercaptopurina (6-MP) o azatioprina (AZA), o que presentan intolerancia o contraindicaciones médicas a dichos tratamientos. Colitis ulcerosa pediátrica. Humira está indicado en el tratamiento de la colitis ulcerosa activa, de moderada a grave, en pacientes pediátricos (de 6 años y mayores) que han presentado una respuesta inadecuada al tratamiento convencional que incluye corticosteroides y/ó 6-mercaptopurina (6-MP) o azatioprina (AZA), o que presentan intolerancia o contraindicaciones médicas a dichos tratamientos. Uveítis. Humira está indicado en el tratamiento de la uveítis no infecciosa intermedia y posterior y panuveítis en pacientes adultos que han presentado una respuesta inadecuada a corticoesteroides, que necesiten disminuir su tratamiento con corticoesteroides, o en aquellos en los que el tratamiento con corticoesteroides sea inapropiado. Uveítis pediátrica. Humira está indicado para el tratamiento de la uveítis pediátrica anterior crónica no infecciosa en pacientes desde los 2 años de edad que han tenido una respuesta inadecuada o son intolerantes a la terapia convencional, o en los que la terapia convencional no es adecuada.
Fuente: Archivo
Opdivo (NIVOLUMAB)
Extensión de la indicación (en negrita): Melanoma. Opdivo en monoterapia o en combinación con ipilimumab está indicado para el tratamiento del melanoma avanzado (no extirpable o metastásico) en adultos. En comparación con nivolumab en monoterapia se ha establecido un aumento de la supervivencia libre de progresión (SLP) y supervivencia global (SG) para la combinación de nivolumab con ipilimumab, solamente en los pacientes con baja expresión de PD L1 en el tumor. Tratamiento adyuvante del melanoma. Opdivo en monoterapia está indicado para el tratamiento adyuvante en adultos con melanoma con afectación de los ganglios linfáticos o enfermedad metastásica que hayan sido sometidos a resección completa.
Cáncer de pulmón no microcítico (CPNM). Opdivo en monoterapia está indicado para el tratamiento del cáncer de pulmón no microcítico, localmente avanzado o metastásico después de quimioterapia previa, en adultos. Carcinoma de células renales (CCR). Opdivo en monoterapia está indicado para el tratamiento del carcinoma de células renales avanzado después de tratamiento previo, en adultos. Opdivo en combinación con ipilimumab está indicado para el tratamiento de primera línea de pacientes adultos con carcinoma de células renales avanzado de riesgo intermedio/alto. Linfoma de Hodgkin clásico (LHc). Opdivo en monoterapia está indicado para el tratamiento de pacientes adultos con linfoma de Hodgkin clásico en recaída o refractario después de un trasplante autólogo de progenitores hematopoyéticos (TAPH) y de tratamiento con brentuximab vedotina.
Cáncer de células escamosas de cabeza y cuello (CCECC). Opdivo en monoterapia está indicado para el tratamiento de pacientes adultos con cáncer de células escamosas de cabeza y cuello recurrente o metastásico que progresa durante o después de un tratamiento basado en platino. Carcinoma urotelial. Opdivo está indicado para el tratamiento de pacientes adultos con carcinoma urotelial irresecable localmente avanzado o metastásico después del fracaso a un tratamiento previo basado en platino. Cáncer de células escamosas de esófago (CCEE). Opdivo está indicado en monoterapia para el tratamiento de pacientes adultos con carcinoma epidermoide o escamoso de esófago irresecable, recurrente o metastásico, después de un tratamiento previo de quimioterapia combinada basado en fluoropirinidinas y platino.
Recarbrio (IMIPENEM 500MG, CILASTATINA SÓDICA EQUIVALENTE A 500 MG DE CILASTATINA, Y RELEBACTAM MONOHIDRATO EQUIVALENTE A 250 MG DE RELEBACTAM)
Unidad de Vigilancia Intensiva Respiratoria (UVIR)
Autoría de la imagen y fuente: Franciso Àvia / Hospital Clínic
Extensión de la indicación (en negrita): Recarbrio está indicado en: el tratamiento de la neumonía hospitalaria, incluyendo la asociada a ventilación mecánica, en adultos. El tratamiento de la bacteriemia que curse en asociación, o que se sospeche que esté asociada, a una neumonía hospitalaria o a una neumonía asociada a ventilación mecánica en adultos. El tratamiento de las infecciones debidas a organismos aerobios Gram-negativos en adultos con opciones de tratamiento limitadas.
Tremfya (GUSELKUMAB)
Extensión de la indicación (en negrita): Psoriasis en placas. Tremfya está indicado para el tratamiento de la psoriasis en placas de moderada a grave en adultos candidatos a tratamiento sistémico. Artritis Psoriásica. Tremfya, en monoterapia o en combinación con metotrexato, está indicado en el tratamiento de la artritis psoriásica activa en pacientes adultos que han tenido una respuesta inadecuada o intolerancia previa a un tratamiento con fármacos antirreumáticos modificadores de la enfermedad (FAME).
Vimpat (LACOSAMIDA)
Extensión de la indicación (en negrita): Vimpat está indicado en monoterapia en las crisis de inicio parcial con o sin generalización secundaria en pacientes adultos, adolescentes y niños a partir de 4 años de edad con epilepsia. Vimpat está indicado como terapia concomitante en: las crisis de inicio parcial con o sin generalización secundaria en pacientes adultos, adolescentes y niños a partir de 4 años de edad con epilepsia; las crisis tónico-clónicas generalizadas primarias en pacientes adultos, adolescentes y niños de 4 años de edad y mayores con epilepsia generalizada idiopática.




