Redacción Farmacosalud.com
En el presente informe se reseñan los medicamentos ya evaluados por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS), considerados de mayor interés para el profesional sanitario. Se trata de opiniones técnicas positivas de la AEMPS correspondientes al mes de julio de 2020 que son previas a la autorización y puesta en el mercado del medicamento, lo que sucederá dentro de algunos meses, informa este organismo mediante un comunicado. Una vez los nuevos fármacos se hayan autorizado, toda la información de cada uno de ellos (desde la ficha técnica y prospecto, hasta sus condiciones de prescripción, uso y disponibilidad real en el mercado) se podrá consultar en la web de la AEMPS, dentro de la sección CIMA: Centro de Información Online de Medicamentos de la AEMPS.
Adakveo (CRIZANLIZUMAB)
Indicación aprobada: Indicado para la prevención de crisis vasooclusivas (CVO) recurrentes en pacientes de 16 años de edad y mayores con enfermedad de las células falciformes. Se puede administrar como tratamiento complementario a hidroxiurea /hidroxicarbamida (HU/HC) ó como monoterapia en pacientes donde el tratamiento con HU/HC es inapropiado o inadecuado. Adakveo estará disponible como concentrado para solución para perfusión (10 mg/ ml).
Autor/a de la imagen: Marco Verch Professional Photographer
Fuente: Flickr / Creative Commons
Arikayce liposomal (AMIKACINA)
Indicación aprobada: Indicado para el tratamiento de la infección pulmonar por micobacterias no tuberculosas causada por el complejo Mycobacterium avium (MAC) en adultos con opciones de tratamiento limitadas y que no presentan fibrosis quística. Arikayce liposomal estará disponible como dispersión para inhalación por nebulizador (590 mg).
Ayvakyt (AVAPRITINIB)
Indicación aprobada: Indicado en monoterapia para el tratamiento de pacientes adultos con tumores del estroma gastrointestinal (GIST, por sus siglas en inglés) no resecables o metastásicos con mutación D842V del receptor alfa del factor de crecimiento derivado de plaquetas (PDGFRA, por sus siglas en inglés). Ayvakyt estará disponible como comprimidos recubiertos con película (100 mg, 200 mg y 300 mg).
Blenrep (BELANTAMAB MAFODOTIN)
Indicación aprobada: Blenrep está indicado en monoterapia para el tratamiento del mieloma múltiple en pacientes adultos que han recibido al menos cuatro tratamientos previos y cuya enfermedad es refractaria al menos a un inhibidor del proteasoma, a un agente inmunomodulador y a un anticuerpo monoclonal anti-CD38, y que hayan presentado progresión de la enfermedad en el último tratamiento. Blenrep estará disponible como polvo para concentrado para solución para perfusión (100 mg).
Calquence (ACALABRUTINIB)
Indicación aprobada: Indicado en: Monoterapia o en combinación con obinutuzumab para el tratamiento de pacientes adultos con leucemia linfocítica crónica (LLC) que no han sido previamente tratados. Monoterapia para el tratamiento de pacientes adultos con leucemia linfocítica crónica (LLC) que han recibido al menos un tratamiento previo. Calquence estará disponible como cápsulas duras (100 mg).
Dapivirine (DAPIVIRINA)
Indicación aprobada: Indicado para reducir el riesgo de transmisión del VIH-1 por vía vaginal a través del coito en mujeres de 18 años de edad y mayores no infectadas por el VIH en combinación con prácticas sexuales más seguras cuando los métodos de prevención oral no se pueden usar o no están disponibles. Dapivirina estará disponible como un sistema de liberación vaginal (25 mg).
Jyseleca (FILGOTINIB)
Indicación aprobada: Indicado para el tratamiento de la artritis reumatoide activa de moderada a grave en pacientes adultos que han tenido una respuesta inadecuada a, o son intolerantes a uno o más fármacos antirreumáticos modificadores de la enfermedad (FARME). Jyseleca debe ser usado como monoterapia o en combinación con metotrexato (MTX). Jyseleca estará disponible como comprimidos recubiertos con película (100 mg y 200 mg).
Zynrelef (BUPIVACAÍNA/MELOXICAM)
Indicación aprobada: Indicado para el tratamiento del dolor postoperatorio somático de heridas quirúrgicas de pequeño a mediano tamaño en adultos. Zynrelef estará disponible como solución de liberación prolongada para heridas (60 mg /1,8 mg, 200 mg /6 mg y 400 mg /12 mg).
Autor/a de la imagen: E. Arandes / www.farmacosalud.com
Fuente: Gentileza del Hospital Sagrat Cor de Barcelona
Biosimilares
Equidacent (BEVACIZUMAB)
Indicación aprobada: Bevacizumab está indicado en combinación con quimioterapia basada en fluoropirimidinas para el tratamiento de pacientes adultos con carcinoma metastásico de colon o recto. Bevacizumab está indicado en combinación con paclitaxel para el tratamiento en primera línea de pacientes adultos con cáncer de mama metastásico. Bevacizumab está indicado, en combinación con capecitabina, para el tratamiento en primera línea de pacientes adultos con cáncer de mama metastásico en los que no se considere apropiado el tratamiento con otras opciones de quimioterapia que incluyan taxanos o antraciclinas. Los pacientes que han recibido regímenes de tratamiento que contienen taxanos y antraciclinas en el entorno adyuvante en los últimos 12 meses deben ser excluidos del tratamiento con Equidacent en combinación con capecitabina. Bevacizumab está indicado, asociado a quimioterapia basada en platino, para el tratamiento en primera línea de pacientes adultos con cáncer de pulmón no microcítico avanzado no resecable, metastásico o recidivante, salvo los que tengan un tipo histológico con predominio de células escamosas.
Bevacizumab, en combinación con erlotinib, está indicado para el tratamiento en primera línea de pacientes adultos con cáncer de pulmón no microcítico no escamoso avanzado no resecable, metastásico o recidivante con mutaciones activadoras del receptor del factor de crecimiento epidérmico (EGFR). Bevacizumab está indicado en combinación con interferón alfa-2a para el tratamiento en primera línea de pacientes adultos con cáncer de células renales avanzado y/o metastásico. Bevacizumab está indicado en combinación con carboplatino y paclitaxel para el tratamiento en primera línea de pacientes adultos con cáncer avanzado (estadios de la Federación Internacional de Ginecología y Obstetricia (FIGO) IIIB, IIIC y IV) de ovario epitelial, trompa de Falopio, o peritoneal primario. Bevacizumab está indicado en combinación con carboplatino y gemcitabina o en combinación con carboplatino y paclitaxel para el tratamiento de pacientes adultos con cáncer de ovario epitelial sensible a platino tras primera recaída, carcinoma de la trompa de Falopio, o carcinoma peritoneal primario que no hayan recibido tratamiento previo con bevacizumab, otros inhibidores VEGF o agentes dirigidos frente a receptores VEGF.
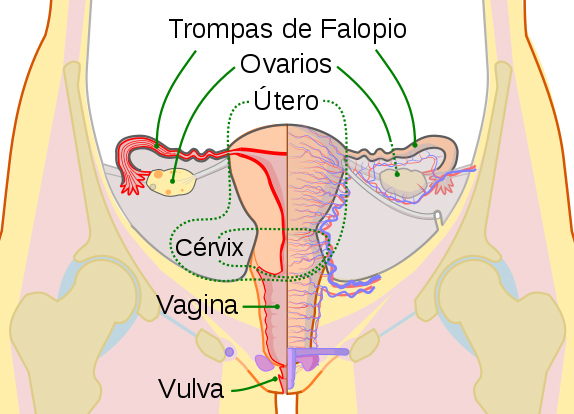
Dibujo esquemático de los órganos reproductores femeninos. Vista frontal
(Imagen modificada) Autor/a de la imagen original: KES47 - File:Scheme female reproductive system-en.svg
Fuente: Wikipedia
Bevacizumab en combinación con paclitaxel y cisplatino o, alternativamente, paclitaxel y topotecan en pacientes que no puedan recibir terapia con platino, está indicado para el tratamiento de pacientes adultos con carcinoma de cérvix persistente, recurrente o metastásico. Equidacent estará disponible como concentrado para solución para perfusión (25 mg/ml).
Cambios de especial interés sanitario en medicamentos ya autorizados
Nuevas indicaciones con dictamen positivo para su autorización
Para las indicaciones ya autorizadas se recomienda consultar el texto completo de las mismas en las fichas técnicas disponibles en la web de la AEMPS, dentro de la sección CIMA: Centro de Información Online de Medicamentos de la AEMPS.
Crysvita (BUROSUMAB)
Extensión de la indicación (en negrita): Crysvita está indicado para el tratamiento de la hipofosfatemia ligada al cromosoma X, en niños y adolescentes de 1 año a 17 años de edad con signos radiográficos de enfermedad ósea, y en adultos.
HyQvia (INMUNOGLOBULINA HUMANA NORMAL)
Extensión de la indicación (en negrita): Terapia de sustitución en adultos, niños y adolescentes (0-18 años) con: Síndromes de inmunodeficiencia primaria con alteración de la producción de anticuerpos. Inmunodeficiencias secundarias (IDS) en pacientes que sufren infecciones graves o recurrentes, tratamiento antimicrobiano ineficaz y fracaso comprobado de anticuerpos específicos (PSAF, por sus siglas en inglés)* o concentración de IgG en suero de <4 g/l. *PSAF= incapacidad de lograr al menos un aumento de 2 veces en el título de anticuerpos IgG frente a polisacáridos neumocócicos y vacunas antigénicas polipeptídicas.
Autor/a: stux
Fuente: Pixabay (free photo)
Imbruvica (IBRUTINIB)
Extensión de la indicación (en negrita): Imbruvica en monoterapia está indicado para el tratamiento de pacientes adultos con linfoma de células del manto (LCM) en recaída o refractario. Imbruvica en monoterapia o en combinación con rituximab u obinutuzumab está indicado para el tratamiento de pacientes adultos con leucemia linfocítica crónica (LLC) que no han sido previamente tratados. Imbruvica en monoterapia o en combinación con bendamustina y rituximab (BR) está indicado para el tratamiento de pacientes adultos con LLC que han recibido al menos un tratamiento previo. Imbruvica en monoterapia está indicado para el tratamiento de pacientes adultos con macroglobulinemia de Waldenström (MW) que han recibido al menos un tratamiento previo, o en tratamiento de primera línea en pacientes en los que la inmunoquimioterapia no se considera apropiada. Imbruvica en combinación con rituximab está indicado para el tratamiento de pacientes adultos con MW.
Imfinzi (DURVALUMAB)
Extensión de la indicación (en negrita): Imfinzi en monoterapia está indicado en adultos para el tratamiento del cáncer de pulmón no microcítico (CPNM) localmente avanzado, no resecable, cuyos tumores expresan PD-L1 ≥ 1% en las células tumorales y cuya enfermedad no haya presentado progresión después de quimiorradioterapia basada en platino. Imfinzi en combinación con etopósido y carboplatino o cisplatino está indicado para el tratamiento de primera línea de pacientes adultos con cáncer de pulmón microcítico en estadío extendido (CPM-EE).
Kalydeco (IVACAFTOR)
Extensión de la indicación (en negrita): Kalydeco comprimidos está indicado: como monoterapia para el tratamiento de adultos, adolescentes y niños de 6 años o mayores con un peso de 25 kg o más con fibrosis quística (FQ) y una mutación R117H en el gen CFTR o una de las siguientes mutaciones de apertura del canal (clase III) en el gen regulador de la conductancia transmembrana de la fibrosis quística (CFTR): G551D, G1244E, G1349D, G178R, G551S, S1251N, S1255P, S549N o S549R.

Autor/a de la imagen: Enric Arandes
Fuente: E. Arandes / www.farmacosalud.com
En un esquema combinado con comprimidos de 100 mg de tezacaftor/150 mg de ivacaftor para el tratamiento de adultos y adolescentes de 12 años de edad o mayores con fibrosis quística (FQ) homocigóticos para la mutación F508del o heterocigóticos para la mutación F508del con una de las siguientes mutaciones en el gen regulador de la conductancia transmembrana de la fibrosis quística (CFTR): P67L, R117C, L206W, R352Q, A455E, D579G, 711+3A→G, S945L, S977F, R1070W, D1152H, 2789+5G→A, 3272-26A→G y 3849+10kbC→T. En un esquema combinado con ivacaftor 75 mg/ tezacaftor 50 mg/ elexacaftor 100 mg comprimidos para el tratamiento de adultos y adolescentes de 12 años de edad o mayores con FQ homocigóticos para la mutación F508del en el gen CFTR, o heterocigotos para F508del en el gen CFTR con una mutación de función mínima (MF, por sus siglas en inglés).
Latuda (LURASIDONA)
Extensión de la indicación (en negrita): Latuda está indicado para el tratamiento de la esquizofrenia en adultos y adolescentes de 13 años de edad y mayores.
NovoThirteen (CATRIDECACOG)
Extensión de la indicación (en negrita): Profilaxis a largo plazo de hemorragias en pacientes con deficiencia congénita de la subunidad A del factor XIII. Tratamiento de los episodios de sangrado durante la profilaxis de rutina. NovoThirteen se puede utilizar en todos los grupos de edad.
Prezista (DARUNAVIR)
Extensión de la indicación (en negrita): Prezista, administrado de forma conjunta con cobicistat, está indicado para el tratamiento de la infección por el Virus de la Inmunodeficiencia Humana (VIH-1) en combinación con otros medicamentos antirretrovirales en adultos y adolescentes (12 años de edad y mayores, con un peso corporal de al menos 40 kg de peso).
Shingrix (vacuna frente al herpes zóster recombinante, adyuvada)
Extensión de la indicación (en negrita): Shingrix está indicado para la prevención del herpes zóster (HZ) y la neuralgia postherpética (NPH), en: Adultos de 50 años de edad y mayores; Adultos de 18 años de edad y mayores con mayor riesgo de presentar herpes zóster.




