Redacción Farmacosalud.com
La Comisión Europea ha concedido la autorización de comercialización para Vargatef® (nintedanib), de la compañía Boehringer Ingelheim, en combinación con docetaxel, para pacientes adultos con cáncer de pulmón no microcítico (CPNM) localmente avanzado, recurrente o metastásico con histología de adenocarcinoma después de la quimioterapia de primera línea. Nintedanib es un tratamiento oral administrado dos veces al día, han informado desde dicha compañía. “Esta autorización proporciona una nueva opción largamente reclamada para pacientes con adenocarcinoma de pulmón avanzado en el marco de una terapia de segunda línea,” comenta el Dr. Martin Reck, jefe de Departamento de Oncología Torácica, Clínica de Neumología Grosshansdorf, Alemania, e investigador principal del estudio LUME-Lung 1. “Los datos clínicos muestran que los pacientes tratados con nintedanib más docetaxel sobreviven más de un año sin empeorar su calidad de vida en comparación con docetaxel en monoterapia”.
El adenocarcinoma es el tipo más frecuente de cáncer de pulmón y en la mayoría de los pacientes se diagnostica cuando ya se halla en una fase avanzada. La enfermedad progresa en la mayoría de casos durante o después de la quimioterapia de primera línea, por lo que existe una gran demanda no satisfecha de nuevos tratamientos de segunda línea eficaces. El cáncer de pulmón es una enfermedad con altos niveles de mortalidad. Con unos 1,6 millones de nuevos casos cada año, suma cerca de 1,38 millones de muertes anualmente. El año 2012, se diagnosticaron en España 26.745 nuevos casos de cáncer de pulmón, cerca del 12,5% del total de diagnósticos de cáncer. En el mismo período de tiempo, fallecieron a causa de la enfermedad 21.118 personas. La agencia Internacional para la Investigación del Cáncer prevé que el número de fallecimientos por cáncer de pulmón seguirá aumentando en todo el mundo y superará los 2,3 millones en el año 2030.
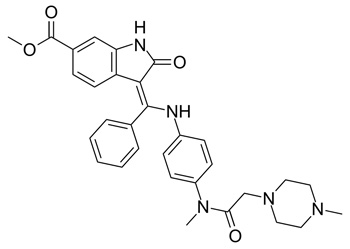
Fórmula estructural de Nintedanib
Autor/a de la imagen: Ed (Edgar181)
Fuente: Wikipedia
Un triple inhibidor triple oral angiocinasa
La autorización de nintedanib, un triple inhibidor angiocinasa, se basa en los resultados del estudio clínico LUME-Lung 1 en el que participaron 1.314 pacientes con cáncer de pulmón después de haber recibido quimioterapia en primera línea. Los datos del estudio, publicados en ‘Lancet Oncology’, muestran que, en comparación con docetaxel en monoterapia, la combinación de nintedanib y docetaxel aumenta significativamente la media de supervivencia global de 10,3 a 12,6 meses (p=0,0359; HR: 0,83) en pacientes con adenocarcinoma. Una cuarta parte de estos pacientes sobrevive durante dos años o más (supervivencia a los 24 meses: nintedanib más docetaxel, 25,7% de los pacientes frente a placebo más docetaxel, 19,1% de los pacientes, p=0,0359; HR: 0,83).
Por otro lado, nintedanib muestra un perfil de acontecimientos adversos que no empeora la calidad de vida global relacionada con la salud de los pacientes. Además, la adición a docetaxel no aumenta significativamente las tasas de interrupción del tratamiento en comparación con docetaxel en monoterapia. Nintedanib es un triple inhibidor triple oral angiocinasa que inhibe simultáneamente las vías de señalización de los receptores del factor de crecimiento del endotelio vascular (VEGFR), los receptores del factor de crecimiento derivado de plaquetas (PDGFR) y los receptores del factor de crecimiento de fibroblastos (FGFR). Hay evidencias científicas de que estas tres familias de receptores angiocinasa desempeñan un papel importante no sólo en la angiogénesis, sino también en el crecimiento tumoral y las metástasis.
El fármaco, en investigación para otro tipo de tumores
Nintedanib se investiga en pacientes con diversos tumores sólidos, entre ellos estudios fase III en cáncer colorrectal (resistente al tratamiento convencional) y cáncer de ovario, y también en estudios fase II en mesotelioma, cáncer de riñón (carcinoma renal) y cáncer hepático (carcinoma hepático). En Europa, Nintedanib ha recibido recientemente la opinión positiva del CHMP para el tratamiento de la Fibrosis Pulmonar Idiopática (FPI) y en Estados Unidos, la Food and Drug Administration (FDA) ya lo ha autorizado con el nombre de OFEV® para el tratamiento oral de la FPI.




