Redacción Farmacosalud.com
La acumulación de células senescentes desempeña un papel importante en la patogénesis del cáncer y otras enfermedades. Sin embargo, los fármacos senolíticos (dirigidos a la eliminación de las células senescentes) presentan importantes toxicidades que limitan sus ventajas terapéuticas. Ahora, una nueva investigación internacional en la que han participado investigadores pertenecientes al CIBER-BBN, la Universitat Politècnica de València (UPV) y el Centro de Investigación Príncipe Felipe, en colaboración con la Universidad de Cambridge, acaba de probar la eficacia de un nuevo fármaco conjugado, Nav-Gal, que permite eliminar las células senescentes de manera selectiva minimizando el efecto en células sanas y reduce la toxicidad de esta terapia. El uso de este fármaco en combinación con quimioterapia podría confirmarse como una estrategia prometedora en el tratamiento del cáncer. Los prometedores resultados de esta investigación se han publicado en la revista ‘Aging Cell’1.
Célula senescente
Fuente: UPV
Difusión: CIBER-BBN / CIBER (Consorcio Centro de Investigación Biomédica en Red, M.P.)
La senescencia es una respuesta al daño y el estrés en la célula que se caracteriza por la detención del ciclo celular. Al envejecer, la célula deja de dividirse de manera permanente, previniendo la propagación de células dañadas o disfuncionales. Pero, con el tiempo, grandes cantidades de células senescentes se acumulan en los tejidos, contribuyendo a la aparición y progresión de múltiples patologías como la diabetes, las enfermedades cardiovasculares, la fibrosis pulmonar, trastornos neurológicos o cáncer, entre otras. Además, en el caso del cáncer, muchas quimioterapias promueven la senescencia celular, y esta acumulación senescente a causa de los tratamientos se ha relacionado con un impulso de la tumorigénesis, asociándose a metástasis y la reaparición del tumor en distintos tipos de carcinomas.
Por ello, la búsqueda de nuevos fármacos que permitan eliminar las células senescentes inducidas por los tratamientos oncológicos es una cuestión clave para garantizar la total erradicación del tumor y prevenir la reaparición. En este camino, los medicamentos senolíticos (compuestos que matan las células senescentes por distintos mecanismos) son una alternativa terapéutica prometedora en oncología y para el tratamiento de otras enfermedades relacionadas con la acumulación de estas células. Sin embargo, los senolíticos presentan hasta ahora una baja especificidad, al dañar también células sanas, e importantes toxicidades, lo que reduce sus ventajas terapéuticas.
Evitar ‘daños colaterales’
En este nuevo estudio, los investigadores pertenecientes al CIBER-BBN, la Universitat Politècnica de València (UPV) y el Centro de Investigación Príncipe Felipe, en colaboración con investigadores del CRUK de la Universidad de Cambridge, trabajaron en el diseño de un senolítico de segunda generación más específico y menos tóxico. Para ello se centraron en Navitoclax, un fármaco validado en modelos preclínicos que mostró una alta capacidad de destrucción de las células senescentes, modificándolo con una galactosa acetilada. El nuevo compuesto, llamado Nav-Gal, dio como resultado un fármaco con actividad senolítica selectiva de amplio alcance, que induce la muerte de las células senescentes al tiempo que preserva la actividad de las células sanas.

Los investigadores Beatriz Lozano y Ramón Martínez Máñez
Fuente: UPV
Difusión: CIBER-BBN / CIBER (Consorcio Centro de Investigación Biomédica en Red, M.P.)
“En definitiva, proponemos la conjugación galactosa con ciertos fármacos como una metodología versátil para desarrollar profármacos de segunda generación con alta actividad senolítica y toxicidad reducida”, explica Ramón Martínez Máñez, miembro del Instituto de Reconocimiento Molecular y Desarrollo Tecnológica (IDM) de la Universitat Politècnica de València y director científico del CIBER-BBN y uno de los coordinadores del estudio.
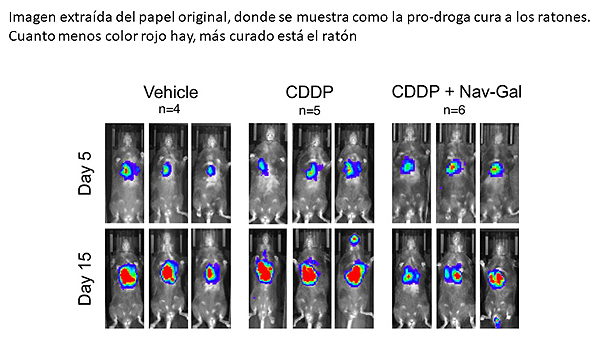
Los investigadores probaron este fármaco en combinación con quimioterapia (cisplatino) en células humanas de cáncer de pulmón, probando que el tratamiento con cisplatino y Nav-Gal dio como resultado la eliminación de células senescentes de cáncer de pulmón y redujo significativamente el crecimiento tumoral. “Este estudio proporciona evidencia de la potencial aplicación clínica de combinar quimioterapias inductoras de senescencia con senoterapias en cáncer”, comenta Daniel Muñoz Espín, del CRUK Early Detection Programme de la Universidad de Cambridge. Además, el compuesto Nav-Gal redujo la toxicidad sobre las plaquetas y la trombocitopenia (reducción de la circulación de plaquetas en el torrente sanguíneo) causadas por su fármaco predecesor, el Navitoclax.
Difusión: CIBER-BBN / CIBER (Consorcio Centro de Investigación Biomédica en Red, M.P.)
Descubren un gen potenciador del carcinoma escamoso de pulmón
Por otra parte, investigadores del Cima Universidad de Navarra han descubierto un gen de ARN largo no codificante que promueve la multiplicación celular en el carcinoma escamoso de pulmón, el cáncer pulmonar más frecuente en España. El estudio ha demostrado que este gen, al que han llamado SWINGN, está expresado en las células tumorales más proliferativas y su acción provoca que estas células cancerígenas se vuelvan más agresivas. La investigación está publicada en la revista científica ‘Nature Communications’2.
Los científicos se han basado en el estudio de ARNs largos no codificantes (lncRNAs, por sus siglas en inglés) y en su interacción con la proteína SMARCB1, un importante regulador epigenético. “Al observar esta relación hemos descubierto SWINGN, un lncRNA que se asocia con SMARCB1 exclusivamente en células que proliferan activamente, ejerciendo un papel pro-oncogénico en algunos tipos de tumores”, señala Maite Huarte, investigadora del grupo de ARNs largos no-codificantes y regulación del genoma del cáncer del Cima y responsabe de trabajo.
Impacto de SWINGN en varios tipos de cáncer
Al analizar el mecanismo por el cual SWINGN promueve la oncogénesis, los investigadores observaron que induce la activación de GAS6, un importante oncogén sobreexpresado en muchos cánceres. “Esta observación del laboratorio ha sido confirmada analizando varias muestras de tumores. Hemos detectado una correlación positiva entre la expresión de SWINGN y GAS6 principalmente en el carcinoma escamoso de pulmón, obteniéndose resultados similares en el carcinoma invasivo de mama, mientras que no hubo correlación en el adenocarcinoma de colon”, explica Elena Grossi, investigadora del grupo de la Dra. Huarte y primera autora del artículo. A su vez, añade la investigadora, “SWINGN no solo activa la expresión de GAS6, sino de un grupo de genes que conjuntamente promueven la mayor proliferación de las células tumorales”.

Dra. Maite Huarte
Fuente: CIMA Universidad de Navarra
Este estudio presenta a SWINGN como una potencial diana terapéutica en algunos tipos tumorales y “desvela un modo de acción probablemente común a otros lncRNAs. Además de avanzar en esta investigación, el siguiente paso es encontrar un fármaco capaz de inhibir este gen para que las células cancerígenas pierdan su capacidad tumoral”, indica Huarte.
Referencias
1. González‐Gualda E, Pàez‐Ribes M, Lozano‐Torres B, Macias D, Wilson JR, González‐López C, et al. Galacto‐conjugation of Navitoclax as an efficient strategy to increase senolytic specificity and reduce platelet toxicity. Aging Cell. 2020;19:e13142.
2. Grossi, E., Raimondi, I., Goñi, E. et al. A lncRNA-SWI/SNF complex crosstalk controls transcriptional activation at specific promoter regions. Nat Commun. 2020;11, 936.




