Redacción Farmacosalud.com
La compañía Novartis ha anunciado que el Comité de Medicamentos de Uso Humano (CHMP) de la Agencia Europea del Medicamento (EMA) ha adoptado una opinión positiva recomendando la aprobación de Rydapt® (midostaurina) para tratar a adultos con leucemia mieloide aguda (LMA) recién diagnosticada con mutación en FLT3. De aprobarse por la Comisión Europea (CE), Rydapt® estará indicado en combinación con inducción estándar de daunorrubicina y citarabina y quimioterapia de consolidación con altas dosis de citarabina y, para pacientes en respuesta completa, seguida de monoterapia de mantenimiento con Rydapt®, para pacientes adultos con LMA recién diagnosticada con mutación en FLT3. También se recomendó la aprobación de Rydapt® en monoterapia para tratar a pacientes adultos con mastocitosis sistémica agresiva (MSA), mastocitosis sistémica con neoplasia hematológica asociada (MS-NHA) o leucemia mastocítica.
De aprobarse, Rydapt® será el primer tratamiento dirigido disponible en la Unión Europea (UE) para pacientes con LMA con mutación en FLT3 recién diagnosticada y pacientes con mastocitosis sistémica (MS) avanzada. La opinión va precedida de la reciente aprobación por la Food and Drug Administration (FDA) de los EE.UU. en 2017 de Rydapt® para LMA con mutación en FLT3 y MS avanzada el 28 de abril y la aprobación de Swissmedic el 4 de mayo.
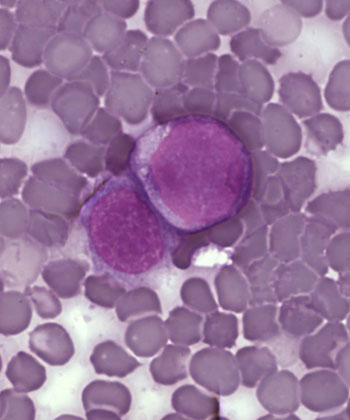
Células leucémicas
Autor/a: See Source
Fuente: A Surprising New Path to Tumor Development. PLoS Biol 3/12/2005: e433 doi:10.1371/journal.pbio.0030433 / Wikipedia / Ayacop
Dos trastornos sanguíneos considerados raros
La LMA es un cáncer raro y agresivo de la sangre y la médula ósea[2]. En la UE, se estima que hay alrededor de 18.000 casos nuevos de LMA al año[3]. Alrededor de un tercio de los pacientes con LMA tendrá una mutación en el gen FLT3[4]. La tirosina quinasa 3 similar a FMS (FLT3) es un tipo de receptor de la superficie celular que participa en el aumento de ciertas células de la sangre[5] y la mutación del gen FLT3 puede provocar que la enfermedad avance más deprisa, mayores tasas de recaída y menores tasas de supervivencia que otros tipos de LMA[4-6]. Antes de la aprobación de Rydapt® en EE.UU., la estrategia terapéutica contra la LMA había permanecido prácticamente inalterada durante más de 25 años[7,8].
La MS avanzada es un trastorno raro de la sangre que se caracteriza por la proliferación y acumulación incontrolada de mastocitos (mediadores de respuestas alérgicas) en uno o más órganos[9]. En la MS avanzada, los mastocitos se acumulan en cantidades tan grandes que pueden empezar a causar daños orgánicos[9]. La mediana de la supervivencia global es actualmente de menos de seis meses para leucemia mastocítica[10], dos años para SM-AHN y 3,5 años para MSA[11].
Estudios RATIFY y CPKC412D2201
Normalmente la CE sigue la recomendación del CHMP y emite su decisión final en un plazo de dos o tres meses. La decisión será aplicable a los 28 estados miembros de la UE, más Islandia, Liechtenstein y Noruega. La opinión positiva se basa en el ensayo clínico de Fase III RATIFY (CALGB 10603 [Alliance]), que se realizó en colaboración con la Alliance for Clinical Trials in Oncology y 13 grupos colaborativos internacionales. En el ensayo, los pacientes recién diagnosticados con mutación en FLT3 que recibieron Rydapt® más quimioterapia estándar experimentaron una mejora significativa en la supervivencia global con una reducción del 23% en el riesgo de muerte frente a placebo más quimioterapia estándar, con una mediana de supervivencia global de 74,7 meses y 25,6 meses, respectivamente (hazard ratio [HR] = 0,77, IC 95%, 0,63, 0,95; unilateral p=0,0078)[1]. Recientemente se publicaron los datos completos del ensayo RATIFY en el New England Journal of Medicine (NEJM)[12].
La supervivencia libre de acontecimientos (SLA; los acontecimientos se definieron como remisión incompleta a los 60 días del inicio de la terapia de inducción, recaída o muerte) fue significativamente mayor para Rydapt® más quimioterapia frente a placebo más quimioterapia estándar (mediana de 8,2 meses frente a 3,0 meses, HR = 0,78, IC 95% 0,66, 0,93 y unilateral p=0,0024). RATIFY es el mayor ensayo clínico mundial hasta la fecha en LMA con mutación en FLT3 recién diagnosticada, se examinó la mutación en FLT3 en 3.277 pacientes con LMA y se reclutó a 717 pacientes[1]. En el ensayo de Fase III de LMA RATIFY, las reacciones adversas más frecuentes (incidencia igual o superior al 30%) en el grupo de Rydapt® más quimioterapia estándar fueron neutropenia febril, náuseas, dermatitis exfoliativa, vómitos, dolor de cabeza, petequias (pequeñas manchas rojizas) y pirexia. La reacción adversa no hematológica de grado 3/4 más frecuente fue la neutropenia febril[1].

Fuente: www.farmacosalud.com / IMAGEN DE ARCHIVO
Gentileza del Centro Nacional de Microbiología. Instituto de Salud Carlos III de Madrid
La recomendación en MS avanzada se basa en dos ensayos multicéntricos abiertos de grupo único, incluyendo un estudio de Fase II (CPKC412D2201), que ha sido el mayor ensayo prospectivo realizado en este raro trastorno. La eficacia de Rydapt® se estableció usando criterios Valent modificados, y los pacientes demostraron una tasa de respuesta global, definida como una respuesta global o parcial, del 59,6% (intervalo de confianza [IC] 95%, 48,6, 69,8%). La eficacia también se evaluó en un análisis post-hoc usando los criterios de consenso de International Working Group-Myeloproliferative Neoplasms Research and Treatment-European Competence Network on Mastocytosis (IWG-MRT-ECNM) de 2013 (n=113). Esta evaluación estimó una tasa de respuesta global del 28,3% (IC 95%, 20,2, 37,6)[1]. En MS avanzada, las reacciones adversas más frecuentes fueron náuseas, vómitos, diarrea, edema periférico y cansancio. Las reacciones adversas de grado 3/4 más frecuentes fueron fatiga, sepsis, neumonía, neutropenia febril y diarrea[1].
La LMA es la leucemia aguda más común en adultos; La LMA representa alrededor del 25% de todas las leucemias en adultos del mundo; la mayor tasa de incidencia se da en Estados Unidos, Europa y Australia[13]. También cuenta con el índice de supervivencia más bajo de todas las leucemias en adultos del mundo[13]. La LMA impide que los glóbulos blancos maduren, provocando una acumulación de ‘blastos’ que no deja espacio para glóbulos normales[2]. En muchos casos de LMA se dan mutaciones de genes específicos[4], así como las pruebas genéticas para detectar mutaciones en pacientes con LMA de reciente diagnóstico pueden ayudar a determinar el pronóstico y las posibles estrategias de tratamiento[14].
En la MS avanzada, el desarrollo incontrolado de mastocitos neoplásicos provoca daños orgánicos (como disfunción hepática), hemogramas bajos y pérdida de peso[9]. Los pacientes también sufren síntomas sistémicos debilitantes como pruritos (picor severo de la piel), causados por mastocitos que liberan mediadores inflamatorios, como histamina, en la sangre[9]. La proliferación incontrolada de mastocitos en muchas personas se debe a una mutación del gen KIT (la mutación más común, la sustitución en el codón D816V, que se produce en aproximadamente en el 90% de los pacientes)[15]. La mutación del gen KIT provoca la activación de la enzima KIT, que activa la proliferación anormal y la supervivencia de los mastocitos[16].
Un inhibidor oral, y también multidiana de múltiples quinasas
Rydapt® (midostaurina) es un inhibidor oral, multidiana de múltiples quinasas, incluyendo FLT3 y KIT, que ayudan a regular muchos procesos celulares esenciales, interrumpiendo la capacidad de las células cancerígenas de proliferar y multiplicarse[17]. En los EE.UU., Rydapt® ha sido aprobado por la FDA para el tratamiento de adultos con LMA recién diagnosticada positiva para la mutación en tirosina quinasa 3 similar a FMS (FLT3 +) detectada por una prueba aprobada por la FDA, en combinación con quimioterapia de inducción estándar con citarabina y daunorrubicina y consolidación con citarabina[17]. Rydapt® no está indicado en los EE.UU. como terapia de inducción con un solo agente para el tratamiento de pacientes con LMA. Para una descripción de la experiencia con el tratamiento con un solo agente más allá de la inducción y consolidación, los profesionales sanitarios en los EE.UU. se deben dirigir a la sección de estudios clínicos de la información de prescripción de EE.UU. (14.1)[17]. Rydapt® también ha sido aprobado para tratar a pacientes adultos con mastocitosis sistémica agresiva (MSA), mastocitosis sistémica con neoplasia hematológica asociada (MS-NHA) o leucemia mastocítica, conocidos colectivamente como mastocitosis sistémica (MS) avanzada[17].

Fuente: Archivo
Rydapt® también está aprobado en Suiza para su uso en combinación con quimioterapia estándar de inducción y consolidación, seguido de monoterapia de mantenimiento para el tratamiento de pacientes adultos recién diagnosticados de LMA con mutación de FLT3. Rydapt® está indicado en Suiza para el tratamiento en pacientes adultos con MS avanzada. Las indicaciones varían según el país y no todas las indicaciones están disponibles en todos los países. El perfil de seguridad y eficacia de Rydapt® aún no se ha establecido fuera de las indicaciones aprobadas. Debido a la incertidumbre de los ensayos clínicos, no hay garantía de que Rydapt® estará comercialmente disponible para indicaciones adicionales en cualquier lugar del mundo.
Información de seguridad importante de Rydapt®
Los pacientes alérgicos a la midostaurina o a cualquiera de los ingredientes de Rydapt® no deben tomar Rydapt®. En caso de que un paciente que tome Rydapt® desarrolle signos de reacción alérgica, debe informar a su médico de inmediato. Los signos de una reacción alérgica incluyen dificultad respiratoria, sofocos, dolor en el pecho, opresión en la garganta e inflamación en los labios, boca o garganta. Rydapt® no se debe tomar durante el embarazo, dado que puede provocar daños al feto. Se deben realizar pruebas de embarazo en mujeres en edad fértil. Se deben aplicar métodos anticonceptivos efectivos durante el tratamiento y, como mínimo, durante los cuatro meses posteriores a la interrupción de Rydapt®. En caso de que una paciente se quedara embarazada o que sospechara que lo pudiera estar, debe consultar con su médico de inmediato. Se debe evitar la lactancia materna durante el tratamiento con Rydapt® y durante un mínimo de cuatro meses posteriores a la dosis final. Los hombres que tomen Rydapt® y que tengan parejas que pudieran quedarse embarazadas, deben utilizar métodos anticonceptivos efectivos durante el tratamiento con Rydapt® y, como mínimo, durante los cuatro meses posteriores a la última dosis de Rydapt®. Rydapt® puede provocar problemas de fertilidad en mujeres y hombres, que pueden afectar a su capacidad de tener hijos.
Rydapt® puede causar problemas pulmonares que pueden provocar la muerte. Los pacientes que tomen Rydapt® que desarrollen o empeoren tos, dificultad respiratoria o dolor de pecho, deben consultar con su médico de inmediato. Podría tratarse de signos de problemas pulmonares graves.
Autor/a: OpenClipart-Vectors
Fuente: Pixabay / Public Domain
Los efectos secundarios habituales documentados durante el tratamiento con Rydapt® en la LMA incluyen niveles bajos de glóbulos blancos con fiebre (neutropenia febril), náuseas, irritación, dolor o úlceras en el interior de la boca (mucositis), vómitos, dolor de cabeza, hematomas, dolor muscular u óseo, hemorragias nasales, infección relacionada con el dispositivo, niveles elevados de glucosa en sangre (hiperglucemia) e infecciones del tracto respiratorio superior. Los efectos secundarios habituales documentados durante el tratamiento para la MS avanzada, MS-NHA o la leucemia mastocítica incluyeron náuseas, vómitos, diarrea, inflamación de las manos, pies o tobillos, dolor muscular u óseo, dolor en la zona estomacal, cansancio, infección en el tracto respiratorio superior, estreñimiento, fiebre, dolor de cabeza o problemas respiratorios.
En caso de que los efectos secundarios como náuseas, vómitos o diarrea empeoren o no desaparezcan durante el tratamiento con Rydapt®, los pacientes deben contactar con su médico. Dependiendo del efecto secundario y/o de la gravedad del efecto secundario que se produzca, su médico puede reducir la dosis, interrumpirla temporalmente o detener definitivamente el tratamiento con Rydapt®. Los pacientes deberán informar a sus médicos los medicamentos que toman, incluyendo los medicamentos por prescripción y de venta libre, así como vitaminas y complementos homeopáticos. Rydapt® puede afectar a la forma en la que actúan estos medicamentos o bien dichos medicamentos pueden afectar a la forma de actuar de Rydapt®.
Referencias
1. Novartis data on file.
2. National Institutes of Health (NIH) National Cancer Institute (NCI). Adult Acute Myeloid Leukemia Treatment (PDQ®) http://www.cancer.gov/types/leukemia/patient/adult-aml-treatment-pdq. Accessed June 19, 2017.
3. Visser O, Trama A, Maynadié M, et al. (RARECARE Working Group). Incidence, survival and prevalence of myeloid malignancies in Europe. Eur J Cancer. 2012;48(17):3257-3266.
4. Patel JP, Gönen M, Figueroa ME, et al. Prognostic relevance of integrated genetic profiling in acute myeloid leukemia. N Engl J Med. 2012; 22;366(12):1079-1089.
5. Gilliland DG, Griffin JD. The roles of FLT3 in hematopoiesis and leukemia. Blood. 2002;100(5):1532-1542.
6. Yanada M, Matsuo K, Suzuki T, et al. Prognostic significance of FLT3 internal tandem duplication and tyrosine kinase domain mutations for acute myeloid leukemia: a meta-analysis. Leukemia. 2005;19(8):1345–1349.
7. Schiller GJ. High-risk acute myelogenous leukemia: treatment today ... and tomorrow. Hematology Am Soc Hematol Educ Program. 2013; 2013:201-208.
8. Lin TL, Levy MY. Acute myeloid leukemia: focus on novel therapeutic strategies. Clin Med Insights Oncol. 2012;6:205-217.
9. Arock M, Akin C, Hermine O, et al. Current treatment options in patients with mastocytosis: status in 2015 and future perspectives. Eur J Haematology. 2015;94(6):474-494.
10. Georgin-Lavialle S, Lhermitte L, Dubreuil P, et al. Mast cell leukemia. Blood. 2013;121:1285-1295.
11. Lim KH, Tefferi A, Lasho T, et al. Systemic mastocytosis in 342 consecutive adults: survival studies and prognostic factors. Blood. 2009;113:5727-5736.
12. Stone RM, Mandrekar SJ, Sanford BL, et al. Midostaurin plus Chemotherapy for Acute Myeloid Leukemia with a FLT3 Mutation. N Engl J Med. 2017 June 23. doi: 10.1056/NEJMoa1614359. [Epub ahead of print].
13. Deschler B, Lübbert M. Acute myeloid leukemia: epidemiology and etiology. Cancer. 2006;107(9):2009-2107.
14. Döhner H, Estey E, Grimwade D, et al. Diagnosis and management of AML in adults: 2017 ELN recommendations from an international expert panel. Blood. 2017;129(4):424-447.
15. Garcia-Montero AC, Jara-Acevedo M, Teodosi C, et al. KIT mutation in mast cells and other bone marrow hematopoietic cell lineages in systemic mast cell disorders: a prospective study of the Spanish Network on Mastocytosis (REMA) in a series of 113 patients. Blood. 2006;108(7):2366-2372.
16. Verstovsek S. Advanced systemic mastocytosis: the impact of KIT mutations in diagnosis, treatment, and progression. Eur J Haematology. 2013;90(2):89-98.
17. Rydapt [prescribing information]. East Hanover, NJ: Novartis Pharmaceuticals Corp, 2017.




