Redacción Farmacosalud.com
La compañía GSK ha anunciado el lanzamiento de Nucala® (mepolizumab) en España como tratamiento complementario de mantenimiento para pacientes a partir de los 18 años de edad con asma grave eosinofílica refractaria. El fármaco fue aprobado por la Agencia Europea del Medicamento (EMA por sus siglas en inglés) en diciembre de 2015. Nucala® es la primera y única terapia biológica aprobada en España que se une a la interleucina 5 (IL-5), que tiene un papel importante en la regulación de la función de los eosinófilos, unas células inflamatorias conocidas por su importancia en el asma. Se administra de manera subcutánea en dosis fijas de 100mg cada cuatro semanas como tratamiento complementario a la medicación habitual del paciente, que habitualmente incluye corticosteroides inhalados a dosis altas además de los tratamientos de mantenimiento adicionales con o sin corticosteroides orales.[1]

Fuente: GSK / Berbés Asociados
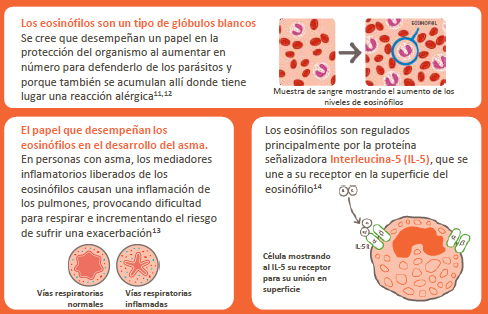
Nucala® es un anticuerpo monoclonal que se une a IL-5, impidiendo su unión a su receptor en la superficie de los eosinófilos. Inhibir la unión de IL-5 a través de esta vía reduce los niveles de eosinófilos en sangre, tejidos y esputo.[1] Los eosinófilos son un tipo de glóbulos blancos que, en algunos pacientes con asma, pueden causar inflamación en los pulmones, dificultando la respiración e incrementando el riesgo de sufrir un ataque de asma o “exacerbación”[2]. Una exacerbación se caracteriza por un aumento de la dificultad para respirar, tos, sibilancias, opresión en el pecho y un empeoramiento de la función pulmonar más allá del estado habitual del paciente, lo cual es suficiente para que se requiera un cambio en el tratamiento[3]. Una exacerbación puede ser grave y requerir que el paciente necesite recibir tratamiento con corticosteroides orales[3]. Asimismo, una exacerbación grave puede incluso requerir la hospitalización del paciente o que éste acuda a urgencias[3,4].
El 10% de la población de asmáticos padece asma grave
“El asma grave constituye aproximadamente el 10% de la población de asmáticos; sin embargo, representa un desafío clínico y una carga sanitaria importante. La existencia de fenotipos en todo el espectro de gravedad complica el manejo de esta enfermedad, aunque en este tipo de pacientes, las exacerbaciones frecuentes suelen asociarse con la persistencia de una reacción inflamatoria de tipo eosinofílica. Con mepolizumab nos encontramos ante un fármaco con acción selectiva sobre esta inflamación eosinofílica”, comenta el Dr. Carlos Melero, neumólogo en el Instituto de Investigación, Hospital Universitario 12 de Octubre de Madrid. En el programa de desarrollo clínico de fase IIb/III para mepolizumab se investigó la eficacia y seguridad en pacientes con asma grave con fenotipo eosinofílico. Todos los pacientes incluidos en los estudios MEA115588 (MENSA) y MEA115575 (SIRIUS) tenían niveles sanguíneos de eosinófilos iguales o superiores a 150 células/μL al inicio del tratamiento o niveles iguales o superiores a 300 células/μL durante los últimos 12 meses.[5,6]
Según el Dr. Luis Prieto, jefe de Sección de Alergología del Hospital Universitario Dr. Peset de Valencia y profesor titular de Medicina de la Universidad de Valencia, “este tipo de asma es de difícil control, por lo que los pacientes ven su calidad de vida muy comprometida. El poder disponer de un novedoso tratamiento que pueda ayudar a los pacientes a controlar su enfermedad sin la necesidad recurrente de tener que acudir a urgencias o, incluso, de sufrir ingresos hospitalarios, es un importante logro”.
Mejora de la calidad de vida
Al añadir mepolizumab al tratamiento habitual se ha demostrado que se reduce la frecuencia de las exacerbaciones en pacientes con asma grave eosinofílica refractaria que tienen exacerbaciones frecuentes, y que se reduce la dosis necesaria de corticosteroides orales. Asimismo, se ha observado que mejora la calidad de vida, medida a través del Cuestionario Respiratorio de St. George (SGRQ, por sus siglas en inglés) y que mejora la función pulmonar, medida como FEV1 previa al uso del broncodilatador, una medida estándar de la salud pulmonar empleada por los médicos. “Disponer de este tratamiento que nos permite ayudar a un tipo concreto de pacientes con asma grave eosinofílica a reducir las exacerbaciones y las exacerbaciones graves, así como el consumo de medicación de rescate, incluyendo aquí a los corticoides orales, es un gran avance”, añade el Dr. Christian Domingo, médico especialista sènior de la Corporació Parc Taulí y profesor titular de Medicina de la Universitat Autònoma de Barcelona (UAB). También comenta que “con estos tratamientos se puede conseguir retrogadar ciertos aspectos de la enfermedad de estos pacientes consiguiendo que no empeoren”.

(de izq. a dcha) Dra. Rosana Cajal, Dr. Carlos Melero y Dra. Guadalupe Sánchez, responsable médico para Nucala® en GSK España
Fuente: GSK / Berbés Asociados
Además, se han publicado recientemente datos que avalan la seguridad y eficacia de Nucala® en dos revistas científicas. En Clinical Therapeutics se han publicado datos procedentes del estudio de extensión abierto COSMOS (MEA115661). Estos datos muestran que el perfil riesgo/beneficio demostrado en los estudios pivotales de Nucala® se mantiene tras un periodo de tratamiento adicional de 52 semanas. La reducción del riesgo de exacerbaciones y la reducción de dosis de corticosteroides orales observada en los estudios previos también se ha demostrado en este estudio de extensión.[7] También se ha publicado un meta-análisis en la revista científica Journal of Allergy and Clinical Immunology, que demuestra que el riesgo de hospitalizaciones o de visitas a urgencias debidas a una crisis de asma se vio reducido a la mitad (51% de reducción p<0.001) en aquellos pacientes de asma grave con fenotipo eosinofílico que recibían Nucala® (dosis fija de 100mg sc de mepolizumab) en comparación con aquellos pacientes que recibieron placebo, ambos añadidos a un tratamiento estándar para su enfermedad.[8]
Información de seguridad importante
La siguiente información importante de seguridad se basa en una síntesis de la ficha técnica europea y la información de prescripción de EE.UU. para Nucala®. Para obtener la información completa de seguridad de Nucala®, consulte la ficha técnica y la información de prescripción completos para Nucala®.
-Nucala® está contraindicado en pacientes con hipersensibilidad a mepolizumab o a cualquiera de sus excipientes.
-Nucala® no debe utilizarse para tratar exacerbaciones agudas del asma.
-Durante el tratamiento pueden aparecer acontecimientos adversos o exacerbaciones del asma. Debe indicarse a los pacientes que busquen asistencia médica si su asma permanece no controlada o empeora después del inicio del tratamiento.
-No se recomienda la interrupción brusca de los corticosteroides después del inicio del tratamiento con Nucala®. La reducción de la dosis de corticosteroides, si es necesaria, debe realizarse de forma gradual y bajo supervisión médica.
-Después de la administración de Nucala® han aparecido reacciones sistémicas agudas y tardías, incluyendo reacciones de hipersensibilidad (por ejemplo, urticaria, angioedema, sarpullido, broncoespasmo, hipotensión). Estas reacciones generalmente ocurren en las horas siguientes a la administración, pero en algunos casos puede aparecer un inicio tardío (por ejemplo, lo más típico en algunos días). Estas reacciones pueden aparecer por primera vez después de un tratamiento de larga duración.
Fuente: GSK / Berbés Asociados
-Los eosinófilos pueden participar en la respuesta inmunológica a algunas infecciones por helmintos. Los pacientes con infecciones ya existentes por helmintos deberían ser tratados de las mismas antes de comenzar el tratamiento con Nucala®. Si los pacientes se infectasen mientras reciben el tratamiento con Nucala® y no responden al tratamiento anti-helmintos, debería considerarse la interrupción temporal de la terapia.
-Durante los ensayos clínicos en sujetos con asma grave eosinofílica refractaria, las reacciones adversas notificadas más comúnmente fueron dolor de cabeza, reacciones en el sitio de inyección y dolor de espalda. El dolor de cabeza fue considerado muy común, apareciendo con una frecuencia de ≥1/10. Las reacciones adversas al medicamento comunes (≥1/100 a <1/10) incluyeron: infecciones de las vías respiratorias inferiores, infecciones de las vías urinarias, faringitis, reacciones de hipersensibilidad (sistémicas, alérgicas), congestión nasal, dolor en el abdomen superior, eccema, dolor de espalda, reacciones relacionadas con la administración (sistémicas, no alérgicas), reacciones locales en el sitio de inyección y pirexia.
-Las reacciones en el sitio de inyección (por ejemplo, dolor, eritema, inflamación, picor y sensación de ardor) ocurrieron en una proporción del 8% en sujetos tratados con Nucala® en comparación con el 3% en sujetos tratados con placebo.
Referencias
1. Nucala Summary of Product Characteristics, 2015
2. Malinovschi A, et al. Exhaled nitric oxide and blood eosinophils independently associate with wheeze and asthma events in NHANES subjects. J Allergy Clin Immunol. 2013;132:821-827.
3. From the Global Strategy for Asthma Management and Prevention. Global Initiative for Asthma (GINA) 2015. Available online at: http://www.ginasthma.org. [Last accessed: 4 January 2016].
4. Reddel HK, et al. An official American Thoracic Society/European Respiratory Society statement: asthma control and exacerbations. Standardizing endpoints for clinical asthma trials and clinical practice. AJRRCM. 2009;180:59-99.
5. Ortega HG, et al. Mepolizumab treatment in patients with severe eosinophilic asthma. N Engl J Med. 2014;371:1198-1207.
6. Bel EL, et al. Oral glucocorticoid-sparing effect of mepolizumab in eosinophilic asthma. N Engl J Med. 2014;371:1189-1197.
7. Referencia to be provided
8. Meta-analysis of asthma-related hospitalization in mepolizumab studies of severe eosinophilic asthma. Yancey S, Ortega H, Keene O, Mayer B, Gunsoy N, Brightling C, Bleecker ER, Haldar P, Pavord I. Journal of Allergy and Clinical Immunology, 2016. Epub. DOI: http://dx.doi.org/10.1016/j.jaci.2016.08.008
Referencias infografías
1. Global Burden of Disease Study 2013 Collaborators. Global, regional, and national incidence, prevalence, and years lived with disability for 301 acute and chronic diseases and injuries in 188 countries, 1990–2013: a systematic analysis for the Global Burden of Disease Study 2013. Lancet. 2015;386:743–800 2. Moore WC, et al. Characterisation of the severe asthma phenotype by the National Heart, Lung, and Blood Institute’s Severe Asthma Research Program. J Allergy Clin Immunol. 2007;11:405-413. 3. Kupczyk M, et al. Frequent exacerbators – a distinct phenotype of severe asthma. Clin Exp Allergy. 2014;44(2):212-221. 4. The ENFUMOSA Study Group. The ENFUMOSA cross-sectional European multicentre study of the clinical phenotype of chronic severe asthma. Eur Respir J. 2003;22:470-477. 5. Accordini S et al. The Cost of Persistent Asthma in Europe: An International Population-Based Study in Adults. Int Arch Allergy Immunol. 2013;160:93-101. 6. Antonicelli L, et al. Asthma severity and medical resource utilisation. Eur Respir J. 2004;23(5):723-729. 7. Godard P, et al. Costs of asthma are correlated with severity: a 1-yr prospective study. Eur Respir J. 2002;19(1):61-67. 8. Dolan CM, et al. Design and baseline characteristics of the epidemiology and natural history of asthma: outcomes and treatment regimens (TENOR) study: a large cohort of patients with severe or difficult-to-treat asthma. Ann Allergy Asthma Immunol. 2004;92:32-39. 9. Walford HH, Doherty TA. Diagnosis and management of eosinophilic asthma: a US perspective. J Asthma Allergy. 2014;7:53–65. 10. GlaxoSmithKline Data on File (Document Number: 2015N248497_00). 2015. 11. Asthma and Allergy Foundation of America. Eosinophilic asthma. Disponible en: https://www.aafa.org/display.cfm?id=8&sub=17&cont=801. [Último acceso: 20 de octubre de 2015]. 12. Rothenberg ME. Eosinophillia. N Engl J Med. 1998;338:1592-1600. 13. Malinovschi A, et al. Exhaled nitric oxide and blood eosinophils independently associate with wheeze and asthma events in NHANES subjects. J Allergy Clin Immunol. 2013;132:821-827. 14. Kouro T, Takatsu T. IL-5- and eosinophil-mediated inflammation: from discovery to therapy. Int Immunol. 2009;21(12):1303–1309.
ESP/NLA/0057/16a




