Redacción Farmacosalud.com
Unos científicos han localizado una pieza decisiva de la maquinaria que permite a la peligrosísima y temida bacteria Staphylococcus aureus transferirse genes de resistencia a los antibióticos. Así, se ha descubierto que la relaxasa, una proteína enzimática, juega un papel determinante en este proceso al servirse de un aminoácido, una histidina, como el elemento central para que se propague la resistencia. El investigador Miquel Coll, líder del estudio sobre Staphylococcus aureus y científico del IRB Barcelona, opina que con este hallazgo se abre la puerta al desarrollo de nuevas estrategias contra la persistencia de dicha bacteria, como podría ser la creación de un fármaco que, con capacidad para bloquear la relaxasa, fuera administrado junto con un antibiótico para el que no fuera resistente la cepa de S. aureus detectada. Esta combinación tendría, sobre todo, un carácter preventivo, es decir, se trataría de evitar la diseminación de la bacteria persistente con el fin de impedir nuevas infecciones. Coll, además, propone a través de www.farmacosalud.com otra aplicación: adjuntar el hipotético nuevo fármaco a los antibióticos “que se suministran a los animales de granja, evitando así que se diseminen cepas resistentes que luego llegan a los humanos”.
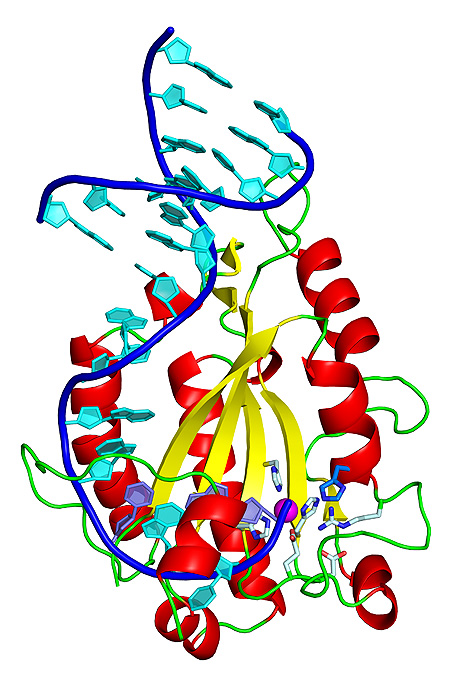
Estructura tridimensional de la proteína relaxasa unida a un fragmento de ADN. La histidina, esencial para cortar y transferir el ADN, se muestra en azul (abajo a la derecha)
Autor/a y fuente: Radoslaw Pluta, IRB Barcelona
La bacteria Staphylococcus aureus mata a 11.300 personas cada año sólo en Estados Unidos por infecciones resistentes a los antibióticos, lo que constituye más de la mitad de las muertes provocadas por infecciones de bacterias resistentes gram-positivo en ese país. La rapidez que tienen las bacterias en adquirir genes de persistencia a tales medicamentos es lo que confiere a S. aureus su capacidad de alta letalidad. Un estudio del Instituto de Investigación Biomédica (IRB Barcelona), que ha contado con la colaboración del Centro de Investigaciones Biológicas (CIB-CSIC) de Madrid, identifica la pieza clave de la maquinaria que usa Staphylococcus aureus para adquirir y transferirse genes que la hacen resistente a antibióticos. El trabajo se ha publicado en ‘Proceedings of the National Academic of Sciences’ (PNAS).
Transferencia horizontal de genes: una habilidad bacteriana ausente en humanos
"La lucha contra las bacterias, sobre todo en entornos hospitalarios donde son un problema de primera magnitud, pasa por entender cómo se transfieren los genes para adaptarse rápidamente a entornos cambiantes, como por ejemplo cuando se encuentran con antibióticos nuevos", señala Coll, también investigador del CSIC y estudioso de la transferencia horizontal de genes desde la biología estructural. "Una habilidad extraordinaria de las bacterias para evolucionar y adaptarse rápidamente es esta transferencia horizontal de genes, que los humanos por ejemplo no tenemos", explica el experto en un comunicado difundido por IRB Barcelona. Una de estas vías se llama conjugación: dos bacterias se unen para pasarse un fragmento de ADN, llamado plásmido. "Un plásmido es un trozo pequeño de ADN en forma de círculo que contiene muy pocos genes, donde se localizan normalmente genes selectivos de resistencia a antibióticos, y que tardan sólo unos minutos en ser transferidos entre bacterias", detalla.
En la transferencia horizontal interviene una maquinaria donde la relaxasa, una proteína enzimática, es una pieza clave. Gracias a la resolución de la estructura en tres dimensiones del complejo que forma la relaxasa con el ADN del plásmido, los investigadores han identificado un aminoácido, una histidina, como el elemento central para que se produzca la transferencia y se propague la resistencia. "Lo que es nuevo es que la relaxasa de diferentes cepas de Staphylococcus aureus es especial porque usa un aminoácido que no se había visto nunca en ninguna otra de las relaxasas que conocemos", precisa el primer firmante del estudio, Radoslaw Pluta, estudiante de doctorado de ‘la Caixa’ en IRB Barcelona, y actualmente investigador postdoctoral en el International Institute of Molecular and Cell Biology en Varsovia, Polonia.
La histidina catalítica, presente en las relaxasas del 85% de cepas de S. aureus
La histidina es el residuo catalítico que permite a la relaxasa cortar el ADN, unirse a él, estirar una de las dos cadenas y llevársela para traspasarla a la bacteria receptora, donde la cadena se replicará para formar, de nuevo, la doble cadena del plásmido. Este nuevo plásmido ya contendrá los genes de resistencia y la maquinaria para transferirlos a otra bacteria. Los científicos informan que esta histidina catalítica está presente en las relaxasas del 85% de cepas de Staphylococcus aureus. Para comprobar que la histidina es decisiva, los investigadores del grupo de Manuel Espinosa del CIB-CSIC, que han participado en el estudio, la intercambiaron por un aminoácido diferente y confirmaron en placas con cultivos que se impedía la transferencia. Así pues, la mutación de la histidina no mata la bacteria, sólo impide el traspaso de genes.
“La histidina es el aminoácido esencial para la catálisis de la reacción de corte y transferencia del ADN. Pero es parte de lo que se llama el centro activo del encima (en este caso una relaxasa). Ese centro activo se podría bloquear con una molécula pequeña que se uniera con gran afinidad a ese sitio del enzima, seguramente también contactando la histidina, impidiendo así la actividad del enzima, y por tanto haciendo imposible la transferencia de ADN. Muchos fármacos actúan así, uniéndose a los centros activos de encimas que son dianas farmacológicas. Encontrar y desarrollar esta pequeña molécula inhibidora para que llegara a ser un fármaco requeriría una larga investigación, pero conocer como es la diana -el enzima relaxasa- ya es un gran paso en esa dirección”, sostiene Coll en un intento de pensar en posibles soluciones terapéuticas frente a los agentes bacterianos ‘recalcitrantes’.
Fuente: www.farmacosalud.com / IMAGEN DE ARCHIVO
Gentileza del Centro Nacional de Microbiología. Instituto de Salud Carlos III de Madrid
“La forma más obvia de impedir la transferencia es bloquear la relaxasa (que contiene la histidina catalítica) con un fármaco tipo pequeña molécula -asevera Coll-. Ahora bien, aquí se plantea la problemática de quién debe tomar este fármaco. Para matar las bacterias que ya tienen la resistencia y que están poniendo en riesgo la vida de un paciente no sirve para salvarle la vida. Hay que darle un antibiótico para el que no sea resistente esa cepa de S. aureus. Esta hipotética molécula contra la transferencia se tendría que suministrar a la vez que el antibiótico y sería preventiva, para evitar la diseminación de la resistencia. Y, por tanto, estaríamos actuando no sólo en ese paciente, sino en previsión de otros posibles casos de infección. Podemos también pensar en otra aplicación: se trataría de adjuntarla (la molécula) a los antibióticos que se suministran a los animales de granja evitando así que se diseminen cepas resistentes que luego llegan a los humanos”.
"Ahora mismo estamos como en una carrera que siempre perdemos”
Coll explica que las infecciones hospitalarias son las más difíciles de combatir. "Ahora mismo estamos como en una carrera que siempre perdemos porque cuando se usa un antibiótico diferente enseguida aparecen resistencias y se propagan", describe. El científico añade que el arsenal de antibióticos en reserva de los hospitales para tratar las infecciones resistentes es "demasiado" corto. Aparte de la dificultad de generar nuevos antibióticos, este investigador también resalta como escollo para avanzar más rápidamente que "haya poca inversión, ya que la industria muestra otras prioridades. Esto es legítimo, por eso hay que sumar inversiones de fondos públicos y privados".
En el trabajo sobre S. aureus ha colaborado el grupo de Modesto Orozco, también en el IRB Barcelona, que ha proporcionado el estudio teórico que otorga validez a la reacción química entre el ADN del plásmido y la proteína a través de la histidina. La resolución de la estructura del complejo formado por la proteína y la cadena de ADN se ha realizado con datos obtenidos por difracción de rayos X en el sincrotrón europeo de Grenoble.
Artículo de referencia:
Radoslaw Pluta, D. Roeland Boer, Fabián Lorenzo-Díaz, Silvia Russi, Hansel Gómez, Cris Fernández-López, Rosa Pérez-Luque, Modesto Orozco, Manuel Espinosa and Miquel Coll. ‘Structural basis of a novel histidine-DNA nicking/joining mechanism for gene transfer and promiscuous spread of antibiotic resistance’. PNAS (2017): Doi: 10.1073/pnas.1702971114




