Redacción Farmacosalud.com
Sanofi ha anunciado que Kevzara® (sarilumab) ya está disponible en España para el tratamiento de la artritis reumatoide (AR) activa de moderada a grave en pacientes adultos. Está indicado en combinación con metotrexato (MTX) en pacientes con una respuesta insuficiente o intolerancia a uno o más fármacos antirreumáticos modificadores de la enfermedad (FAME), como el MTX o los inhibidores del TNFα (aTNF).[1] Se puede utilizar Kevzara® en monoterapia en caso de intolerancia al MTX o cuando el tratamiento con MTX no resulte adecuado.[1] Kevzara® es un anticuerpo monoclonal humano que se une a los IL-6R (receptor de la interleucina 6) tanto cuando está soluble como unido a la membrana celular, inhibiendo las vías de señalización en las que interviene esta citoquina proinflamatoria[1]. La IL-6 es una de las citocinas más abundantes en suero y líquido sinovial de los pacientes con AR, y sus niveles elevados persistentes se asocian a mayor actividad de la enfermedad, destrucción articular y efectos sistémicos de la enfermedad. [2,3]
“La llegada de este medicamento es una buena noticia para los profesionales sanitarios que tratamos a personas que padecen artritis reumatoide, y por lo tanto, para los pacientes”, explica el profesor Juan José Gomez-Reino, presidente de la Sociedad Española de Reumatología (SER). “Actualmente todavía existen necesidades no cubiertas para el paciente con artritis reumatoide y disponer de sarilumab significa ampliar el arsenal terapéutico disponible y, al final, tener más herramientas que nos ayuden a adecuar mejor el tratamiento a cada paciente y a mejorar su calidad de vida”.
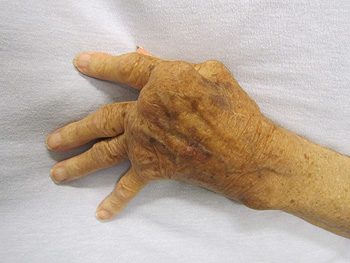
Mano afectada por la artritis reumatoide
Autor/a de la imagen: James Heilman, MD - Trabajo propio
Fuente: Wikipedia
La AR afecta aproximadamente a 70 millones de adultos en todo el mundo y a 2,9 millones de personas solo en Europa.[4-6] En España se estima que tienen AR unas 200.000 personas, según la Sociedad Española de Reumatología (SER). En la AR, el sistema inmunitario ataca los tejidos de las articulaciones, provocando inflamación, dolor articular, hinchazón, rigidez, fatiga y con el tiempo, daño articular e incapacidad funcional, acompañándose también de manifestaciones sistémicas como anemia, enfermedades pulmonares o aumento del riesgo de desarrollar eventos cardiovasculares o incluso la muerte.[7,8] La AR es más frecuente en mujeres, y suele debutar entre los 35 y 50 años.[9]
Tres estudios avalan la eficacia del nuevo fármaco
En los 3 estudios pivotales: MOBILITY, TARGET y MONARCH, sarilumab 200 mg en combinación con FAME o en monoterapia, ha demostrado una eficacia sólida y consistente entre distintas poblaciones de pacientes, entre las que se incluyen pacientes no respondedores a MTX (MTX-IR), no respondedores a fármacos biológicos contra el factor de necrosis tumoral (TNF-IR) o intolerantes a MTX.1,[10]
En el ensayo en fase III MONARCH, con pacientes intolerantes, cuyo tratamiento no es adecuado o no responden al MTX, el tratamiento con Kevzara® 200 mg en monoterapia demostró su superioridad frente a adalimumab 40 mg (comercializado por AbbVie como Humira®), ambos administrados cada 2 semanas, a la hora de reducir la actividad de la enfermedad y mejorar la función física, informa Sanofi mediante un comunicado. Asimismo, un mayor número de pacientes lograron la remisión clínica durante 24 semanas.[1, 11]
En el ensayo en fase III MOBILITY, en pacientes no respondedores a MTX, el tratamiento con Kevzara® en combinación con MTX redujo los signos y síntomas de la AR, mejoró la funcionalidad física y, en la semana 52, detuvo la evolución del daño estructural en un 91% con la dosis de Kevzara® 200 mg, comparado con el placebo en combinación con MTX[1,12]

Fuente: Sanofi
En el estudio en fase III TARGET, en pacientes intolerantes o no respondores a anti-TNF (anticuerpos frente al factor de necrosis tumoral α), el tratamiento con Kevzara® en combinación con FAME redujo los signos y síntomas de la AR y mejoró la funcionalidad física, comparado con el placebo en combinación con FAME[1,13]. La eficacia demostrada en los diversos estudios supone una mejora en los signos y síntomas de la AR, una mayor inhibición de la progresión del daño articular, así como la mejora de la función física y otros resultados de salud reportados por el paciente (PROs: patient reported outcomes) para el paciente con AR de moderada a grave.[1,10,14-16]
Un dispositivo innovador
La dosis recomendada de Kevzara® es de 200 mg una vez cada 2 semanas, administrada en forma de inyección subcutánea con una jeringa o pluma precargadas.[1] Kevzara llega al mercado español con un dispositivo innovador, ya premiado en distintos países como Alemania, por su diseño pensado en los pacientes que más limitaciones funcionales presentan debido a la evolución de su enfermedad. Así, su diseño ergonómico, sin necesidad de apretar ningún botón, de un solo uso y donde la aguja no está visible, resulta muy bien valorado por los pacientes, como destaca otro estudio en fase III, EASY[17] donde se comparó la jeringa precargada con este innovador dispositivo. Asimismo, el hecho que, tras su uso, se bloquee evitando riesgos de pinchazos accidentales, supone una garantía más para los pacientes con AR.[17]
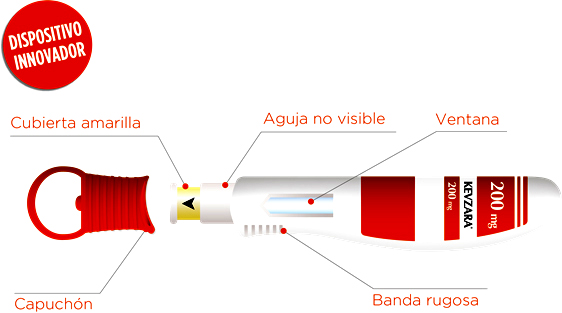
Fuente: Sanofi
Las reacciones adversas más frecuentes observadas con Kevzara® en los ensayos clínicos fueron neutropenia, aumento de la alanina-aminotransferasa, eritema en el lugar de la inyección, infecciones del tracto respiratorio superior y del urinario[1]. Las reacciones adversas graves más frecuentes fueron las infecciones[1]. Estos hallazgos son consistentes con las reacciones esperadas de un inhibidor de IL-6R que se administra por vía subcutánea[1]. Se recomienda la reducción de la dosis desde los 200 mg cada 2 semanas a 150 mg cada 2 semanas para controlar ciertas anomalías en los análisis, características de los fármacos que bloquean la vía de la citocina IL6 (neutropenia, trombocitopenia y/o aumento de las enzimas hepáticas)[1].
Se debe interrumpir el tratamiento con Kevzara® en pacientes que presenten una infección grave hasta que la infección esté controlada[1]. No se recomienda iniciar el tratamiento con Kevzara® en pacientes con un nivel bajo de neutrófilos, (recuento absoluto de neutrófilos (RAN) <2 x 109/l), en pacientes con un recuento de plaquetas por debajo de 150 x 103/μl, o en pacientes con ALT o AST por encima de 1,5 x LSN (límite superior de normalidad)[1].
Referencias
1. Kevzara Summary of Product Characteristics April 2017.
2. Robak T, et al. Mediators Inflamm. 1998;7:347–53;
3. McInnes IB, Buckey CD, Isaacs JD.. Nat Rev Immunol 2016;12:36-68.
4. National Rheumatoid Arthritis Foundation. “European Fit to Work report.” Available at http://www.nras.org.uk/european-fit-for-work-report. Last accessed: February 2018.
5. Gibofsky, A. Overview of Epidemiology, Pathophysiology, and Diagnosis of Rheumatoid Arthritis. Am J Manag Care. 2012 Dec;18(13 Suppl):S295-302.
6. United Nations, Department of Economic and Social Affairs, Population Division (2015). World Population Prospects: The 2015 Revision, Key Findings and Advance Tables. Working Paper No. ESA/P/WP.241.
7. Mayo Clinic. “Rheumatoid Arthritis.” Available at http://www.mayoclinic.org/diseases-conditions/rheumatoid-arthritis/home/ovc-20197388. Last accessed: February 2018.
8. Arthritis Research UK. “What are the symptoms of rheumatoid arthritis?” Available at: http://www.arthritisresearchuk.org/arthritis-information/conditions/rheumatoid-arthritis/symptoms.aspx Last accessed: February 2018.
9. Burton, W, Morrison, A, Maclean, R, and Ruderman, E. "Systematic review of studies of productivity loss due to rheumatoid arthritis." Occupational Medicine 2006;56:18–27
10. Tornero J. Reumatol Clin Supl. 2018;14(2):70-77
11. Burmester G, et al. Ann Rheum Dis 2017;76(5):840-847.
12. Genovese MC, et al. Arthritis Rheumatol 2015;67(6):1424-1437.
13. Fleischmann R, et al. Arthritis Rheumatol 2017;69(2):277-290.
14. Strand V, et al. Arthritis Res Ther. 2016 Sep 6;18:198.
15. Strand V, et al. RMD Open. 2017 Mar 7;3(1):e000416
16. Strand V, et al. Arthritis Research & Therapy. 2018 Jun 19;20(1):129.
17. Kivitz A, et al.Rheumatol Ther. 2018 Jun;5(1):231-242




