Redacción Farmacosalud.com
Llega a España Ozempic® (semaglutida), un novedoso análogo del péptido similar al glucagón tipo 1 (GLP-1) para la diabetes tipo 2 que aporta grandes beneficios en relación a la glucemia, el peso y el riesgo cardiovascular. El nuevo fármaco, por ejemplo, es capaz de llevar a objetivos de control a pacientes que han referido grandes dificultades para reducir los niveles de glucosa en sangre, y logra resultados sin precedentes en relación a la pérdida de peso. Semaglutida muestra, además, una significativa reducción del peligro de episodios cardiovasculares del 26%, registrándose, en esa línea, una disminución del 39% del riesgo de ictus, asegura a www.farmacosalud.com el Dr. Lluís Masmiquel, jefe de Endocrinología del Hospital Universitario Son Llàtzer (Palma de Mallorca).
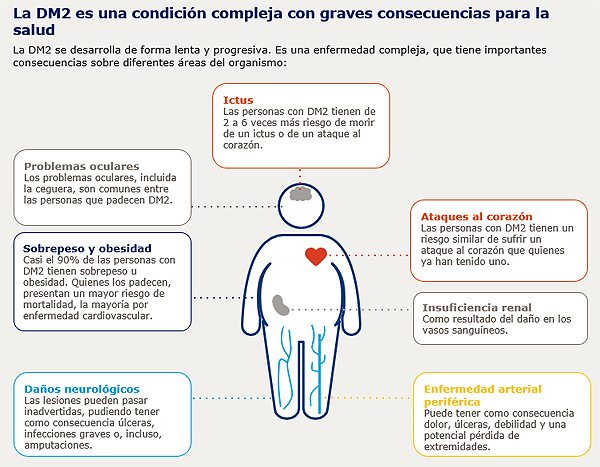
La diabetes tipo 2 afecta a 5,3 millones de personas en España[1]. Es una enfermedad multifactorial y compleja que, sin un correcto seguimiento, puede tener graves consecuencias para la salud: problemas oculares, sobrepeso u obesidad, insuficiencia renal, enfermedades cardiovasculares, etc. En torno al 90% de estos diabéticos tienen sobrepeso u obesidad[2] y alrededor del 80% fallecen a causa de una enfermedad cardiovascular aterosclerótica, como el infarto del miocardio o el ictus[3].
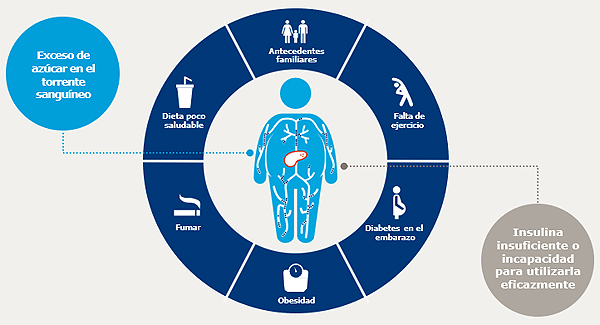
La DM2 puede ser consecuencia de múltiples factores
Fuente: International Diabetes Federation. Available at: http://www.diabetesatlas.org/. Last accessed: 12 January 2018.
Difusión: Novo Nordisk / Cícero Comunicación
Disminución del 35% de los procesos de revascularización arterial
Para ayudar a controlar mejor la diabetes tipo 2 y prevenir algunas de sus graves complicaciones asociadas, Novo Nordisk lanza Ozempic® (semaglutida), un nuevo análogo del péptido similar al glucagón tipo 1 (GLP-1). Ya disponible en España para el tratamiento de adultos con diabetes mellitus tipo 2[4], ha demostrado que reduce significativamente los niveles de glucosa en sangre, al tiempo que ayuda en el control del peso y hace que descienda el riesgo de sufrir un episodio cardiovascular grave hasta en un 26% en los pacientes de alto riesgo o que han sufrido un episodio cardiovascular previo[5-9]. Los altos niveles de glucosa en sangre y otras alteraciones asociadas a la diabetes (presión arterial alta, alteración de los lípidos, obesidad…) provocan daños en los vasos sanguíneos, lo que motiva que la enfermedad cardiovascular sea una complicación muy frecuente y la principal causa de muerte y discapacidad en las personas con diabetes[10,11].
Según el Dr. Masmiquel, “Ozempic® ha evidenciado una disminución de un 26% de los episodios cardiovasculares en comparación con placebo, índice que, hasta el momento, no ha sido superado por ningún otro fármaco para la diabetes. Esto tiene grandes beneficios para las personas con diabetes tipo 2, especialmente, para aquellas con elevado riesgo cardiovascular”, explica Masmiquel a través de un comunicado de Novo Nordisk relativo a la rueda de prensa de presentación del nuevo tratamiento. “Semaglutida ha demostrado en SUSTAIN 6, su ensayo de seguridad cardiovascular, una disminución de un 26% del riesgo de sufrir un objetivo compuesto de ‘muerte cardiovascular, ictus e infarto de miocardio’”, remarca a www.farmacosalud.com el facultativo, quien añade que también “es destacable una disminución del 39% del riesgo de ictus”, así como que entre sus objetivos secundarios se haya visto una reducción “del 35% de los procesos de revascularización arterial, sobre todo a expensas de procedimientos de revascularización coronaria”.
Altas puntuaciones en la escala de satisfacción con el tratamiento de la diabetes
Semaglutida, asimismo, destaca por su flexibilidad: se administra subcutáneamente una vez a la semana en cualquier momento del día, con o sin comidas[4]. “La insulina debe administrarse una o varias veces al día en función del paciente. De la misma manera, otros agonistas del receptor de GLP1 que podríamos llamar de primera generación, se administran una o incluso dos veces al día. Los medicamentos antidiabéticos orales también se administran una o varias veces al día. Pensamos que la administración semanal es más sencilla y flexible para el paciente y esta es la tendencia que han seguido los nuevos inyectables. Las puntuaciones en la escala de satisfacción con el tratamiento de la diabetes (DTSQ) que han contestado los pacientes han sido, en general, mejores con semaglutida que con otros comparadores”, revela el Dr. Masmiquel.
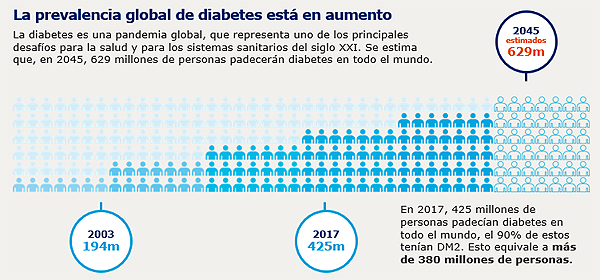
Fuente: International Diabetes Federation. Available at: http://www.diabetesatlas.org/. Last accessed: 12 January 2018.
Difusión: Novo Nordisk / Cícero Comunicación
La eficacia de semaglutida está basada en el programa de ensayos clínicos SUSTAIN, en el que demostró un perfil seguro y con buena tolerabilidad[3]. Este programa comprende ocho ensayos clínicos globales de fase 3a en los que participaron más de 8.000 adultos con diabetes tipo 2, incluidas personas con elevado riesgo cardiovascular, con y sin enfermedad renal[5-9, 12-15].
En estos ensayos, Ozempic® ha proporcionado una mayor reducción de los niveles de glucosa en sangre (HbA1c) y del peso corporal en comparación con otros tratamientos para la diabetes tipo 2 (sitagliptina, exenatida de liberación prolongada, insulina glargina U100 y dulaglutida)[5-8], además de demostrar beneficios cardiovasculares y una reducción estadísticamente significativa de la aparición o progresión de la nefropatía diabética frente a placebo conjuntamente con el tratamiento estándar[4]. “Cuando se ha comparado de forma directa con otras opciones terapéuticas, semaglutida ha probado que es capaz de llevar a control a un porcentaje muy alto de pacientes, cifras que hasta ahora solo habíamos observado con terapias más agresivas”, afirma el Dr. Esteban Jódar, jefe del departamento de Endocrinología y Nutrición de los hospitales Quirón Salud Pozuelo, Ruber Juan Bravo y San José (Madrid).
Para Mads W. Ø. Larsen, director general de Novo Nordisk en España, “Ozempic® puede establecer una nueva referencia en el tratamiento de la diabetes tipo 2. Su sólido perfil clínico aporta una opción terapéutica muy necesaria para personas que buscan una solución nueva y eficaz para controlar su enfermedad. Semaglutida está llamada a tener un gran impacto en la vida de los españoles con diabetes mellitus tipo 2, y así esperamos que sea”.
“Ozempic® atraviesa muy bien la barrera hematoencefálica”
Las personas tratadas con Ozempic® experimentaron una pérdida de peso de entre dos y cinco veces superior en comparación con otras terapias para la diabetes y hasta el 79% alcanzaron el objetivo de control glucémico (HBA1c) por debajo del 7%, según las recomendaciones de la Asociación Americana de Diabetes[5-8, 12,13]. “Semaglutida cambia el paradigma de tratamiento para las personas con diabetes mellitus tipo 2 en su esfuerzo por mejorar el control de su enfermedad, un control que incluye mejorar sus niveles de glucemia y conseguir un difícil objetivo como es la pérdida de peso, ambos con resultados sin precedentes. Además, muestra una significativa reducción del riesgo de los episodios cardiovasculares del 26% en tan solo dos años de tratamiento, incidiendo así sobre la principal causa de mortalidad de las personas con diabetes mellitus tipo 2”, sostiene Francisco Pajuelo, director médico de Novo Nordisk en España.
Fuente:
International Diabetes Federation. Available at: http://www.diabetesatlas.org/. Last accessed: 12 January 2018
International Diabetes Federation. Available at: https://www.idf.org/ our-activities/care-prevention/cardiovascular-disease/cvd-report.html. Last accessed: 12 January 2018.
Low Wang CC, et al. Circulation 2016;133:2459–2502.
Ting D, et al.
Clin Exp Opthalmol 2016;44:260–277.
Fihn SD, et al. Circulation 2012;126:3097–3137.
Schramm TK, et al. Circulation 2008;117:1945–1954.
World Health Organization. Available at: http://www.who.int/dietphysicalactivity/media/en/gsfs_obesity.pdf. Accessed 12 January 2018.
Whitlock G, et al. Lancet 2009;373:1083–1096.
Difusión: Novo Nordisk / Cícero Comunicación
Para el Dr. Masmiquel, el hecho de que el nuevo fármaco aporte enormes beneficios en relación a la pérdida de peso no implica que esté especialmente indicado para diabéticos con grandes problemas de sobrepeso o muy obesos: “Semaglutida es igual de eficaz en términos de reducción de la glucosa y en términos de reducción de eventos cardiovasculares, tanto en pacientes con IMC superior a 30 kg/m2 como en pacientes con IMC inferior a 30. Por tanto, no existe base para restringir el medicamento sólo a pacientes con obesidad. Sí es cierto que, en los pacientes en los que perder peso es la primera prioridad, semaglutida es la mejor opción porque perderán más peso que con otro fármaco antidiabético”.
El 90% de las personas con diabetes tipo 2 tienen sobrepeso u obesidad[2]. Es una enfermedad que requiere una gestión a largo plazo y que se asocia a diversas consecuencias graves para la salud y a una menor esperanza de vida[11]. Por ello, los tratamientos que ayudan a controlar el peso son, por lo general, altamente beneficiosos para las personas diabéticas. En este sentido, Ozempic® reduce el apetito y disminuye la ansiedad por comer[4]. “Aunque es una característica general de los fármacos de este grupo, no todos han demostrado la misma pérdida de peso en los ensayos clínicos de desarrollo. Entre ellos, el más potente en reducción de peso ha sido semaglutida”, explica el Dr. Jódar. “Ozempic® es un fármaco que atraviesa muy bien la barrera hematoencefálica y actúa en los centros del apetito. Y a este nivel, ha sido mucho más potente que las otras opciones terapéuticas que hemos tenido hasta el momento”, añade Masmiquel.
Riesgos de hipoglucemia muy bajos
Se estima que un 56% de las personas con diabetes en España no tienen un nivel óptimo de control glucémico (hemoglobina glucosilada -HbA1c)[16]. Un control inadecuado de los niveles de glucosa en sangre puede tener como consecuencia hiperglucemias o hipoglucemias, poniendo en riesgo la salud y la calidad de vida de los diabéticos.

Fuente: International Diabetes Federation. Available at: http://www.diabetesatlas.org/. Last accessed: 12 January 2018.
Difusión: Novo Nordisk / Cícero Comunicación
Ozempic® reduce la glucosa en sangre de un modo dependiente de la glucosa, mediante la estimulación de la secreción de insulina y la disminución de la secreción de glucagón cuando la glucosa en sangre es elevada[17-19] sin causar hipoglucemias de manera directa: “Ha demostrado un descenso en los niveles de hemoglobina glicosilada mayor que los inhibidores de la DPP4, la insulina u otros análogos de GLP-1 -explica Masmiquel-. Al cabo de un año tras la incorporación del tratamiento con semaglutida, un 67% de los pacientes que estaban siendo tratados con una terapia dual o triple han visto cómo su situación era óptima en cuanto al objetivo terapéutico de hemoglobina”.
Por su parte, el Dr. Jódar pone de relieve “la potencia de Ozempic®, que permite controlar a un porcentaje muy alto de personas con diabetes que necesitan intensificar su tratamiento; además, es capaz de llevar a objetivos de control a pacientes que han referido grandes dificultades para reducir los niveles de glucosa en sangre”.
Según Masmiquel, con semaglutida “los riesgos de hipoglucemia son muy bajos; en general, cuando no se administra con secretágogos ni con insulina, son prácticamente nulos, especialmente cuando hablamos de hipoglucemias graves. En ausencia de secretágogos, se han observado hipoglucemias sintomáticas en entre el 0 y el 1% de los casos. Cuando hay sulfonilureas o insulina asociadas, las hipoglucemias se detectan en entre el 10 y el 31% de los sujetos. Por ello se recomienda, antes de iniciar el tratamiento, reducir la dosis de sulfonilureas o de insulina”.
En cuanto a las contraindicaciones, en la ficha técnica de semaglutida consta como contraindicación la hipersensibilidad al medicamento. Tampoco debe utilizarse en diabetes tipo 1. “No existe experiencia en pacientes con insuficiencia cardiaca de clase IV ni en pacientes con insuficiencia renal terminal, por lo que en ellos no debería utilizarse” semaglutida, advierte el jefe de Endocrinología del Hospital Universitario Son Llàtzer. La experiencia en insuficiencia hepática grave es limitada y en estos pacientes deben extremarse las precauciones. Tampoco se dispone de datos suficientes sobre seguridad y eficacia en menores de 18 años. Deberían extremarse la precaución en pacientes con antecedentes de pancreatitis. También se deben extremar las precauciones al tratar pacientes con retinopatía diabética avanzada.

(de izq. a dcha), el Dr. Esteban Jódar, el Dr. Francisco Pajuelo, Mads W. Ø. Larsen, y el Dr. Lluís Masmiquel
Fuente: Novo Nordisk / Cícero Comunicación
Uso en pluma precargada
Ozempic® ha sido aprobado para su uso en pluma precargada con 0,25 mg en 1,5 ml, 0,5 mg en 1,5 ml y 1 mg en 3 ml de solución, y está indicado en el tratamiento de adultos con diabetes mellitus tipo 2 que no han sido controlados adecuadamente, como complemento de la dieta y el ejercicio, en monoterapia, cuando la metformina no se considera apropiada debido a intolerancia o contraindicaciones y añadido a otros medicamentos para el tratamiento de la diabetes[4]. La dosis inicial es de 0,25 mg una vez a la semana. Después de cuatro semanas, la dosis debe incrementarse a 0,5 mg una vez a la semana. Después de al menos 4 semanas con 0,5 mg, ésta se puede incrementar hasta 1,0 mg una vez a la semana, para lograr así, una nueva mejora del control glucémico[4].
La tolerancia digestiva de Ozempic® es similar a la de otros agonistas del receptor del GLP-1. Las reacciones adversas notificadas con más frecuencia durante el programa de ensayos clínicos fueron los trastornos digestivos, incluidas náuseas, diarrea y vómitos. No obstante, esas reacciones fueron de intensidad leve o moderada y de corta duración[4].
Ozempic® fue aprobado por la Administración de Medicamentos y Alimentos de los EE.UU. (FDA, en sus siglas en inglés) el 5 de diciembre de 2017 y por la agencia reguladora de Canadá el 9 de enero de 2018. El 9 de febrero de 2018 la Comisión Europea (CE) otorgó la autorización de comercialización de Ozempic® (semaglutida) para el tratamiento de la diabetes mellitus tipo 2 en la UE.
Referencias
1. Estudio di@betes. CIBERDEM, 2010.
2. World Health Organization. Disponible en: http://www.who.int/dietphysicalactivity/media/en/gsfs_obesity.pdf.
3. Low Wang, et al. Circulation. 2016;133(24):2459-502
4. EMA. Ficha técnica Ozempic® (semaglutida). Disponible en: https://ec.europa.eu/health/documents/community-register/2018/20180208139833/anx_139833_es.pdf
5. Ahrén B, Masmiquel L, Kumar H, et al. Efficacy and safety of once-weekly semaglutide versus once-daily sitagliptin as an add-on to metformin, thiazolidinediones, or both, in patients with type 2 diabetes (SUSTAIN 2): A 56-week, double-blind, phase 3a, randomised trial. Lancet Diabetes Endocrinol. 2017;5:341-354.
6. Ahmann AJ, Capehorn M, Charpentier G, et al. Efficacy and Safety of Once-Weekly Semaglutide Versus Exenatide ER in Subjects With Type 2 Diabetes (SUSTAIN 3): A 56-Week, Open-Label, Randomized Clinical Trial. Diabetes Care. 2018;41:258-266.
7. Aroda VR, Bain SC, Cariou B, et al. Efficacy and safety of once-weekly semaglutide versus once-daily insulin glargine as add-on to metformin (with or without sulfonylureas) in insulin-naive patients with type 2 diabetes (SUSTAIN 4): A randomised, open-label, parallel-group, multicentre, multinational, phase 3a trial. Lancet Diabetes Endocrinol. 2017;5:355-366.
8. Pratley RE, Aroda VR, Lingvay I, et al. Semaglutide once weekly versus dulaglutide once weekly in patients with type 2 diabetes (SUSTAIN 7): a randomised, open-label, phase 3b trial. Lancet Diabetes Endocrinol. 2018.
9. Marso SP, Bain SC, Consoli A, et al. Semaglutide and cardiovascular outcomes in patients with type 2 diabetes. N Engl J Med. 2016;375:1834-1844.
10. World Health Organization, editor. Global health risks: mortality and burden of disease attributable to selected major risks. Geneva, Switzerland: World Health Organization; 2009. 62p.
11. Whitlock G, Lewington S, Sherliker P, Clarke R, Emberson J, Halsey J, Qizilbash N, Collins R, Peto R. Body-mass index and cause-specific mortality in 900 000 adults: Collaborative analyses of 57 prospective studies. Lancet. 2009;373:1083-1096.
12. Sorli C, Harashima SI, Tsoukas GM, et al. Efficacy and safety of once-weekly semaglutide monotherapy versus placebo in patients with type 2 diabetes (SUSTAIN 1): a double-blind, randomised, placebo-controlled, parallel-group, multinational, multicentre phase 3a trial. Lancet Diabetes Endocrinol. 2017;5:251-260.
13. Rodbard HW, Lingvay I, Reed J, et al. Semaglutide added to basal insulin in type 2 diabetes (SUSTAIN 5): a randomised, controlled trial. The Journal of Clinical Endocrinology & Metabolism. ePub ahead of print. DOI: 10.1210/jc.2018-00070. 2018.
14. Seino Y, Terauchi Y, Osonoi T, et al. Safety and efficacy of semaglutide once weekly vs sitagliptin once daily, both as monotherapy in Japanese people with type 2 diabetes. Diabetes Obes Metab. 2018;20:378-388.
15. Kaku K, Yamada Y, Watada H, et al. Safety and efficacy of once-weekly semaglutide versus additional oral antidiabetic drugs, in Japanese subjects with inadequately controlled T2D: a randomised trial. Diabetes Obes Metab. 2018.
16. Vinagre I, et.al. Diabetes Care. 2012;51:774–9.
17. Kapitza C, Dahl K, Jacobsen JB, et al. Effects of semaglutide on beta cell function and glycaemic control in participants with type 2 diabetes: a randomised, double-blind, placebo-controlled trial. Diabetologia. 2017;60:1390-1399.
18. Blundell J, Finlayson G, Axelsen M, et al. Effects of once-weekly semaglutide on appetite, energy intake, control of eating, food preference and body weight in subjects with obesity. Diabetes Obes Metab. 2017;19:1242-1251.
19. Hjerpsted JB, Flint A, Brooks A, et al. Semaglutide improves postprandial glucose and lipid metabolism, and delays first-hour gastric emptying in subjects with obesity. Diabetes Obes Metab. 2018;20:610-619.




