Dr. Vicenç Rocamora / Dra. Mª Magdalena Alcover / Redacción Farmacosalud.com
La leishmaniosis es una afección causada por protozoos del género Leishmania, unos parásitos que se transmiten a través de la picadura de unos insectos conocidos como flebótomos. La leishmaniosis nunca se transmite directamente del perro al hombre. De todos modos, un perro enfermo de leishmaniosis canina puede volver a ser infectante para los flebótomos y, por tanto, estos insectos pueden alimentarse sobre él y posteriormente, de forma accidental, infectar a las personas[1]. “La leishmaniosis por L. infantum presente en la región mediterránea sigue un ciclo epidemiológico secundario de tipo zoonótico, con el perro como hospedador principal y reservorio del parásito y el hombre como hospedador secundario. En nuestros focos se presentan principalmente dos formas clínicas de leishmaniosis en el hombre: leishmaniosis cutánea y leishmaniosis visceral. En el perro suelen presentar signos clínicos de afectación cutánea y visceral de forma concomitante”, explican los Drs. Vicenç Rocamora Durán, dermatólogo, jefe de servicio de Dermatología del Hospital de Manacor (Islas Baleares), y Mª Magdalena Alcover Amengual, farmacéutica, Dra. en Parasitología, y Prof. Asociada de la sección de Parasitología de la Facultad de Farmacia y Ciencias de la Alimentación de la Universitat de Barcelona (UB).
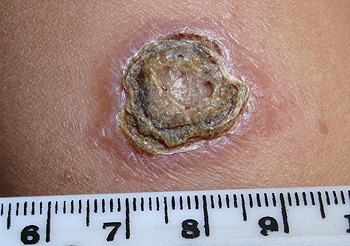
Lesión de la leishmaniosis cutánea
Autor/a de la imagen: Abanima
Fuente: Wikipedia
La lesión típica de la leishmaniosis cutánea humana comienza en forma de nódulo en el lugar de la inoculación. En el centro se forma una costra, que puede desprenderse exponiendo una úlcera que se cura gradualmente y deja una cicatriz ligeramente hundida con pigmento alterado. En algunos casos, las lesiones pueden simular otras patologías cutáneas con formas atípicas como: pápulas tipo carcinoma cutáneo o patología vírica, placas rojas tipo celulitis… es decir, la lesión puede comportarse como una gran simuladora.
Entre 2 y 12 meses de incubación en la leishmaniosis canina
Según los Drs. Rocamora y Alcover, “la leishmaniosis canina presenta un periodo de incubación que oscila entre dos y doce meses. Estudios epidemiológicos muestran la existencia de un gran porcentaje de perros asintomáticos. Por lo tanto, la leishmaniosis canina no suele guardar relación con la humana, ya que el hombre es un hospedador accidental y en muy contadas ocasiones presenta afectación sistémica, que es cuando se da una mayor frecuencia de amastigotes en el tejido hemotisular, lo que permitiría completar el ciclo del parásito si un vector picara al humano e ingiriera formas amastigotes que se transformarían en promastigotes en el intestino del vector”.
Con cada picadura de los flebótomos infectados, entran en la dermis del hospedador vertebrado entre 10 y 200 promastigotes metacíclicos, algunos de los cuales son destruidos por los leucocitos y eosinófilos, mientras que otros son englobados en una vacuola parasitófora en el interior de los macrófagos. El parásito se transforma en forma amastigota y se divide activamente hasta que dicho macrófago estalla. Los parásitos se liberan e invaden otros macrófagos vecinos, en el interior de los cuales siguen multiplicándose. Se diseminan a través de la piel o del torrente sanguíneo y linfático por órganos ricos en células macrofágicas. Ello ocasiona la aparición de las distintas formas clínicas que vienen determinadas por la interacción del parásito y el hospedador vertebrado.
“Se ha demostrado que la transmisión del protozoo también puede darse al compartir jeringuillas -advierten ambos facultativos-. Se ha descrito algún caso excepcional en el que la enfermedad puede transmitirse por picadura de garrapata, por transfusión sanguínea, de hombre a hombre, o a través de la placenta durante la gestación. Cabe destacar que hay otros reservorios de Leishmania menos frecuentes como, por ejemplo, la liebre, que fue la causante de un brote epidémico en la Comunidad de Madrid hace años. Durante ese periodo de tiempo, la incidencia de casos de leishmaniosis humana aumentó de manera significativa”.
Vectores en España: Phlebotomus ariasi y Phlebotomus perniciosus
La leishmaniosis es una enfermedad infecciosa, granulomatosa crónica, endémica, causada por distintas especies del parásito Leishmania (…) El protozoo se transmite mediante la picadura de un insecto y da lugar a distintas formas clínicas dependiendo del género de Leishmania y de la respuesta inmunitaria del individuo: forma visceral, mucocutánea o cutánea[2].

Flebótomo
(Phlebotomus sp 01)
Autor/a de la imagen: Obtained from the CDC Public Health Image Library. see:http://en.wikipedia.org/wiki/Image:Phlebotomus_sp_01.jpg
Image credit: World Health Organization (PHIL #3812), 1975.
Fuente: Wikipedia
“Los dos tipos de dípteros presentes en España que son vectores de la Leishmania infantum son: Phlebotomus ariasi y Phlebotomus perniciosus. La especie presente en las Islas Baleares es Phlebotomus perniciosus. Cuando las hembras de los flebótomos pican para ingerir la sangre del hospedador -y, en el caso de que las leishmanias lleguen a un vector susceptible-, los flebótomos se infestan si la sangre contiene macrófagos o monocitos infestados con las formas amastigotes de las leishmanias en el interior de las vacuolas lisosomales. Los cambios de temperatura y pH que sufre el parásito al pasar del mamífero al vector desencadenan el desarrollo del parásito en el vector, en cuyo intestino los amastigotes sufren una serie de complejas transformaciones morfológicas y funcionales que comportan la diferenciación de los promastigotes a formas metacíclicas infestantes que se localizan en las regiones bucales del díptero. Éstos los vehiculan en una nueva picadura a los hospedadores vertebrados”, detallan Rocamora y Alcover.
La forma visceral es una afectación en que se afectan principalmente los órganos hematopoyéticos (el bazo y el hígado) provocando anemia por disminución de hematíes y disminución de glóbulos blancos con afectación de la inmunidad, lo cual puede aumentar las infecciones oportunistas y disminuir el número de plaquetas, con el riesgo de sangrado que ello comporta. “En estos casos, podremos palpar hepatoesplenomegalia secundaria, y el paciente tendrá episodios de fiebre importante y hipergammaglobulinemia”, comentan.
Hasta el año 1985, el 70% de los casos de leishmaniosis aparecía en menores de 15 años. En la actualidad, más del 75% se da en adultos, infectados por el VIH, y en otros grupos de pacientes inmunodeprimidos, ya sea por patología o por tratamientos modernos inmunosupresores. “La inmunidad celular del huésped es importantísima, pues determina, entre otras cosas, si ocurre solamente una infección subclínica o si el paciente padece la enfermedad, si la afectación es visceral o existe también afectación cutánea o mucocutánea, y si la respuesta al tratamiento es completa o parcial”, precisan los expertos.

Dr. Vicenç Rocamora Durán
Fuente: Dr. Rocamora / Hospital de Manacor
Los flebótomos, conocidos también como ‘moscas de la arena’
La frecuencia de la leishmaniosis cutánea en la cuenca mediterránea peninsular y Baleares es elevada en relación con otras áreas del territorio español[3]. La existencia de leishmaniosis en un área depende de la presencia de los vectores y, en el caso de la producida por L. infantum, también del hospedador vertebrado principal, en este caso el perro. Por ello, los estudios que analicen el riesgo de la leishmaniosis tienen que abarcar tanto aspectos entomológicos como relativos a la presencia del reservorio y la leishmaniosis canina.
“Los flebótomos son dípteros conocidos también como ‘sandflies’, es decir, ‘moscas de la arena’ -apuntan Rocamora y Alcover-. Eso nos indica que no es habitual localizarlos en zonas húmedas. Su ciclo requiere de zonas ricas en materia orgánica, en la que las hembras ponen los huevos y en la que se desarrollan los distintos estadios larvarios. La temperatura idónea para el completo desarrollo de los flebótomos oscila entre los 17 y los 25ºC”.
En el último boletín epidemiológico (la leishmaniosis humana es una enfermedad de declaración obligatoria), Baleares tiene declarados 3,8 casos de Leishmania por 100.000 habitantes, 28 en total, de los cuales 22 son cutáneos y 6 viscerales. De los 23 casos adultos, sólo un caso de visceral era HIV, los otros pacientes tenían otra causa de inmunosupresión. De los 5 casos pediátricos, 2 son viscerales y 3 cutáneos.
“Se han postulado métodos muy diversos para el control de la leishmaniosis y diferentes autores discuten la eficacia de las estrategias de control tradicionales. Actualmente dichas estrategias se centran en el diagnóstico precoz de la enfermedad, el tratamiento de humanos y animales infectados, la búsqueda de moléculas idóneas para el tratamiento y el control de la enfermedad, el desarrollo de vacunas y la aplicación de distintas metodologías para la lucha antivectorial. En lo que se refiere a la leishmaniosis humana, es importante reforzar la declaración de los casos. A pesar de que, como ya se ha indicado, en las Islas Baleares la leishmaniosis humana es de declaración obligatoria, al igual que en el resto del territorio de España, lo cierto es que se da una infradeclaración. Para paliarla, en la actualidad coordinamos esfuerzos con el departamento de Anatomía Patológica, Microbiología y Dermatología para poder acercar el número real de pacientes afectos a los declarados”, sostienen los especialistas.

Dra. Mª Magdalena Alcover Amengual
Fuente: Dr. Rocamora / Dra. Alcover
“La Leishmania se controlaría mejor curando al transmisor afecto”
De acuerdo con Rocamora y Alcover, “la Leishmania se controlaría mejor curando al transmisor afecto (perro principalmente, aunque hay otros mamíferos transmisores: liebre, etc.) y al vector. Es difícil curar al transmisor, por no haber terapias 100% efectivas, y mucho más difícil erradicar completamente al vector, aunque se fumigue en época reproductiva. Principalmente, actuaremos frente a los perros afectos mediante tratamiento de los mismos hasta alcanzar la curación clínica. Hay que señalar, no obstante, que la curación parasitológica rara vez se consigue, por lo que los perros recaen al cabo de unos meses. Sin embargo, con el tratamiento se consigue que no resulten infectivos para los flebótomos en los meses posteriores, por lo que se ha sugerido administrar un segundo tratamiento completo antes del verano, estación durante la cual aparecen los vectores”.
Para combatir a los vectores sólo cabe el uso de insecticidas del tipo de los piretroides en las casetas de los perros y en criaderos potenciales de flebótomos.
El diagnóstico de esta enfermedad (leishmaniosis cutánea) es difícil por la inespecificidad de la clínica y el lento crecimiento del parásito en el cultivo [4]. En zonas endémicas, puede hacer sospechar de infección cualquier lesión papular, costrosa, con bordes sobreelevados en zonas expuestas a picaduras. También cualquier lesión que no se cure, que permanezca durante un periodo prolongado de tiempo posterior a la época infectiva de los flebótomos (verano). Ante lesiones con un diagnóstico dudoso, cabría el diagnóstico diferencial de leishmaniosis cutánea.
Varios métodos diagnósticos, entre ellos la PCR
Respecto a los métodos diagnósticos con los que se cuenta, además de la biopsia y el cultivo de ésta, poco realizado por sus dificultades de procesamiento en condiciones idóneas, existen los siguientes:
• Frotis cutáneo y la tinción giemsa, que permiten la observación directa del parásito.
• Biopsia cutánea de la lesión sospechosa de la que, posteriormente, se realiza una PCR (reacción en cadena de la polimerasa), técnica que permite “detectar la presencia del DNA del parásito a pesar de que éste se halle en cantidades ínfimas. Es una técnica de elevada sensibilidad y especificidad. Las muestras que pueden ser procesadas por PCR pueden ser muestras en fresco, biopsias parafinadas y exudado de la lesión recogido en papel Whatman nº3”, indican los Drs.
• Técnicas de detección de anticuerpos de Leishmania (ELISA y Western Blot). Habitualmente son análisis dirigidos al seguimiento de pacientes inmunodeprimidos diagnosticados con muchas lesiones o con leishmaniosis muco-cutánea y/o sistémica. Estas técnicas indirectas ayudan a valorar la curación clínica y el riego de afectación sistémica de la patología.
Fuente: Archivo
Los antimoniales pentavalentes, fármacos de primera elección
Actualmente existen diversas terapias para el tratamiento de la leishmaniosis cutánea. Los compuestos más utilizados son los antimoniales pentavalentes, considerados los fármacos de primera elección del tratamiento y control de la leishmaniosis. “También contamos con la amfotericina B liposomal, la pentamidina, la paramomicina, medicamentos derivados de los imidazoles, immunomoduladores, y un fármaco de administración oral, la miltefosina (WHO 2010). El tratamiento de elección en España es el antimoniato de meglumina (Glucantime®) intralesional. Se tratan diferentes puntos de la lesión, central y en periferia, cada 7-21 días y de 5/7 veces, para saber si el tratamiento es eficaz o no. Si hay lesiones múltiples o leishmaniosis del nuevo mundo, deberemos optar por antimoniato de meglumina intramuscular y, si no funciona, amfotericina B liposomal”, detallan Rocamora y Alcover.
En cuanto a la eficacia del tratamiento intralesional en lesiones únicas y pacientes no inmunodeprimidos, es casi del 100%. En los otros casos, se decidirá cuál es el tratamiento adecuado dependiendo del estado inmunitario del paciente y de los efectos adversos esperables.
Por otro lado -agregan-, “disponemos de cremas de paromomicina tópica al 15% con gentamicina asociada o metilbenzetonio, aunque no hay estudios que aseguren una eficacia elevada, por lo que en nuestra área no se suelen utilizar. Hay casos publicados de la eficacia de la terapia fotodinámica; en ella usamos un fotosensibilizante, que se aplica sobre la lesión, y aplicamos una luz determinada emitida por una lámpara para provocar una reacción química y conseguir la eliminación del parásito secundaria a ésta. Sería una técnica en la que se combina un tratamiento farmacológico y uno físico, en este caso la luz”.
“Destacar también que, en ocasiones, asociamos a los tratamientos el uso de azoles tipo itraconazol o fluconazol. También se ha usado alopurinol como coadyuvante del tratamiento indicado con antimoniales”, indican los facultativos.
Creciente uso de la miltefosina oral en determinados supuestos
Se ha usado concomitantemente a tratamiento intralesional con antimoniales, o bien como terapéutica única, “el imiquimod, molécula que, a través de un proceso de activación de nuestra inmunidad, ayudaría a la eliminación del parásito por nuestro propio cuerpo. Por último, destacar que en nuestro medio se está empezando a usar la miltefosina oral cada vez más en leishmanias resistentes a antimoniales, en afectación múltiple o en pacientes inmunodeprimidos, aunque faltan estudios controlados y comparativos con otros fármacos usados en este tipo de leishmaniosis y que ya están en nuestros protocolos, como antimoniales sistémicos o amfotericina B liposomal”, señalan los expertos.

Fuente: www.farmacosalud.com / IMAGEN DE ARCHIVO
Gentileza del Centro Nacional de Microbiología. Instituto de Salud Carlos III de Madrid
Respecto a la utilidad del calor, la crioterapia y el raspado en las lesiones cutáneas, sus resultados “siempre van asociados al tratamiento con antimoniales intralesionales y se consideran un complemento. Todos ellos ayudan a eliminar el número de parásitos alterando la homeostasis y el confort del parásito en la zona lesional. Si son lesiones pequeñas, en ocasiones se podría optar por la exéresis completa de la lesión”, subrayan.
En lo concerniente a las novedades terapéuticas que se han producido recientemente o que están cerca de producirse en relación a la leishmaniosis cutánea, Rocamora y Alcover refieren que, en medicina y ciencias de la salud en particular, “el desarrollo de sistemas para la terapia y el diagnóstico, la liberación de fármacos... son objeto de gran interés”. Los liposomas han sido utilizados en varias ocasiones como sistemas de liberación de fármacos anti-Leishmania. Estudios in vitro e in vivo, realizados inicialmente con liposomas que contienen derivados del antimonio para el tratamiento de la leishmaniosis, demostraron un amplio incremento del índice terapéutico debido al aumento de la actividad leishmanicida gracias a la facilidad de los liposomas para ser fagocitados por los macrófagos del sistema mononuclear fagocítico.
Los hidrogeles son materiales poliméricos entrecruzados, de origen natural o sintético, en forma de red tridimensional, que se hinchan en contacto con el agua formando materiales blandos y elásticos. Debido a su biocompatibilidad, su estructura y propiedades, son cada vez más utilizados como biomarcadores. Además, al tratarse de materiales inertes, las células y las proteínas no tienden a engancharse a su superficie. “Por lo tanto, destaca su utilización, entre otras aplicaciones biomédicas, como vehículo para la liberación controlada de fármacos. Uno de los objetivos es poder usar el antimoniato de meglumina en liposomas o nanosomas, y que se realicen estudios amplios con moléculas orales que podamos usar con seguridad en nuestros pacientes”, comentan el dermatólogo y la farmacéutica.
Manifestación clínica de la patología: gravedad similar en niños y adultos
Tanto niños como adultos presentan una gravedad similar en lo que es la manifestación clínica de la leishmaniosis cutánea. El factor determinante de la gravedad y extensión de la patología es el estado inmunitario del paciente[5]. En ocasiones, se incide en que la gravedad de la leishmaniosis en niños es mayor que en adultos. Ello puede ser debido a la dificultad de implementar el tratamiento correctamente, al ser de primera elección la terapia intralesional. “Actualmente, la utilización de cremas anestésicas facilita la correcta administración de los fármacos”, resaltan los Drs. Rocamora y Alcover. A pesar de la baja incidencia de casos de leishmaniosis visceral, es más frecuente en niños que en adultos al hacer la comparativa entre individuos de igual estado inmunológico.
La leishmaniosis cutánea tiende a la curación espontánea, pero dejando cicatriz. El tratamiento reduce las cicatrices y previene la diseminación parasitaria y las recaídas[6]. “Aunque la curación espontánea es un fenómeno descrito en estos pacientes, para que se dé, es imprescindible que la inmunidad del huésped sea excelente. Aun en casos de un buen estado inmunitario, sabemos que las lesiones tardan mucho tiempo en curar, en ocasiones 6/12 meses, por lo que hoy en día la población tiende a consultar cuando las lesiones aparecen o llevan unas semanas de evolución y no curan”, matizan los especialistas. Por ello, los dermatólogos suelen intervenir en el proceso de resolución de las lesiones.

Autor/a: George Hodan
Fuente: www.publicdomainpictures.net
La curación depende de la localización y del tipo de lesión: si son lesiones papulares sin costra, no suele haber cicatrización importante; y, si muestran costra central y de mayor tamaño, presentan más secuelas cicatriciales. “Clínicamente suele suceder que, cuando las lesiones pierden la costra inicial –que, en ocasiones, ya ni apreciamos cuando acude el paciente-, sea difícil sospechar el diagnóstico. Así pues, debemos realizar exéresis completa de la lesión o biopsia parcial, en ocasiones sospechando otro tipo de lesiones, tipo carcinoma cutáneo, lo que provocará cicatrices residuales. Gracias a la ayuda de nuevos métodos diagnósticos, como la PCR de muestras en fresco de sangre y/o de exudado de la lesión, recogidas en papel Whatman, conseguimos no provocar cicatrices previas al tratamiento y que el tratamiento resuelva las lesiones sin cicatriz”, explican.
Muchas lesiones se localizan en zonas visibles
Lo ideal sería un diagnóstico rápido, no cruento ni que dejase cicatriz, y un tratamiento efectivo y rápido no cicatricial, que minimice las secuelas estéticas: muchas lesiones se localizan en zonas visibles, como puede ser la cara, los brazos y las extremidades inferiores. En resumen, un diagnóstico y tratamiento rápido contribuirán a reducir la posibilidad de cicatrices o, en el caso de que se den, ayudarán a que su apreciación sea mínima. “Por todo ello -recalcan-, deberíamos ser proactivos a la hora de tratar a estos pacientes y no dejar evolucionar las lesiones al desconocer cómo está nuestro paciente inmunitariamente y cómo evolucionará la patología”.
“Normalmente, si la inmunidad del paciente es la adecuada, no tendremos leishmaniosis cutánea crónica, pero sí lesiones que durarán tiempo y serán difíciles de tratar; por lo tanto, abogamos por una actuación precoz. Como hemos comentado, la manifestación clínica de la enfermedad dependerá del estado inmunitario del paciente y de la especie de Leishmania. Un hecho a tener en cuenta es que, en los casos de leishmaniosis en inmunodeprimidos, en la forma mucocutánea (casi siempre de leishmaniosis importadas) y en leishmanias del nuevo mundo, es más frecuente la recidiva a pesar de un tratamiento correcto”, advierten Rocamora y Alcover.
Referencias
1. www.farmacosalud.com “La leishmaniosis nunca se transmite directamente del perro al hombre”. Noticia con declaraciones del veterinario Xavier Roura. Diciembre, 2014. http://farmacosalud.com/la-leishmaniosis-se-transmite-directamente-del-perro-al-hombre-o-viceversa/
2. Pérez Gutiérrez ME., Izquierdo Caballero R., Montalbán E., Hernández R., Verne E. ‘Leishmaniasis cutánea’. An Pediatr (Barc). 2010 Feb;72(2). Páginas 99-162 DOI: 10.1016/j.anpedi.2009.09.014 http://www.analesdepediatria.org/es-leishmaniasis-cutanea-articulo-S1695403309005967
3. 46º Congreso Nacional de Dermatología y Venereología. AEDV 2018. Programa Científico. https://web.congresoaedv.net/storage/P_Preliminar%20AEDV_2018.pdf
4. Del Rosal Rabes T., Baquero-Artigao F., García Miguel MJ. ‘Leishmaniasis cutánea’. Rev Pediatr Aten Primaria vol.12 no.46 Madrid abr./jun. 2010. Difusión online Scielo http://scielo.isciii.es/scielo.php?script=sci_arttext&pid=S1139-76322010000300009
5. M. Magdalena Alcover, Vicenç Rocamora, M. Carmen Guillén, Diana Berenguer, Marta Cuadrado, Cristina Riera, Roser Fisa. Case Report: Diffuse Cutaneous Leishmaniasis by Leishmania infantum in a Patient Undergoing Immunosuppressive Therapy: Risk Status in an Endemic Mediterranean Area. Am. J. Trop. Med. Hyg., 98(5) 2018, pp. 1313 – 1316 doi: 10.4269/ajtmh.17-0769
6. Del Rosal Rabes T., Baquero-Artigao F., Gómez Fernández C., García Miguel MJ., De Lucas Laguna R. ‘Tratamiento de la leishmaniasis cutánea con anfotericina B liposomal’. An Pediatr. Vol. 73. Núm. 2. Agosto 2010. Páginas 67-112. DOI: 10.1016/j.anpedi.2010.05.014 http://www.analesdepediatria.org/es-tratamiento-leishmaniasis-cutanea-con-anfotericina-articulo-S169540331000278X




