Redacción Farmacosalud.com
Las compañías Eisai y Biogen anuncian que han obtenido resultados positivos en un ensayo clínico fase 3 con lecanemab, un anticuerpo que actúa contra la proteína beta-amiloide en el tratamiento del deterioro cognitivo leve causado por la enfermedad de Alzheimer (EA) en estadío temprano. En concreto, el uso de lecanemab reduce, a los 18 meses, un 27% el deterioro clínico en la escala cognitiva y funcional global en comparación con placebo.
La acumulación de beta amiloide en el cerebro es un conocido precursor de la EA. Antes de que aparezcan los primeros síntomas, estos depósitos van formando placas entre las neuronas que resultan tóxicas y son responsables de la progresiva degeneración cognitiva de las personas afectadas.

Autor/a: Enric Arandes
Fuente: E. Arandes / www.farmacosalud.com
Ensayo Clarity
Los beneficios aportados por el nuevo fármaco se han observado en el ensayo Clarity, aleatorizado y doble ciego, y en el que han participado 1.795 personas con Alzheimer poco avanzado, informan las compañías mediante un comunicado conjunto.
"El anuncio da a los pacientes y sus familias la esperanza de que lecanemab, si se aprueba, pueda retrasar potencialmente la progresión de la enfermedad de Alzheimer y proporcionar un impacto clínicamente significativo en la cognición y la función", dice Michel Vounatsos, director ejecutivo de Biogen. “Es importante destacar que el estudio muestra que la eliminación de la proteína beta-amiloide agregada en el cerebro se asocia con una desaceleración de la enfermedad en pacientes en la etapa inicial de la afección”, agrega.
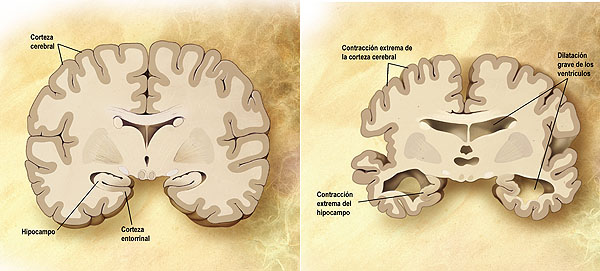
Comparación entre un cerebro normal y un cerebro afectado de Alzheimer. Esquema de un corte frontal de dos cerebros. El de la izquierda es un cerebro sano y el de la derecha uno que padece dicha enfermedad neurológica
Autor/a de la imagen: COMPARISONSLICE_HIGH.JPG: *derivative work: Garrondo (talk) SEVERESLICE_HIGH.JPG: ADEAR: "Alzheimer's Disease Education and Referral Center, a service of the National Institute on Aging." PRECLINICALSLICE_HIGH.JPG: ADEAR: "Alzheimer's Disease Education and Referral Center, a service of the National Institute on Aging." - COMPARISONSLICE_HIGH.JPG
Fuente: Wikipedia
En julio de 2022, la Agencia del Medicamento de los Estados Unidos (FDA) aceptó la solicitud de licencia biológica (BLA) de Eisai para lecanemab bajo la vía de aprobación acelerada y concedió la revisión prioritaria del medicamento. La FDA acordó que los resultados de Clarity pueden servir como estudio de confirmación para verificar el beneficio clínico de lecanemab, según se lee en dicho comunicado.




