Redacción Farmacosalud.com
Ya está disponible en España Alofisel® (darvadstrocel), la primera terapia celular alogénica basada en células madre, descubierta, desarrollada y fabricada íntegramente en territorio español. El nuevo fármaco está indicado para el tratamiento de fístulas perianales complejas en pacientes adultos con enfermedad de Crohn (EC). Estos sujetos requieren, tradicionalmente, de una media de cinco intervenciones a lo largo de la historia natural de la enfermedad y éstas generalmente se asocian a morbilidades como la incontinencia fecal y más posibilidades de requerir un estoma permanente (apertura quirúrgica en la superficie del abdomen). Según declara a www.farmacosalud.com el jefe del Departamento de Cirugía General y Digestiva de la Fundación Jiménez Díaz (Grupo Quirónsalud), en Madrid, el Prof. Damián García Olmo, el novedoso tratamiento da un vuelco radical a toda esta problemática: “Ningún paciente tratado con darvadstrocel ha presentado incontinencia fecal como consecuencia de la inyección celular. Por los ensayos clínicos sabemos que el 60% presenta un cierre completo y casi el 80% presenta mejorías. Sin duda, en el futuro veremos un menor número de estomas como consecuencia de estos resultados”.
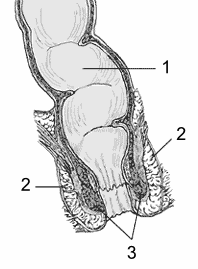
Diagrama del ano y el recto. 1: recto 2: esfínter exterior 3: esfínter interior
Autor/a de la imagen: U.S. Government National Institutes of Health
http://digestive.niddk.nih.gov/ddiseases/pubs/fecalincontinence/images/anorectum.gif
Fuente: Wikipedia
Darvadstrocel, comercializada por Takeda y catalogada como la primera terapia celular alogénica aprobada en Europa, representa un proyecto de biotecnología capaz de atraer inversión extranjera y posicionar a España en el mapa global de la terapia celular.
Una fístula simple es aquella que prácticamente no afecta al aparato esfinteriano y, por ello, su tratamiento quirúrgico no produciría incontinencia fecal. Por el contrario, una fístula compleja es aquella que compromete seriamente el esfínter anal, por lo que su tratamiento implica un riesgo serio de provocar incontinencia fecal. “Esto es lo fundamental -sostiene García Olmo-, aunque existen otro tipo de matices para hablar de complejidad, como la recurrencia o el número de trayectos”.
“Maniobras quirúrgicas muy respetuosas con el aparato esfinteriano”
Las células madre tienen propiedades regenerativas únicas, lo que significa que pueden tener diversas aplicaciones clínicas, como en este caso en enfermedades inmunoreguladoras o en trastornos inflamatorios (según patente del CSIC, o Consejo Superior de Investigaciones Científicas). Las células madre en las que se basa esta terapia proceden de tejido adiposo de donantes. Tras someterse a un riguroso proceso científico para ser convertidas en una terapia capaz de potenciar la capacidad regeneradora del organismo (según patente de la UAM, o Universidad Autónoma de Madrid), se aplican al paciente mediante un proceso quirúrgico.
Este innovador tratamiento constituye un hito de la ciencia española del que se beneficiarán pacientes de todo el mundo. “La cirugía que se practica para la inyección celular se define como ‘mínimamente invasiva’. Esto significa que son maniobras quirúrgicas muy respetuosas con el aparato esfinteriano y que, por ello, preservan la continencia del paciente. Básicamente consisten en la limpieza profunda de los trayectos fistulosos y el cierre del orificio interno”, explica el experto.
La llegada de darvadstrocel es un ejemplo de colaboración público-privada en España. En su desarrollo, inicialmente liderado por la Universidad Autónoma de Madrid y el Consejo Superior de Investigaciones Científicas, han participado 21 hospitales españoles. A través de un comunicado, el Prof. García Olmo señala que la nueva terapia “ofrece una alternativa novedosa, de calidad y seguridad sobresalientes y mínimamente invasiva para el tratamiento de pacientes con fístulas perianales complejas que no responden a las terapias actualmente disponibles y que han tenido hasta ahora opciones limitadas de tratamiento".
Así, el especialista, y uno de los principales investigadores responsables del desarrollo de Alofisel®, considera que su comercialización “es un éxito del sistema de ciencia e innovación español que, junto al sistema sanitario, ha desarrollado la primera terapia celular aprobada en Europa”. En este sentido, hace especial hincapié en el hecho de que toda la investigación y desarrollo de este nuevo fármaco se haya conducido desde territorio español, y que actualmente toda la fabricación del medicamento celular se haga en la Comunidad de Madrid, “lo que sitúa a España a la vanguardia de la investigación en este ámbito a nivel mundial”.
Tres pilares: control de la inflamación, inmunomodulación y regeneración celular
Darvadstrocel es un medicamento vivo y la primera y única terapia celular aprobada para las fístulas perianales complejas derivadas de la enfermedad de Crohn, la complicación más incapacitante de esta patología, que afecta a más de un 25% de los pacientes que la sufren[1-4], y para la que no existen tratamientos farmacológicos eficaces a largo plazo. El tratamiento aprobado ofrece un nuevo mecanismo de acción basado en tres pilares: el control de la inflamación, la inmunomodulación y la regeneración celular.
Se administra a través de un único procedimiento quirúrgico mínimamente invasivo y puede evitar las reiteradas intervenciones a las que hasta hoy se tenían que someter los pacientes con estas lesiones, así como sus secuelas y complicaciones. Los afectados de fístulas perianales requieren de una media de cinco intervenciones a lo largo de la historia natural de la enfermedad y estas operaciones generalmente se asocian a morbilidades como la incontinencia fecal y más posibilidades de requerir un estoma permanente (apertura quirúrgica en la superficie del abdomen)[5].
Takeda ha asumido un papel de liderazgo en la investigación con células madre. Este hecho supuso, en marzo de 2018, la aprobación centralizada de comercialización para darvadstrocel por parte de la Unión Europea. Su aprobación se ha basado en el ensayo pivotal fase III ADMIRE-CD, cuyos resultados mostraron una superioridad de darvadstrocel estadísticamente significativa frente al grupo control en el objetivo primario de eficacia, que era alcanzar la remisión combinada (cierre de las fístulas) a las 24 semanas. Al respecto, García Olmo considera que “es la primera vez que se alcanza este objetivo en un ensayo con células en el que existe cirugía”.

Autor/a: Free-Photos
Fuente: Pixabay (free photo)
Re-tratamiento si aparecen nuevas crisis de supuración
Los datos adicionales de seguimiento indican que darvadstrocel cuenta con una eficacia sostenida en el tiempo, ya que fue capaz de mantener e incluso mejorar las tasas de remisión a largo plazo (55% a las 52 semanas)[6]. Darvadstrocel no se aplica a modo de terapia de mantenimiento con la que evitar recidivas, tal y como certifica el facultativo: “En la actualidad, darvadstrocel solo está indicado en la fístula perianal con enfermedad luminal leve o moderada. Esto significa que no se dirige al tratamiento sistémico de la enfermedad, sino sólo al control de la fístula perianal. Por ello, no tiene sentido la prevención de recidivas, pero sí el re-tratamiento si aparecen nuevas crisis de supuración perianal en el contexto de enfermedad luminal controlada”.
Asimismo, la nueva terapia celular ha demostrado rapidez de acción consiguiendo la remisión clínica dos veces más rápidamente que los pacientes del grupo control (el 50% de los pacientes que alcanzan la remisión clínica lo hacen en una media de 6,7 semanas con darvadstrocel, frente a las 14,6 semanas en el grupo control). Además, el medicamento obtuvo estos beneficios con un perfil de seguridad y tolerabilidad similar al del grupo control. Según García Olmo, “no hay descritos efectos adversos graves con darvadstrocel. Los efectos adversos leves como el dolor o sangrado se han relacionado más con la técnica quirúrgica y son de muy poca intensidad”.
Sin contraindicaciones absolutas
Por ahora -añade-, tampoco se puede decir que darvadstrocel presente “contraindicaciones absolutas, porque lo que no hay es investigación suficiente en determinados escenarios. De momento, la evidencia científica sólo ha probado sus efectos en pacientes con enfermedad luminal leve o moderada”.
La fase de ensayos clínicos, realizada en varios países europeos, ha sido liderada por investigadores españoles y en ella han participado un total de 21 centros médicos de diferentes comunidades autónomas. Esta terapia es un excelente ejemplo de la alta calidad de la ciencia en España y el potencial ilimitado que se puede lograr a través de la colaboración entre instituciones públicas y privadas. El nuevo tratamiento con células madre se ha desarrollado en colaboración con instituciones académicas, entidades públicas de investigación y centros hospitalarios, y ahora los pacientes españoles que la necesiten podrán beneficiarse de ella.

(de izq. a dcha): Dr. Javier Maira Vidal, responsable del Área de Estrategia Comercial e Internacionalización de la Vicepresidencia Adjunta de Transferencia del Conocimiento del CSIC; Stefanie Granado, directora general de Takeda Iberia; Prof. Damián García Olmo; jefe del Servicio de Cirugía General y Digestiva de la Fundación Jiménez Díaz, y Fidel Rodríguez Batalla, director de la Fundación Universidad Autónoma de Madrid (FUAM)
Fuente: Takeda / Fundación Jiménez Díaz
Stefanie Granado, directora general de Takeda Iberia, destaca el compromiso de Takeda con la I + D en España mediante el desarrollo de terapias innovadoras con el potencial de transformar la vida de las personas, y con el empleo de alta cualificación en este país. “Takeda mantiene un firme compromiso con la búsqueda de soluciones a necesidades clínicas no cubiertas a través de medicamentos innovadores. La innovación tiene que ser también accesible y en nuestro compromiso con la sostenibilidad del sistema hemos firmado un acuerdo de riesgo compartido con el Ministerio de Sanidad”.
Y es que, como resume el Prof. García Olmo, durante 17 años de investigación rigurosa, se han unido los esfuerzos del ámbito hospitalario -con la Fundación Jiménez Díaz a la cabeza, que ha finalizado el proceso de ‘puesta a punto’ del medicamento y que mantiene una línea de investigación avanzada sobre mejoras del producto y nuevas indicaciones, seguida por los hospitales Clínico de Barcelona (donde el Dr. Julián Panés lideró el ensayo clínico internacional en fase III) y Universitario La Paz de Madrid (donde se hicieron las primeras fases clínicas)-, el sector de los laboratorios (la Red de Terapia Celular Española -TERCEL- del Instituto Carlos III del Ministerio de Sanidad) y la esfera empresarial. Todo ello ha dado lugar a una “transferencia de conocimiento para resolver una necesidad médica no cubierta: las fístulas de los pacientes con enfermedad de Crohn”, a partir de la investigación inicial desarrollada por el CSIC y la UAM, indica.
Evaluación en fístulas perianales criptoglandulares y fístulas de otras partes del organismo
“Las propiedades antiinflamatorias de las células madre mesenquimales derivadas de la grasa (darvadstrocel) -destaca el jefe del Departamento de Cirugía General y Digestiva de la Fundación Jiménez Díaz- hacen pensar en que pronto tendrán más indicaciones”. De hecho, se está evaluando su uso en el tratamiento de la fístula perianal compleja de origen criptoglandular y en otras fístulas en diferentes partes del organismo. Productos celulares similares se están evaluando para lesiones osteomusculares (artrosis, artritis) y para producir neovascularización en pacientes con arteriopatías diabéticas.

Imagen relativa a la industria farmacéutica (IMAGEN DE ARCHIVO)
Fuente: www.farmacosalud.com
Las instalaciones de Tres Cantos (Madrid) constituyen la única planta de Takeda aprobada para la fabricación comercial de este tipo de medicamentos, lo que convierte a este centro en un referente a nivel mundial. La planta suministra esta terapia tanto para fines terapéuticos como de investigación. En 2019, Takeda ha realizado una inversión de 10 millones de euros para duplicar la capacidad de producción de la fábrica. A nivel logístico, la entrega de ese fármaco supone un verdadero reto. En tan solo 48 horas, la terapia fabricada en Madrid llega a los pacientes de todo el continente, un hecho que requiere un preciso sistema de seguimiento y trazabilidad que permite controlar todos los pasos del proceso a lo largo de la cadena de suministro.
La aplicación del nuevo tratamiento requiere la formación de los profesionales sanitarios. En este sentido, Takeda está implementando un programa de certificación para una óptima administración de la terapia. En España, la incidencia de la enfermedad de Crohn y la colitis ulcerosa se ha multiplicado por 10 en los últimos 25 años y actualmente se detectan unos 2.000 nuevos casos, con un incremento del 2,5% anual[7]. Se estima que hay unos 150.000 pacientes en territorio español que sufren y conviven de manera habitual con diarrea, dolor abdominal, pérdida de peso, malestar general, fatiga y fiebre, entre otros síntomas.
Referencias
1. Georgiadou E, Brandes A, Fanter L, et al., P804 Retrospective observational claims data analysis of German statutory health insurance (SHI) patients with Crohn’s disease reveals low prevalence of perianal fistulas (3.4%), but high rates of biologic treatment and inpatient surgical intervention. J Crohns Colitis. 12, S518–S519. 2018.
2. Spanish Epidemiological and Economic Study Group on Crohn’s Disease. Epidemiological and clinical features of Spanish patients with Crohn’s disease. Eur J Gastroenterol Hepatol. 1999; 11:1121-1127.
3. Chaparro M, Burgueno P, Vera I, et al., Epidemiological Study of Perianal Fistulas in Patients with Crohn’s Disease. Gastroenterology. 2011; 140(5): S1: S-736.
4. Göttgens KWA, Jeuring SFG, Sturkenboom R, et al., Time trends in the epidemiology and outcome of perianal fistulizing Crohn’s disease in a population-based cohort. Eur J Gastroenterol Hepatol. 2017. doi: 10.1097/MEG.0000000000000840.
5. Panés J, García-Olmo D, Van Assche G, et al., Expanded allogeneic adipose-derived mesenchymal stem cells (Cx601) for complex perianal fistulas in Crohn’s disease: a phase 3 randomized, double-blind controlled trial. The Lancet. 2016; 388(10051): 1281-90.
6. European Medicines Agency (EMA) Committee For Medicinal Products For Human Use. Alofisel, INN-darvadstrocel EPAR Annex | Summary of Product Characteristics (2018). Available at: http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_-_Product_Information/human/004258/WC500246474.pdf. Published April 2018. Accessed August 2018.
7. Datos de ACCU España: https://www.accuesp.com/la-enfermedad-inflamatoria-intestinal-crece-un-2-5-cada-ano-en-espana





