La Enfermedad de Neurona Motora (EMN) engloba un grupo heterogéneo de enfermedades que afectan a las neuronas motoras. Entre esas afecciones, está la Esclerosis Lateral Amiotrófica (ELA), uno de los fenotipos más frecuentes. La EMN, aunque es algo más extensa que el concepto ELA, se usa en muchos ámbitos como equivalente. Es una enfermedad neurodegenerativa, de carácter esporádico o hereditario, rápidamente progresiva, caracterizada por una pérdida de las neuronas motoras (superior y/o inferior) a nivel de la corteza cerebral y/o de la médula espinal[1] que conduce a la atrofia muscular y parálisis de la musculatura, llevando a la muerte del paciente en pocos años. El proceso por el que se produce esta pérdida neuronal no es bien conocido, aunque se han descrito múltiples mecanismos implicados. Los fenotipos al diagnóstico caracterizan la evolución de la afección, siendo las formas de inicio bulbar alrededor del 25% de los casos, y las formas de inicio espinal el 75%.

Elisabet Romero Gangonells
Fuente: E. Romero Gangonells / Hospital de Bellvitge
Un factor conocido como uno de los principales indicadores de mal pronóstico de la enfermedad es la pérdida de peso[2], siendo un factor clave en la evolución de la misma y pudiendo ser una de las manifestaciones iniciales. Cuando la pérdida de peso respecto al peso habitual es >10%, se produce una caída de la capacidad vital forzada (CVF)[3,4] que incrementa el riesgo de muerte hasta un 45% con respecto a aquellos que presentan una pérdida de peso menor al 5%[5]. El estado nutricional del paciente con EMN se ve comprometido por múltiples afectaciones propias de la progresión de la enfermedad[6]: anorexia, dificultades en la masticación[7], disfagia[8], debilidad en las extremidades superiores, y un estado de hipermetabolismo[9,10]. Este conjunto de circunstancias da lugar a una pérdida de peso que es parte de la progresión natural de la patología.
Una de las hipótesis más estudiadas y consolidadas en la pérdida de peso es el incremento del gasto energético en reposo[11] como consecuencia del estado de hipermetabolismo[12] descrito en el 50-60% de los pacientes con ELA, y que se mantiene pese a la evolución de la enfermedad en un 80% de los casos[9,13]. Otras de las afectaciones que comprometen el estado nutricional del paciente con EMN son los trastornos de la deglución[14] y la sintomatología de disfagia orofaríngea, ampliamente descritos en la literatura[15,16], que afectan hasta al 80% de los pacientes[17].
En los fenotipos bulbares, la disfagia aparece de forma temprana, mientras que en las formas de predominio espinal puede aparecer durante la evolución de la enfermedad, desarrollándola hasta un 80% de los pacientes[18]. La disfagia comporta una dificultad para la deglución que provoca atragantamientos y paso del alimento a la vía respiratoria (penetraciones y aspiraciones), comprometiendo así la seguridad de la deglución. Por otro lado, la disfagia también supone una pérdida de eficacia de la deglución, que lleva a la pérdida de peso, malnutrición y deshidratación[19]. En definitiva, la disfagia influye negativamente en la evolución de la enfermedad de motoneurona comprometiendo el estado nutricional y la capacidad respiratoria del paciente.
En la fase orofaríngea de la deglución interviene musculatura estriada o voluntaria, que está controlada por la primera y segunda neuronas motoras, afectadas en la EMN[20], e intervienen múltiples elementos que son coordinados por estructuras del tronco encefálico y de la corteza cerebral[21]. En la EMN están descritas alteraciones de la fase oral y faríngea con alimentos líquidos[8] y semisólidos que requieren modificaciones de la textura de los alimentos a partir del 7º mes de evolución de la sintomatología bulbar[18]. Las alteraciones de la fase oral vienen dadas por un transporte enlentecido del bolo alimentario desde la boca hasta la faringe, incluso en pacientes sin sintomatología bulbar aparente[18]. Las alteraciones faríngeas son consecuencia de una constricción faríngea debilitada[22] que puede dar lugar a residuos faríngeos, que junto con un cierre del vestíbulo laríngeo incompleto frecuente en la EMN, pueden conducir a la penetración del bolo alimenticio en la vía respiratoria, y llegar a darse una aspiración de bolo alimenticio.
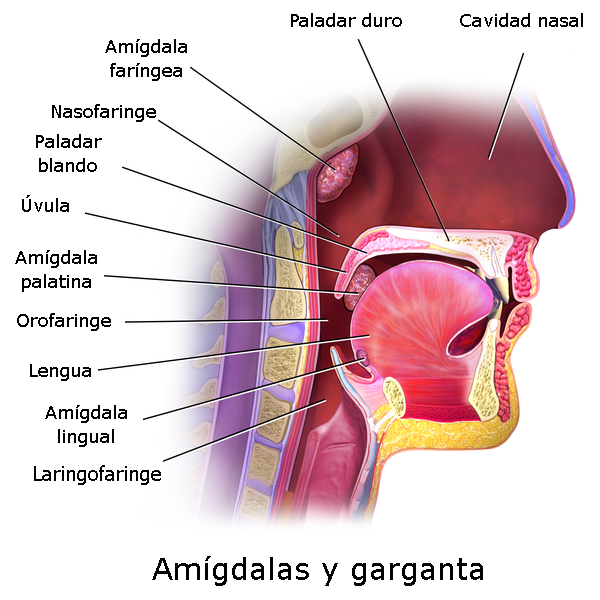
Anatomía de la boca y faringe
Autor/a de la imagen: Modificado de Blausen - WIKIMEDIA COMMONS. File:Blausen 0861 Tonsils&Throat Anatomy2.png
Fuente: Wikipedia
Dada la influencia de la disfagia, tanto en el empeoramiento de la calidad de vida, como en la supervivencia, se hace necesario valorar la disfagia desde el inicio de la afección, incluso en aquellos pacientes aparentemente asintomáticos. Hay que tener en cuenta que puede existir una afectación subclínica de disfagia, y es esencial evaluarla para el correcto abordaje terapéutico de los pacientes con EMN.
Existen estudios que apuntan la necesidad de crear escalas específicas de valoración de la disfagia para patologías neuromusculares como la ELA[23] porque en la actualidad no existen cuestionarios para el cribado de la disfagia específicos para población con EMN. El test de cribado de la disfagia más ampliamente utilizado es el EAT-10 (Eating Assessment Tool, despistaje de la disfagia)[24], validado en diferentes poblaciones y patologías, y también en una subpoblación de ELA[25]. No es un cuestionario específico para población con EMN, y en la práctica clínica habitual se intuyó que el test EAT-10 infravaloraba la disfagia en pacientes con EMN. Por este motivo se sometió a estudio, junto con la escala específica de valoración funcional de la deglución en pacientes con ELA, la ALS-SS (ALS Swallowing Scores)[26]. Esta última menos utilizada como tal en la práctica habitual porque se ha incluido de forma simplificada en la ALSFR-R (ALS Functional Rating Scale Revised)[27], para la valoración global del paciente con EMN.
Se planteó un estudio para valorar la sensibilidad y especificidad del cuestionario de disfagia más utilizado, el EAT-10, y la escala de valoración de la disfagia, la ALS-SS. Además, se evaluó también un cuestionario validado sobre la calidad de vida del paciente con disfagia (Swal-QoL)[28] con el objetivo de estudiar el subapartado de frecuencia de síntomas, para definir su utilidad en un grupo de pacientes con Enfermedad de Neurona Motora. Todos los resultados obtenidos con los cuestionarios fueron comparados con la técnica gold standard para el diagnóstico de la disfagia (videofluoroscopia, en este caso), donde se confirmó que el test EAT-10 presentaba una sensibilidad y especificidad bajas en este grupo de población (resultados pendientes de publicación).

Equipo de profesionales de la Unidad Funcional de Motoneurona del Hospital Universitario de Bellvitge
Fuente: E. Romero Gangonells / Hospital de Bellvitge
Además, gracias a la técnica de la videofluoroscopia (VFS) se pudieron evaluar los trastornos de la deglución que aparecen en distintos momentos evolutivos de la enfermedad. Se estudiaron 46 pacientes de los 154 visitados en la Unidad Funcional de Motoneurona del Hospital Universitario de Bellvitge (Centro de Referencia del Sistema Nacional de Salud, CSUR) entre septiembre de 2017 y julio de 2018. Entre los resultados obtenidos en dicho estudio, se observó que un 82.2% de los pacientes presentó disfagia, a pesar de que el test EAT-10 detectó un 57.8% y la subescala ALS-SS un 60%. El apartado de frecuencia de síntomas del cuestionario SwalQoL presentó mejores resultados, sobre todo para detectar los pacientes que realmente no tenían disfagia. En el 97% de los casos hubo alteración de alguna de las fases de la deglución, siendo en el 47% de los pacientes, en la fase preoral; en el 89%, en la fase oral y en el 97% de los pacientes, en la fase faríngea. Alrededor de un 10% de los pacientes sin sintomatología de afectación bulbar presentaron alteraciones de seguridad en la deglución cuando se analizó la VFS.
Con el uso de la VFS y hasta el momento, podemos concluir que en la ELA hay alteraciones de la deglución desde los primeros síntomas de afectación bulbar y que el momento de aparición de la afectación bulbar condiciona la progresión de la disfagia[18].
Examinando los test de cribado disponibles, constatamos que los pacientes con EMN subestiman la sintomatología de disfagia, y que la videofluoroscopia sigue siendo necesaria para detectar las alteraciones de la seguridad y eficacia de la deglución y obtener un abordaje nutricional más personalizado.
Referencias
1. Brain J, Walton J. Brain’s diseases of the nervous System. Oxford: Oxford University Press; 1969.
2. Langmore SE, Kasarskis EJ, Manca ML, Olney RK. Enteral tube feeding for amyotrophic lateral sclerosis/motor neuron disease. Cochrane Database of Systematic Reviews. John Wiley and Sons Ltd; 2006.
3. Desport, J C , Preux, PM, Truong CT, Courat, L, Vallat JM CP. Nutritional assessment and survival in ALS patients. Amyotroph Lateral Scler Other Mot Neuron Disord. 2000;1(2):91–6.
4. Kasarskis EJ, Berryman S, Vanderleest JG, Schneider a R, McClain CJ. Nutritional status of patients with amyotrophic lateral sclerosis: relation to the proximity of death. Am J Clin Nutr. 1996;63:130–7.
5. Marin B, Arcuti S, Jesus P, Logroscino G, Copetti M, Fontana A, et al. Population-Based Evidence that Survival in Amyotrophic Lateral Sclerosis Is Related to Weight Loss at Diagnosis. Neurodegener Dis. 2016 Feb;16(3–4):225–34.
6. Marin B, Desport JC, Kajeu P, Jesus P, Nicolaud B, Nicol M, et al. Alteration of nutritional status at diagnosis is a prognostic factor for survival of amyotrophic lateral sclerosis patients. J Neurol Neurosurg Psychiatry. 2011;82(6):628–34.
7. Riera-Punet N, Martinez-Gomis J, Willaert E, Povedano M, Peraire M. Functional limitation of the masticatory system in patients with bulbar involvement in amyotrophic lateral sclerosis. J Oral Rehabil. 2017;45(3):204–10.
8. Andrenelli E, Galli FL, Gesuita R, Skrami E, Logullo FO, Provinciali L, et al. Swallowing impairments in Amyotrophic Lateral Sclerosis and Myotonic Dystrophy type 1: Looking for the portrait of dysphagic patient in neuromuscular diseases. NeuroRehabilitation. 2018;42(1):93–102.
9. Bouteloup C, Desport JC, Clavelou P, Guy N, Derumeaux-Burel H, Ferrier a., et al. Hypermetabolism in ALS patients: An early and persistent phenomenon. J Neurol. 2009;256(8):1236–42.
10. Dupuis L, Pradat P-F, Ludolph AC, Loeffler J-P. Energy metabolism in amyotrophic lateral sclerosis. Lancet Neurol. 2011 Jan 1;10(1):75–82.
11. Kasarskis EJ, Mendiondo MS, Matthews DE, Mitsumoto H, Tandan R, Simmons Z, et al. Estimating daily energy expenditure in individuals with amyotrophic lateral sclerosis. Am J Clin Nutr. 2014 Apr;99(4):792–803.
12. Ngo ST, Steyn FJ, McCombe PA. Body mass index and dietary intervention: Implications for prognosis of amyotrophic lateral sclerosis. J Neurol Sci. 2014 May 15;340(1–2):5–12.
13. Desport JC, Torny F, Lacoste M, Preux PM, Couratier P. Hypermetabolism in ALS: Correlations with clinical and paraclinical parameters. Neurodegener Dis. 2005;2(3–4):202–7.
14. Kidney D, Alexander M, Corr B, O’Toole O, Hardiman O. Oropharyngeal dysphagia in amyotrophic lateral sclerosis: Neurological and dysphagia specific rating scales. Amyotroph Lateral Scler Other Mot Neuron Disord. 2004;5(3):150–3.
15. Murono S, Hamaguchi T, Yoshida H, Nakanishi Y, Tsuji A, Endo K, et al. Evaluation of dysphagia at the initial diagnosis of amyotrophic lateral sclerosis. Auris Nasus Larynx. 2015;
16. Waito AA, Valenzano TJ, Peladeau-Pigeon M, Steele CM. Trends in Research Literature Describing Dysphagia in Motor Neuron Diseases (MND): A Scoping Review. Vol. 32, Dysphagia. Springer New York LLC; 2017. p. 734–47.
17. Chiò A, Logroscino G, Traynor BJ, Collins J, Simeone JC, Goldstein LA, et al. Global epidemiology of amyotrophic lateral sclerosis: A systematic review of the published literature. Neuroepidemiology. 2013;41(2):118–30.
18. Higo R, Tayama N, Nito T. Longitudinal analysis of progression of dysphagia in amyotrophic lateral sclerosis. Auris Nasus Larynx. 2004 Sep 1;31(3):247–54.
19. Greenwood DI. Nutrition management of amyotrophic lateral sclerosis. Nutr Clin Pract. 2013 Jun;28(3):392–9.
20. Ludlow CL. Central Nervous System Control of Voice and Swallowing. Vol. 32, Journal of Clinical Neurophysiology. 2015. p. 294–303.
21. Carrion Bolorino S. Tesis doctoral: Fisiopatología de las complicaciones nutricionales asociadas a la disfagia orofaríngea en la población anciana.
22. Waito AA, Tabor-Gray LC, Steele CM, Plowman EK. Reduced pharyngeal constriction is associated with impaired swallowing efficiency in Amyotrophic Lateral Sclerosis (ALS). Neurogastroenterol Motil. 2018 Dec 1;30(12).
23. Wada A, Kawakami M, Liu M, Otaka E, Nishimura A, Liu F, et al. Development of a new scale for dysphagia in patients with progressive neuromuscular diseases: the Neuromuscular Disease Swallowing Status Scale (NdSSS). J Neurol [Internet]. 2015 Oct 4;262(10):2225–31. Available from: http://link.springer.com/10.1007/s00415-015-7836-y
24. Peláez RB, Sarto B, Segurola H, Romagosa A, Puiggrós C, Vázquez C, et al. Traducción y validación de la versión en español de la escala EAT-10 (Eating Assessment Tool-10) para el despistaje de la disfagia. Nutr Hosp. 2012;27(6):2048–54.
25. K.Plowman E, Tabor L, Robison R, Gaziano J, Dion C. Discriminant Ability of the Eating Assessment Tool to Predict Aspiration in Individuals with Amyotrophic Lateral Sclerosis. Neurogastroenterol Motil. 2016;150(2):137–43.
26. Hillel AD, Miller RM, Yorkston K, McDonald E, Norris FH. Amyotrophic Lateral Sclerosis Severity Scale. Neuroepidemiology. 1989;(8):142–50.
27. Cedarbaum JM, Stambler N, Malta E, Fuller C, Hilt D. The ALSFRS-R: a revised ALS functional rating scale that incorporates assessments of respiratory function [Internet]. Vol. 169, Journal of the Neurological Sciences. 1999. Available from: www.elsevier.com/locate/jns
28. McHorney CA, Robbins JA, Lomax K, Rosenbek JC, Chignell K, Kramer AE, et al. The SWAL-QOL and SWAL-CARE outcomes tool for oropharyngeal dysphagia in adults: III. Documentation of reliability and validity. Dysphagia. 2002;17(2):97–114.




