Dr. Gilberto E. Chéchile Toniolo
Introducción
La implantación de fuentes radiactivas implantadas por vía transperineal para el tratamiento del cáncer de próstata se utiliza desde 19811. En 1995 Stone y Stock describieron la técnica de braquiterapia (BT) en tiempo real dinámico, lo que representó un gran avance en la implantación de las fuentes radiactivas mejorando los resultados oncológicos y funcionales2.
La BT de baja tasa con Yodo125 es uno de los tratamientos radiantes recomendados para el cáncer de próstata localizado, ya que brinda similares resultados oncológicos que la prostatectomía (PR) radical con una menor incidencia de incontinencia, o que la radioterapia externa (RT) con menor irradiación de los tejidos circundantes3.

Dr. Gilberto Chéchile Toniolo
Fuente: Dr. Chéchile Toniolo
Dentro de las razones que han llevado a que un elevado porcentaje de pacientes elijan la BT como tratamiento de su tumor prostático se encuentran la menor incidencia de disfunción eréctil o de incontinencia de orina, la rápida incorporación a su actividad laboral, con menos de 24 horas de ingreso hospitalario, una convalecencia de pocos días y, sobre todo, un excelente control oncológico de la enfermedad3.
Se han publicado diferentes estudios que comparan la BT con la cirugía radical4-6. Ninguno de ellos demostró superioridad en el manejo del cáncer de próstata localizado de bajo riesgo. Otros estudios alcanzan resultados similares comparando la BT con la RT externa.
Inicialmente, la BT se reservaba para los casos con cáncer de próstata de bajo riesgo, pero en los últimos años su utilización se ha extendido a los casos con tumores de riesgo intermedio observándose que los resultados oncológicos son similares a los obtenidos con cirugía radical o con radioterapia externa7,8.
Objetivos
El objetivo principal es determinar la sobrevida libre de recidiva bioquímica (SLRB) en los pacientes sometidos a BT con Yodo125 en tiempo real dinámico, en Instituto Médico Tecnológico y en Prostate Institute Barcelona.
Además, se correlacionó la SLRB con la dosis de radiación recibida por el 90% de la próstata (D90), la estratificación del riesgo según D’Amico, el grado según Gleason, el estadio clínico, la edad, el PSA pre-tratamiento, la utilización de hormonoterapia previa y el tamaño de la próstata.
Material y Métodos
Se analizaron las historias clínicas de todos los pacientes tratados con BT entre junio de 2003 y diciembre de 2017. Previo a la BT, a los pacientes se les realizó una ecografía suprapúbica y transrectal para determinar el volumen prostático, una flujometría para valorar la calidad miccional, y cuestionarios de síntomas urinarios (IPSS) y de la esfera sexual (SHIM, IIEF).
Los pacientes se estratificaron según la escala de riesgo de D’Amico en: riesgo bajo (Gleason 3+3, PSA <10 ng/ml y estadio clínico T1c – T2a), riesgo intermedio (Gleason 7 o PSA 10-20 ng/ml o estadio clínico T2b), y riesgo alto (Gleason ≥8 o PSA >20 ng/ml o estadio clínico T2c)9.
La BT se efectuó con la técnica de tiempo real dinámico con planificación intraoperatoria de la dosis, y la implantación de las fuentes sueltas cargadas con Yodo125 (Bard, USA) se realizó con el aplicador Mick guiado por ecografía transrectal (BK Profocus). La dosis prescrita para todos los pacientes fue de 160 Gy dirigida a la próstata, más un margen peri-prostático de 2-5 mm. Antes de iniciar el implante se cateterizó la vejiga con una sonda Foley 14F, que se retiró a las 8-10 horas. A las 12-14 horas el paciente fue dado de alta.
Aproximadamente a los 30 días del implante se realizó un TAC abdomino-pelviano para valorar la calidad del implante determinando la dosis de radiación recibida por próstata, recto, uretra y vejiga. Se calculó el D90 (dosis recibida por el 90% de la próstata).
Los controles postoperatorios se efectuaron a los 3, 6 y 12 meses, cada 6 meses hasta los 5 años y luego anualmente. En los controles se determinó el PSA, se realizó flujometría y los pacientes completaron cuestionarios IPSS y QL, y SHIM e IIEF. Se registraron los efectos secundarios urinarios y rectales y se catalogaron según la gravedad en leves, moderados o severos.
Se definió como recidiva bioquímica la presencia de 3 elevaciones sucesivas del PSA10. En el último control clínico realizado los pacientes fueron agrupados en: 1- vivo sin recidiva, 2- vivo con recidiva, 3- muerto sin cáncer, 4- vivo con otro cáncer y 5- muerto por otro cáncer.
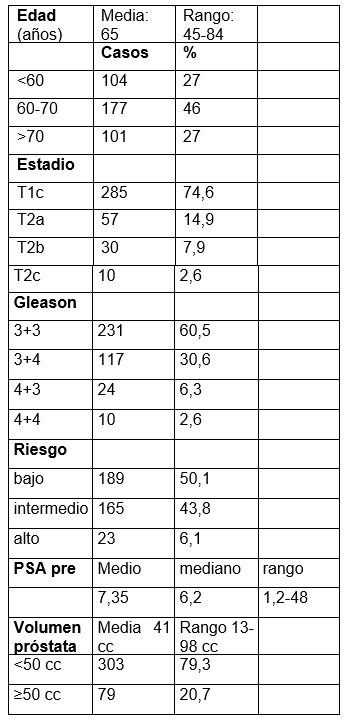
Tabla 1: Características clínicas de los pacientes y de los tumores
Todos los datos que se encontraban en las historias clínicas informatizadas se recolectaron en una base de datos Excel.
La SLRB se calculó utilizando el método Kaplan Meier. Para identificar factores pronósticos independientes se utilizaron las siguientes variables: edad, PSA pre-braquiterapia, volumen prostático, grado de Gleason, D90, hormonoterapia previa, cirugía prostática previa y estratificación del riesgo. El análisis multivariante se realizó utilizando la regresión de Cox y correlacionando la SLRB con: estadio, Gleason, edad, PSA pre-tratamiento, año del tratamiento, D90, volumen próstata pre-braquiterapia y hormonoterapia previa.
La comparación entre los grupos se realizó utilizando la prueba de log Rank. Se consideró estadísticamente significativo un valor de p<0,05. El análisis estadístico se realizó con el programa informático STATA.
Resultados
Entre junio de 2003 y diciembre de 2017 se realizó BT a 382 pacientes con cáncer de próstata. Las características clínicas de los pacientes se presentan en la tabla 1.
En 80 pacientes (21%) se utilizó tratamiento hormonal antes de la BT. En 37 casos la razón del tratamiento fue reducción de tamaño de la glándula y la duración del mismo fue de 3 meses en un 89% de los casos.
El seguimiento medio fue de 53,22 meses (rango: 1-176 meses) y el 38,5% de los casos (147 pacientes) presentó un seguimiento mayor de 5 años.
En 29 casos (7,6%) se observó recidiva bioquímica, que se confirmó clínicamente, por imágenes (TAC, RMN o PET) o mediante biopsia prostática en 20 casos. El lugar más frecuente de la recidiva fue la próstata.
Con respecto al tratamiento de los pacientes que sufrieron recidiva, a 10 se les realizó hormonoterapia, a 8 se les asoció hormonoterapia y radioterapia externa, a 2 se les realizó prostatectomía radical de rescate y a un caso radioterapia externa. A 8 pacientes no se les realizó ningún tratamiento, ya que no se determinó el lugar de la recidiva pese a que se practicaron todas las exploraciones de imagen disponibles y continúan en control.
La SLRB global a 5, 8 y 10 años fue del 91,78% IC [87,31%-94,72%], 87,30% IC [81,34%-91,45%] y 81,94% IC [72,76%-88,27%] respectivamente (figura 1).
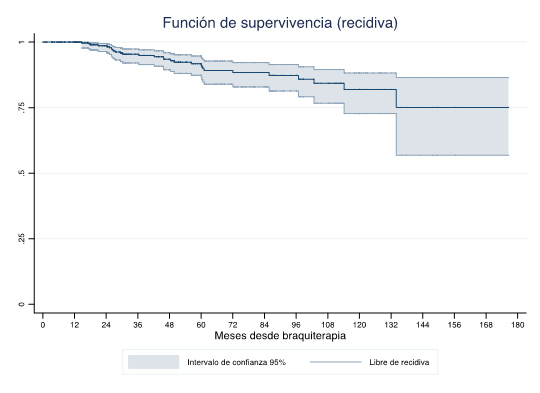
Figura 1. SLRB global a 5,8 y 10 años (Kaplan-Meier)
La correlación entre el riesgo y la SLRB se presenta en la tabla 2.
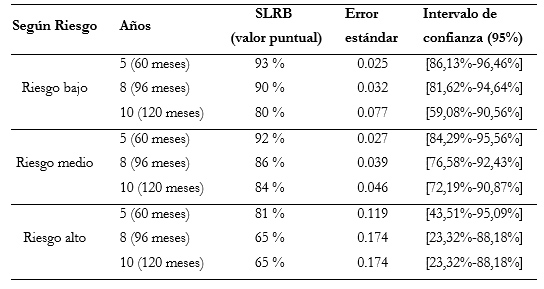
Tabla 2. SLRB según los grupos de riesgo
La SLRB según el grado de Gleason se presenta en la tabla 3.
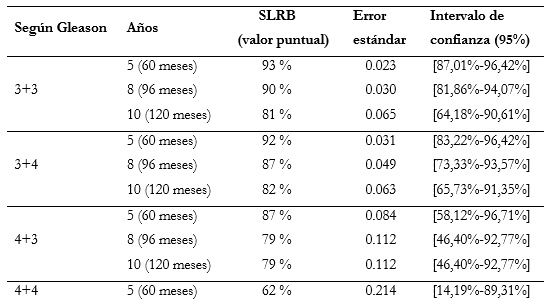
Tabla 3. SLRB según el grado de Gleason
La SLRB según el riesgo se presenta en la figura 2. No se observaron diferencias significativas según el nivel de riesgo.
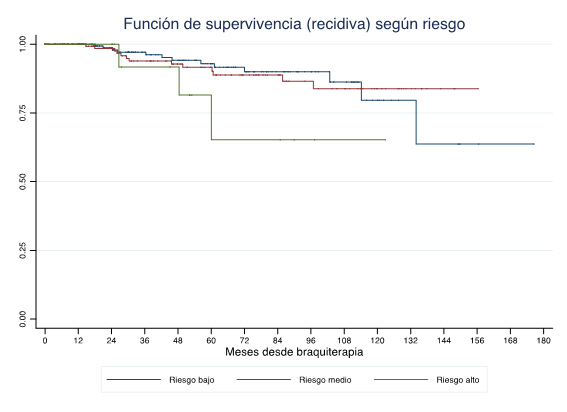
Figura 2. SLRB a 5, 8 y 10 años según riesgo (Kaplan-Meier) (p-valor=0.2504, log-rank test)
La SLRB según el grupo de edad se presenta en la figura 3. Se observaron diferencias estadísticamente significativas.
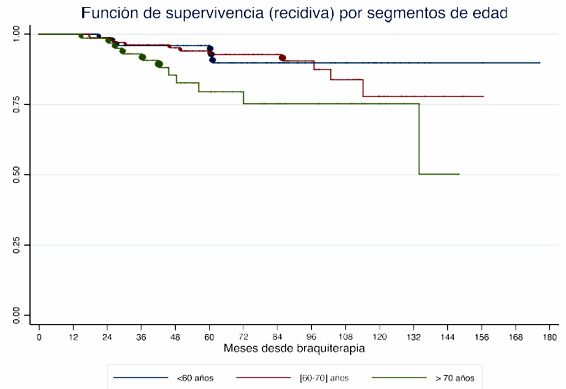
Figura 3. SLRB según los grupos de edad. Se observan diferencias significativas (p-valor=0.0409, log-rank test)
No se encontraron diferencias estadísticamente significativas entre la aparición de recidiva bioquímica, el grado de Gleason y la dosis de radiación (D90), el riesgo según D’Amico o la utilización de hormonoterapia previa.
El análisis de regresión multivariante (regresión de Cox) correlacionando recidiva con estadio, Gleason, edad, PSA pre-tratamiento, año del tratamiento, D90, volumen próstata pre braquiterapia y hormonoterapia previa se presenta en la tabla 4. Los factores que afectaron la recidiva fueron el estadio T2a y T2c frente al estadio T1c, el grado de Gleason 4+4 frente al grado 3+3 y el valor de PSA antes de la braquiterapia. Al agrupar los valores de D90 en 140-160 Gy, 160-180 Gy y >180Gy, se observó que los pacientes con un D90 > 180 Gy presentaron una mayor SLRB (p= 0,037).
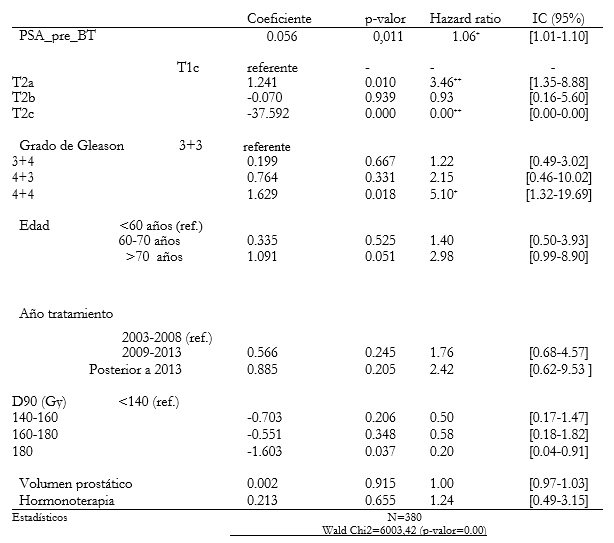
Tabla 4. Análisis de regresión multivariante
La evolución final según el riesgo se presenta en la figura 4. En el último control, el 92% de los casos con riesgo bajo estaban vivos y libres de recidiva tumoral, el 6,5% estaban vivos con recidiva, el 0,5% habían muerto por cáncer de próstata, y el 1,1% estaban vivos con otro cáncer. De los pacientes con riesgo intermedio, el 89% de los casos estaban vivos y sin recidiva, el 8% estaban vivos con recidiva tumoral, el 0,8% habían muerto sin cáncer, el 1,2% habían muerto por otro cáncer y el 1,2% estaban vivos con otro cáncer. De los pacientes con riesgo alto, el 82,6% estaban vivos sin recidiva, el 13% estaban vivos con recidiva tumoral y el 4,3% habían muerto sin cáncer.
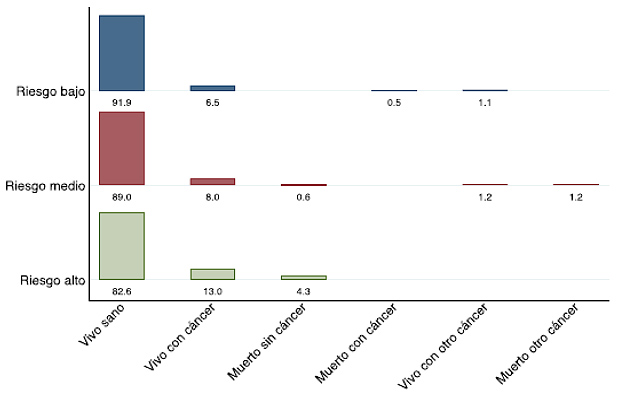
Figura 4. Evolución final según el riesgo
La evolución final según el grado de Gleason se presenta en la figura 5. En el último control, de los pacientes con Gleason 3+3, el 90,2% de los casos estaban vivos y libres de recidiva tumoral, el 6,2% estaban vivos con recidiva, el 0,4% habían muerto sin cáncer, el 0,4% habían muerto por cáncer de próstata, el 1,8% estaban vivos con otro cáncer y el 0,9% habían muerto por otro cáncer.
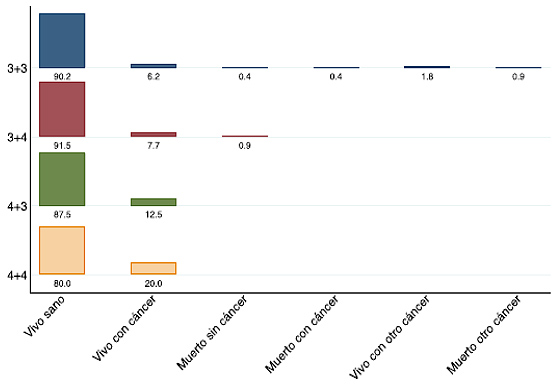
Figura 5. Evolución final según el grado de Gleason
Discusión
Se han expuesto los resultados de la braquiterapia en tiempo real dinámico con Y125 realizadas en nuestro Centro a pacientes con cáncer de próstata, los cuales muestran un excelente control de la enfermedad.
La comparación con las diferentes publicaciones se vio dificultada por la gran variabilidad en los criterios de selección, cambios de protocolos, tiempos de seguimiento y homogeneidad de las series.
Pese a estas limitaciones, nuestros resultados fueron similares a las grandes series publicadas. Observamos una SLRB global a los cinco años del 91,78%. Merrick et al.11 reportó una SLRB del 97,1% a los 5 años de seguimiento. Zelefsky et al12 publicó que, a los 5 años de seguimiento, los pacientes con bajo riesgo presentaron un 96% de SLRB y los de riesgo intermedio un 88%, datos que se asemejan a los publicados en nuestra serie (riesgo bajo 92,92% y riesgo intermedio 91,56%). Marshall et al presentaron la experiencia de los primeros 20 años del Mount Sinai Medical Center con 2.495 casos tratados desde 199013. La sobrevida actuarial a 12 años fue del 90% en los casos de riesgo bajo, del 84% en los de riesgo intermedio y del 64% en los de riesgo alto. Morris et al observaron una SLRB del 96,7% a los 5 años y del 94% a los 10 años4. Routman et al observaron una SLRB a 5 años similar (96%) pero a los 10 años fue inferior que en la serie de Morris (88%)14.
No existen publicaciones con gran valor estadístico que comparen la braquiterapia con la prostatectomía radical. Giberti et al. concluye en un estudio prospectivo, en el que compara prostatectomía radical con braquiterapia, que ambas técnicas tienen similar SLRB a los 5 años de seguimiento5. Recientemente, el mismo autor comparó los resultados obtenidos de forma prospectiva en pacientes tratados con braquiterapia frente a pacientes tratados con prostatectomía radical robótica sin observar diferencias en la SLRB de ambos grupos15.
Fuente: Archivo
En cuanto a la dosis de radiación, Morris et al.16 no encontraron una diferencia significativa entre SLRB y D90, siempre y cuando el paciente no presentara dosis subóptimas de tratamiento.
Por el contrario, Rasmusson et al.17 encontraron diferencia significativa entre el D90 y la SLRB. Los casos con D90 entre 170 y 180 Gy obtienen un excelente control oncológico a 5 años (95,7%) con aceptables efectos adversos en el tratamiento del cáncer de próstata de bajo riesgo. Similares resultados encontramos en nuestra serie, dado que la SLRB fue mayor en los pacientes con D90 > 180Gy. (p=0,037).
En España, Prada et al. observaron que la SLRB actuarial a 10 años para los casos con cánceres de próstata de riesgo bajo, intermedio y alto tratados con braquiterapia fue del 92%, 85% y 65% respectivamente18. Nuestros resultados a 10 años fueron superponibles en los casos con tumores de riesgo intermedio y alto.
Todas las series publicadas han mostrado que la braquiterapia es un excelente método terapéutico no sólo para los pacientes con cáncer de próstata de bajo riesgo, sino también para aquellos con cáncer de próstata de riesgo intermedio. Nuestros resultados muestran la misma tendencia. Aunque se trata de un número de casos reducido, se trata de una serie muy homogénea dado que las indicaciones del tratamiento fueron realizadas por un solo urólogo y el equipo tratante (físicos y radioterapeuta) se han mantenido sin cambios desde el primer caso tratado en 2003.
En conclusión, la braquiterapia en tiempo real dinámico con Y125 es un tratamiento de primera línea para el cáncer de próstata de riesgo bajo e intermedio no sólo por brindar un excelente control oncológico, sino también por presentar un porcentaje menor de efectos adversos que la prostatectomía radical.
Bibliografía
1. Kumar PP, Bartone FF. Transperineal percutaneous I-125 implant of prostate. Urology. 1981; 17: 238-40.
2. Stone NN, Stock RG. Brachytherapy for prostate cancer: real-time three-dimensional interactive seed implantation. Tech Urol. 1995; 1: 72-80.
3. Lytton B, Schiff M Jr, Shonk CR. Treatment of early stage prostatic cancer by implantation of iodine-125 seeds. Surg Clin North Am. 1980; 60: 1215-23.
4. Morris W. J, Keyes M, Spadinger I, et al. Population-Based 10-Year Oncologic Outcomes After Low-Dose-Rate Brachytherapy for Low-Risk and Intermediate-Risk Prostate Cancer. Cancer, 2013; 119: 1537-46.
5. Giberti C, Chiono L, Gallo F, et al. Radical retropubic prostatectomy versus brachytherapy for low-risk prostatic cancer: a prospective study. World J Urol. 2009; 27: 607-12.
6. Grimm P, Billiet I, Bostwick D, et al. Comparative analysis of prostate-specific antigen free survival outcomes for patients with low, intermediate and high risk prostate cancer treatment by radical therapy. Results from the Prostate Cancer Results Study Group. BJU Int 2012;109 Suppl 1:22-29.
7. Stokes SH. Comparison of biochemical disease-free survival of patients with localized carcinoma of the prostate undergoing radical prostatectomy, transperineal ultrasound-guided radioactive seed implantation, or definitive external beam irradiation. Int J Radiat Oncol Biol Phys, 2000; 47:129–136.
8. Morris W. J, Keyes M, Palma D, et al. Population-based study of biochemical and survival outcomes after permanent 125I brachytherapy for low- and intermediate-risk prostate cancer. Urology, 2009; 73: 860-5.
9. D'Amico AV, Whittington R, Malkowicz SB et al. Biochemical outcome after radical prostatectomy, external beam radiation therapy, or interstitial radiation therapy for clinically localized prostate cancer. JAMA 1998; 280: 969–74.
10. Roach M 3rd, Hanks G, Thames H Jr, et al. Defining biochemical failure following radiotherapy with or without hormonal therapy in men with clinically localized prostate cancer: recommendations of the RTOG-ASTRO Phoenix Consensus Conference. Int J Radiat Oncol Biol Phys. 2006; 65: 965-74.
11. Merrick GS, Butler WM, Galbreath RW, et al. Five-year biochemical outcome following permanent interstitial brachytherapy for clinical T1-T3 prostate cancer. Int J Radiat Oncol Biol Phys. 2001; 51:41-48.
12. Zelefsky MJ, Yamada Y, Cohen GN, et al. Five-year outcome of intraoperative conformal permanent I-125 interstitial implantation for patients with clinically localized prostate cancer. Int J Radiat Oncol Biol Phys, 2007; 67: 65-70.
13. Marshall RA, Buckstein M, Stone NN, et al. Treatment outcomes and morbidity following definitive brachytherapy with or without external beam radiation for the treatment of localized prostate cáncer: 20 year experience at Mount Sinai Medical Center. Urol Oncol 2014; 32: 1-7.
14. Routman DM, Funk RK, Stish BJ, et al. Permanent prostate brachytherapy monotherapy with I-125 for low- and intermediate- risk prostate canceroutcomes in 974 patients. Brachytherapy 2018 Oct 4. pii: S1538-4721(18)30565-8. doi: 10.1016/j.brachy.2018.09.003. [Epub ahead of print]
15. Giberti C, Gallo F, Schenone M, et al. Robotic prostatectomy versus brachytherapy for the treatment of low risk prostate cancer. Can J Urol 2017; 24: 8728-33.
16. Morris WJ, Spadinger I, Keyes M, et al. Whole prostate D90 and V100: a dose-response analysis of 2000 consecutive (125)I monotherapy patients. Brachytherapy 2014; 13: 32-41.
17. Rasmusson E, Gunnlaugsson A, Kjellén E, et al. Low-dose rate brachytherapy with I-125 seeds has an excellent 5-year outcome with few side effects in patients with low-risk prostate cancer. Acta Oncol 2016: 55: 1016-21.
18. Prada PJ, Juan G, González-Suarez H, et al. Prostate-specific antigen relapse-free survival and side effects in 734 patients with localized prostate cancer treated by permanent 125iodine implants. BJU Int 2010; 106: 32-36.




