Redacción Farmacosalud.com
La compañía Lilly anuncia resultados positivos del ensayo fase 3 ACHIEVE-1, un estudio que evalúa la seguridad y eficacia de orforglipron en comparación con placebo en adultos con diabetes tipo 2 y control glucémico inadecuado solo con dieta y ejercicio. Orforglipron es la primera molécula pequeña oral agonista del péptido-1 similar al glucagón (GLP-1), administrada sin restricciones de ingesta de comida o agua, que completa con éxito un ensayo de fase 3. “Las hormonas son proteínas y los fármacos derivados de hormonas presentan limitaciones en cuanto a las vías de administración. Generalmente, son moléculas grandes que requieren ser inyectadas o que tienen limitaciones si se aplican por vía oral. Sin embargo, orforglipron es un medicamento no peptídico, diseñado como una molécula pequeña, lo que permite ofrecer el beneficio de otros arGLP1 sin restricciones de ingesta, ni de alimentos ni de agua. Tanto su cómoda administración (el único ar-GLP1 de toma oral sin restricciones en la ingesta) como su eficacia en el control de la glucemia y el peso son aspectos diferenciales”, afirma el Dr. José Antonio Sacristán, director médico de Lilly España.
En caso de que orforglipron fuera aprobado, Lilly confía en su capacidad para comercializar el tratamiento en todo el mundo sin restricciones de suministro, lo que promovería la misión de la compañía de reducir las enfermedades crónicas como la diabetes tipo 2, patología que podría afectar a unos 760 millones de adultos para el año 20501. Orforglipron se presenta en formato oral sólido, es decir, pastilla / cápsula.

Dr. José Antonio Sacristán
Fuente: Lilly / Ogilvy
Toma en cualquier momento del día
“ACHIEVE-1 es el primer estudio fase 3 de siete que estudian la eficacia y seguridad de orforglipron entre las personas con diabetes y obesidad. Nos complace ver que nuestra última incretina confirma nuestras expectativas de seguridad y tolerabilidad, control de la glucemia y pérdida de peso, y esperamos las publicaciones de datos adicionales a finales de este año”, apunta David A. Ricks, presidente y director ejecutivo de Lilly. “Como un fármaco de uso diario de administración cómoda, orforglipron puede proporcionar una nueva opción de tratamiento y, si se aprueba, podría estar listo para su producción y comercialización a escala para ser usado en todo el mundo”, agrega Ricks.
Por su parte, la Dra. Miriam Rubio de Santos, directora médica del área Cardiometabólica de Lilly España, señala que “la administración oral en cualquier momento del día -sin limitaciones de ingesta- de orforglipron podrá ser un aliado para algunas personas con diabetes o con obesidad. Es la primera molécula pequeña de GLP1 y forma parte del amplio abanico de tratamientos que Lilly está desarrollando para ofrecer diferentes alternativas que puedan abordar las necesidades de los diferentes pacientes, y que se sumarán a la innovación de Mounjaro, tirzepatida, que ya es una realidad en España”.
Los resultados de ACHIEVE-3, para finales de año
En el primer ensayo clínico fase 3 del programa ACHIEVE, orforglipron cumplió con el objetivo primario de una reducción superior de la HbA1c (hemoglobina glicosilada) en comparación con placebo a las 40 semanas, disminuyendo la HbA1c en una media de 1,3% a 1,6%, desde un basal de 8,0% utilizando la estimación de eficacia2. “A la espera del resto de estudios, los datos son muy prometedores. No podemos hacer comparaciones entre orforglipron y otros arGLP-1 orales sin tener datos de ensayos comparativos. Sin embargo, en el estudio ACHIEVE-1, orforglipron mostró un buen perfil de seguridad en la fase 3 y demostró resultados de eficacia estadísticamente significativos y un perfil de seguridad compatible con los medicamentos inyectables de la clase de tratamiento GLP-1”, manifiesta el Dr. Sacristán.

Autor/a: cristianstorto
Fuente: depositphotos.com
“Los resultados de ACHIEVE-3, que compara la seguridad y eficacia y seguridad de orforglipron con semaglutida oral en adultos con diabetes de tipo 2 con un control glucémico inadecuado mediante metformina, se esperan para finales de este año”, añade este experto. En un objetivo secundario del ACHIEVE-1, más del 65% de los participantes que tomaron la dosis más alta de orforglipron lograron un HbA1c menor o igual al 6,5%, que está por debajo del umbral de diabetes definido por la Asociación Americana de Diabetes (ADA)3.
En otro objetivo secundario, los sujetos en tratamiento con el nuevo medicamento perdieron de media un 7,9% de peso con la dosis más alta. Dado que los pacientes no habían alcanzado el plató de peso cuando finalizó el estudio, parece que la reducción ponderal completa no se había logrado aún. “El programa de ensayos clínicos ACHIEVE está diseñado para evaluar la seguridad y la eficacia y la seguridad del orforglipron en personas con diabetes tipo 2. Aunque los datos de reducción de peso de ACHIEVE-1 son muy positivos, los resultados del programa de ensayo clínico ATTAIN, que evalúa la eficacia y seguridad del orforglipron en personas con obesidad, se esperan para el tercer trimestre de este año”, explica Sacristán.
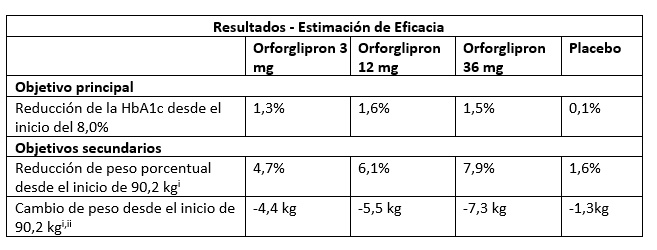
i Los objetivos secundarios del peso corporal para orforglipron 3 mg no se controlaron para el error de tipo 1
ii Las reducciones medias en el peso corporal no alcanzaron el plató en las 40 semanas
Difusión: Lilly
En la estimación del régimen de tratamiento4 en ACHIEVE-1, cada dosis de orforglipron condujo a reducciones estadísticamente significativas de la HbA1c. El objetivo secundario para el peso corporal, medido en los grupos de dosis de 12 mg y 36 mg de orforglipron, también logró reducciones de peso estadísticamente significativas mediante el estimando del régimen de tratamiento.
Eventos adversos gastrointestinales leve-moderados
El perfil de seguridad general de orforglipron en ACHIEVE-1 fue consistente con la clase terapéutica de GLP-1. Los eventos adversos notificados con mayor frecuencia fueron los gastrointestinales, que generalmente fueron de intensidad leve a moderada. Los efectos secundarios más comunes para los participantes tratados con orforglipron (3 mg, 12 mg y 36 mg, respectivamente) fueron diarrea (19%, 21% y 26%) vs. 9% con placebo, náusea (13%, 18% y 16%) vs. 2% con placebo, dispepsia (10%, 20% y 15%) vs. 7% con placebo, estreñimiento (8%, 17% y 14%) vs. 4% con placebo, y vómitos (5%, 7% y 14%) vs. 1% con placebo. La tasa de interrupción del tratamiento debido a eventos adversos fue inferior al 6% (3 mg), 4% (12 mg) y 8% (36 mg) para orforglipron vs 1% con placebo. No se observó ninguna señal de seguridad hepática.
Lilly espera presentar orforglipron para el control de peso a las agencias reguladoras mundiales a finales de este año y se prevé la presentación para el tratamiento de la diabetes tipo 2 en 2026.
Orforglipron es una molécula pequeña (no peptídica) de administración oral tomada una vez al día que actúa como un agonista del receptor del peptido-1 similar al glucagón (GLP-1). Está en fase de investigación y puede administrarse en cualquier momento del día sin restricciones en la ingesta de alimentos y agua5,6.
Autor/a: nazarov.dnepr@gmail.com
Fuente: depositphotos.com
Orforglipron fue descubierto por Chugai Pharmaceutical Co., Ltd. y licenciado por Lilly en 2018. Chugai y Lilly publicaron conjuntamente los datos preclínicos de farmacología de esta molécula. Lilly está desarrollando estudios fase 3 para el tratamiento de la diabetes tipo 2 y para el control del peso en adultos con obesidad o sobrepeso con al menos un problema médico relacionado con el peso. También se está estudiando como potencial tratamiento para la apnea obstructiva del sueño y la hipertensión arterial en adultos con obesidad.
Ensayo ACHIEVE-1: 559 participantes en EEUU, China, India, Japón y México
ACHIEVE-1 (NCT05971940) es un ensayo clínico fase 3, aleatorizado, doble ciego, controlado con placebo, de 40 semanas de duración, que compara, como monoterapia, la eficacia y seguridad de orforglipron 3 mg, 12 mg y 36 mg con placebo en adultos con diabetes tipo 2 y control glucémico inadecuado con dieta y ejercicio físico. El ensayo distribuyó aleatoriamente a 559 participantes en EE.UU., China, India, Japón y México en una proporción de 1:1:1:1 para recibir 3 mg, 12 mg o 36 mg de orforglipron o placebo. El objetivo del estudio fue demostrar que orforglipron (3 mg, 12 mg, 36 mg) es superior en la reducción de la HbA1c desde el inicio después de 40 semanas, en comparación con el placebo, en personas con diabetes tipo 2 que no han tomado ningún medicamento antidiabético durante al menos 90 días antes de la visita 1, y que no han recibido tratamiento con insulina.
Los participantes en el ensayo tenían una HbA1c entre el ≥7,0% y el ≤9,5% y un IMC de ≥23 kg/m2. Todos los participantes en los grupos de tratamiento con orforglipron comenzaron el estudio con una dosis de 1 mg de orforglipron una vez al día y luego aumentaron la dosis en un enfoque escalonado a intervalos de cuatro semanas hasta su dosis final de mantenimiento aleatorio de 3 mg (a través de un escalón de 1 mg), 12 mg (a través de escalones de 1 mg, 3 mg y 6 mg) o 36 mg (a través de escalones de 1 mg. 3 mg, 6 mg, 12 mg y 24 mg). No se permitió la dosificación flexible.
En el programa de desarrollo clínico global fase 3 ACHIEVE para orforglipron han participado más de 6.000 diabéticos con la afección de tipo 2 en 5 ensayos de registro globales. El programa comenzó en 2023 y se esperan los resultados para finales de este año y hasta 2026.
Referencias
1. Facts & figures International Diabetes Federation. (2025, April 7). https://idf.org/about diabetes/diabetes-facts-figures/
2. La estimación de la eficacia representa la eficacia si todos los participantes hubieran permanecido en la intervención del estudio (con posibles interrupciones de dosis) durante 40 semanas sin iniciar medicación antihiperglucémica adicional (>14 días de uso).
3. American Diabetes Association. (n.d.). Understanding diabetes diagnosis. Diabetes Diagnosis & Tests | ADA. https://diabetes.org/about-diabetes/diagnosis
4. La estimación del régimen de tratamiento representa el efecto promedio estimado del tratamiento, independientemente de la interrupción del tratamiento.
5. Ma X, Liu R, Pratt EJ, Benson CT, Bhattachar SN, Sloop KW. Effect of Food Consumption on the Pharmacokinetics, Safety, and Tolerability of Once-Daily Orally Administered Orforglipron (LY3502970), a Non-peptide GLP-1 Receptor Agonist. Diabetes Ther. 2024 Apr;15(4):819-832. doi: 10.1007/s13300-024-01554-1. Epub 2024 Feb 24. PMID: 38402332; PMCID: PMC10951152.
6. T. Kawai, B. Sun, H. Yoshino, D. Feng, Y. Suzuki, M. Fukazawa, S. Nagao, D.B. Wainscott, A.D. Showalter, B.A. Droz, T.S. Kobilka, M.P. Coghlan, F.S. Willard, Y. Kawabe, B.K. Kobilka, & K.W. Sloop, Structural basis for GLP-1 receptor activation by LY3502970, an orally active nonpeptide agonist, Proc. Natl. Acad. Sci. U.S.A. 117 (47) 29959-29967, https://doi.org/10.1073/pnas.2014879117 (2020).




