Redacción Farmacosalud.com
Novartis presenta los resultados del período doble ciego a 6 meses del estudio de Fase III APPEAR-C3G de iptacopán en la última sesión de ensayos clínicos del Congreso de la European Renal Association (ERA)1. Los sujetos que recibieron tratamiento con este fármaco además del tratamiento de apoyo lograron una reducción del 35,1% (p = 0,0014) en la proteinuria (medida por la relación proteína/creatinina en orina [UPCR] de 24 horas) a los 6 meses en comparación con los que recibieron placebo además del tratamiento de apoyo1, en el ámbito de la glomerulopatía C3 (GC3).
Los datos del objetivo secundario para la tasa de filtración glomerular estimada (TFGe) mostraron una mejora numérica del tratamiento iptacopán durante 6 meses frente a placebo; en una próxima reunión médica se presentarán resultados adicionales a 6 meses correspondientes al periodo abierto2,3. La nueva molécula mostró un perfil de seguridad favorable sin nuevas señales de seguridad1.
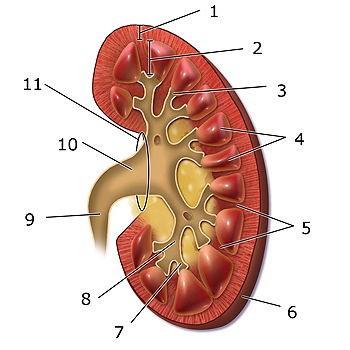
Esquema del riñón: 1. Corteza renal, 2. Médula renal, 3. Papila renal, 4, Pirámide renal, 5. Columna renal, 6. Cápsula fibrosa, 7. cáliz menor, 8. cáliz mayor, 9. Uréter, 10. Pelvis renal, 11. Hilio renal.
Autor/a de la imagen: Modificado de BruceBlaus - Wikimedia Commons file:Blausen 0593 KidneyAnatomy 02.png
Fuente: Wikipedia
Sobreactivación de la vía alterna del complemento
GC3, una enfermedad renal ultrarrara causada por la sobreactivación de la vía alterna del complemento, progresa a insuficiencia renal en aproximadamente el 50% de los enfermos en un plazo de 10 años4-7; actualmente no hay tratamientos aprobados para GC37-9. El tratamiento ahora presentado es un inhibidor dirigido al factor B de la vía alterna del complemento que se administra por vía oral, dirigido selectivamente a la causa subyacente de GC31; está en curso un programa de desarrollo en etapa avanzada para varias patologías minoritarias10-13.
En muchas enfermedades renales, la reducción de la proteinuria es un marcador subrogado cada vez más reconocido que se correlaciona con el retraso de la progresión a insuficiencia renal14,15. Iptacopán, de administración oral, es un inhibidor dirigido al factor B de la vía alterna del complemento que se está investigando en adultos con GC31-3. Las presentaciones regulatorias, incluyendo las de la FDA y la EMA (Agencias del Medicamento de Estados Unidos y Europa, respectivamente), para la indicación de la GC3 en adultos están previstas para la segunda mitad de 2024.
“La GC3 es una enfermedad devastadora y desatendida que, con frecuencia, afecta a las personas cuando son jóvenes. El pronóstico para los pacientes con GC3 es desfavorable, y aproximadamente la mitad de los pacientes afectados progresan a insuficiencia renal, que requiere diálisis o trasplante durante los 10 años posteriores al diagnóstico”, explica Marianne Silkjær Nielsen, fundadora de CompCure, una asociación danesa sin ánimo de lucro comprometida con mejorar los resultados para personas con esta afección y glomerulonefritis membranoproliferativa mediada por inmunocomplejos (GNMP-IC). "Actualmente no hay terapias aprobadas para la GC3, pero la investigación sobre nuevos tratamientos potenciales desarrollados específicamente para esta enfermedad nos ofrece esperanzas de poder mejorar los resultados para los pacientes y mitigar sus efectos emocionales, físicos y sociales", agrega.
Datos adicionales sobre el objetivo secundario de la tasa de filtración glomerular estimada (TFGe), una medida de la función renal, mostraron una mejora numérica de +2,2 mL/min/1,73 m2 (p = 0,1945) durante 6 meses con este tratamiento en comparación con placebo. El estudio también demostró que la molécula tiene un perfil de seguridad favorable sin nuevas señales de seguridad1.
“Los tratamientos actuales no abordan la biología subyacente de la GC3”
“Se trata de un hito ilusionante para los pacientes y para el posible manejo futuro de la GC3. La característica distintiva de la GC3 es la sobreactivación de parte del sistema inmunológico denominada vía alterna del complemento, que daña los riñones y provoca una pérdida grave de la función renal en muchos pacientes. Los tratamientos utilizados actualmente no abordan la biología subyacente de la GC3 y a menudo conllevan efectos secundarios importantes que aumentan la carga de la enfermedad”, afirma David Kavanagh, Prof. de Terapéutica del Complemento y consultor honorario de Nefrología de la Facultad de Ciencias Médicas de la Universidad de Newcastle (Reino Unido) y miembro del Comité Directivo del estudio APPEAR-C3G.

Fuente: www.farmacosalud.com / IMAGEN DE ARCHIVO
Gentileza del Centro Nacional de Microbiología. Instituto de Salud Carlos III de Madrid
"Iptacopán es el primer tratamiento potencial que se dirige a la vía alterna del complemento en GC3, y su impacto en las medidas de daño renal y función renal en este estudio, además de su perfil de seguridad, es alentador para los enfermos y la comunidad clínica", comenta el experto.
El ensayo APPEAR-C3G continúa con un período adicional abierto de 6 meses después del período doble ciego de 6 meses, en el que todos los pacientes reciben este tratamiento, incluyendo aquellos que recibieron previamente placebo2,3.
En el Congreso ERA, Novartis también ha presentado nuevos datos sobre su portafolio de enfermedades raras, incluyendo los resultados del análisis intermedio de 36 semanas del estudio de Fase III ALIGN de atrasentán, en investigación en la nefropatía por IgA (NIgA), datos adicionales de iptacopán en NIgA del análisis intermedio a 9 meses del estudio de Fase III APPLAUSE-IgAN, datos de eficacia y seguridad a largo plazo de 33 meses de este tratamiento en GC3 del estudio de extensión de Fase II, datos de Fase I/II a 1 año de zigakibart en investigación en NIgA y datos de investigaciones en la práctica clínica real en GC3 y síndrome urémico hemolítico atípico (SHUa)16-19.
APPEAR-C3G (NCT04817618) es un estudio de Fase III, multicéntrico, aleatorizado, doble ciego, de grupos paralelos y controlado con placebo para evaluar la eficacia y seguridad de este tratamiento de administración oral dos veces al día (200 mg) en pacientes con GC32,3. Iptacopán es un inhibidor oral dirigido al factor B de la vía alterna del sistema del complemento1. Descubierto en Novartis, el nuevo medicamento se encuentra actualmente en desarrollo para una variedad de enfermedades raras que incluyen NIgA, GC3, SHUa, GNMP-IC y nefritis lúpica (NL) y, como tal, no se ha establecido todavía el perfil de seguridad y eficacia en estas indicaciones2,11-13,20.
La molécula fue aprobada por la FDA en diciembre de 2023 para el tratamiento de adultos con la enfermedad sanguínea rara denominada hemoglobinuria paroxística nocturna (HPN) y recibió la aprobación por l EMA en mayo del 202421,22. La glomerulopatía C3 (GC3) es una dolencia renal progresiva y ultrarrara que se manifiesta de forma inicial en niños y adultos jóvenes4-6,23. Cada año, aproximadamente entre 1 y 2 personas de cada millón en todo el mundo reciben un nuevo diagnóstico de GC3, una forma de glomerulonefritis membranoproliferativa (GNMP)4.
En la GC3, la sobreactivación de la vía alterna del complemento (parte del sistema inmunológico) hace que se acumulen depósitos de proteína C3 en los glomérulos renales (una red de vasos sanguíneos que filtran los desechos y eliminan el exceso de líquido de la sangre)4,7,23-25. Esto desencadena inflamación y daño glomerular que provoca proteinuria (proteína en la orina), hematuria (sangre en la orina) y función renal reducida4,7,23-25. Aproximadamente, el 50% de los individuos con GC3 progresan a insuficiencia renal en un plazo de 10 años tras el diagnóstico, momento en el cual requerirán diálisis y/o trasplante de riñón6,7, y más del 55% de los pacientes con GC3 experimentan una recurrencia de la enfermedad después del trasplante26-29.
Referencias
1. Kavanagh D, Bomback A, Vivarelli M, et al. Efficacy and Safety of Iptacopan in Patients with C3 Glomerulopathy: Results from the Phase 3 APPEAR-C3G Trial. Presented at European Renal Association (ERA) Congress; May 25, 2024; Stockholm, Sweden.
2. ClinicalTrials.gov. NCT04817618. A Multicenter, Randomized, Double-Blind, Parallel Group, Placebo-Controlled Study to Evaluate the Efficacy and Safety of Iptacopan (LNP023) in Complement 3 Glomerulopathy (APPEAR-C3G). Available from: https://clinicaltrials.gov/study/NCT04817618. Accessed May 2024.
3. Bomback AS, Kavanagh D, Vivarelli M, et al. Alternative Complement Pathway Inhibition with Iptacopan for the Treatment of C3 Glomerulopathy – Study Design of the APPEAR-C3G Trial.Kidney Int Rep. 2022;7(10):2150-2159. doi:10.1016/j.ekir.2022.07.004
4. Schena FP, Esposito P, Rossini M. A Narrative Review on C3 Glomerulopathy: A Rare Renal Disease. Int J Mol Sci. 2020;21(2):525. doi:10.3390/ijms21020525
5. Smith RJ, Alexander J, Barlow PN, et al. New Approaches to the Treatment of Dense Deposit Disease. J Am Soc Nephrol. 2007;18(9):2447-2456. doi:10.1681/ASN.2007030356
6. Martin B, Smith RJH. In: Adam MP, Feldman J, Mirzaa GM, et al., editors. C3 Glomerulopathy. GeneReviews® [Internet]. Updated 2018. University of Washington, Seattle; 1993-2024. Available from: https://www.ncbi.nlm.nih.gov/books/NBK1425/. Accessed May 2024.
7. Smith RJH, Appel GB, Blom AM, et al. C3 Glomerulopathy – Understanding a Rare Complement-Driven Renal Disease. Nat Rev Nephrol. 2019;15(3):129-143. doi:10.1038/s41581-018-0107-2
8. Goodship TH, Cook HT, Fakhouri F, et al. Atypical Hemolytic Uremic Syndrome and C3 Glomerulopathy: Conclusions from a “Kidney Disease: Improving Global Outcomes” (KDIGO) Controversies Conference.Kidney Int. 2017;91(3):539-551. doi:10.1016/j.kint.2016.10.005
9. Kidney Disease: Improving Global Outcomes (KDIGO) Glomerular Diseases Work Group. KDIGO 2021 Clinical Practice Guideline for the Management of Glomerular Diseases.Kidney Int. 2021;100(4S):S1-S276. doi:10.1016/j.kint.2021.05.021
10. Perkovic V, Kollins D, Renfurm R, et al. WCN24-1506 Efficacy and Safety of Iptacopan in Patients with IgA Nephropathy: Interim Results from the Phase 3 APPLAUSE-IgAN Study. Kidney IntRep. 2024;9(4):S506. doi:10.1016/j.ekir.2024.02.1414
11. ClinicalTrials.gov. NCT04578834. A Multi-Center, Randomized, Double-Blind, Placebo-Controlled, Parallel Group, Phase III Study to Evaluate the Efficacy and Safety of LNP023 in Primary IgA Nephropathy Patients (APPLAUSE-IgAN). Available from:https://clinicaltrials.gov/study/NCT04578834. Accessed May 2024.
12. ClinicalTrials.gov. NCT04889430. A Multicenter, Single-Arm, Open Label Trial to Evaluate Efficacy and Safety of Oral, Twice Daily LNP023 in Adult aHUS Patients Who Are Naive to Complement Inhibitor Therapy (APPELHUS). Available from: https://clinicaltrials.gov/study/NCT04889430. Accessed May 2024.
13. ClinicalTrials.gov. NCT05755386. A Multicenter, Randomized, Double-Blind, Parallel Group, Placebo-Controlled Study to Evaluate the Efficacy and Safety of Iptacopan (LNP023) in Idiopathic Immune Complex Mediated Membranoproliferative Glomerulonephritis (IC-MPGN) (APPARENT). Available from: https://clinicaltrials.gov/study/NCT05755386. Accessed May 2024.
14. Thompson A, Carroll K, Inker LA, et al. Proteinuria Reduction as a Surrogate End Point in Trials of IgA Nephropathy.Clin J Am Soc Nephrol. 2019;14(3):469-481. doi:10.2215/CJN.08600718
15. Caravaca-Fontán F, Díaz-Encarnación M, Cabello V, et al. Longitudinal Change in Proteinuria and Kidney Outcomes in C3 Glomerulopathy.Nephrol Dial Transplant. 2022;37(7):1270-1280. doi:10.1093/ndt/gfab075
16. Heerspink HJL, Jardine M, Kohan D, et al. ALIGN Phase 3 Primary Endpoint Analysis: Atrasentan Shows Significant Reduction in Proteinuria in Patients with IgA Nephropathy. Presented at European Renal Association (ERA) Congress; May 25, 2024; Stockholm, Sweden.
17. Perkovic V, Kollins D, Papachristofi O, et al. Efficacy and Safety of Iptacopan in Patients with Primary IgA Nephropathy: Interim Analysis Results of the Phase 3 APPLAUSE-IgAN Study. Presented at European Renal Association (ERA) Congress; May 25, 2024; Stockholm, Sweden.
18. Nester CM, Eisenberger U, Karras A, et al. Update to the Long-Term Safety and Efficacy of Iptacopan in C3G: 33-Month Extension Study Data from Patients Enrolled in a Phase 2 Study. Presented at European Renal Association (ERA) Congress; May 25, 2024; Stockholm, Sweden.
19. Barratt J, Kooienga L, Agha I, et al. One Year of Zigakibart Treatment Shows Clinically Meaningful Proteinuria Reduction and Good Tolerability in a Phase 1/2 Study of IgA Nephropathy. Presented at European Renal Association (ERA) Congress; May 25, 2024; Stockholm, Sweden.
20. ClinicalTrials.gov. NCT05268289. An Adaptive, Randomized, Double-Blind, Dose Exploration, Parallel Group, Placebo Controlled, Multicenter Phase 2 Trial to Evaluate the Efficacy, Safety and Tolerability of LNP023 in Combination with Standard-of-Care with and without Oral Corticosteroids in Patients with ActiveLupusNephritis Class III-IV, +/- V. Available from:https://clinicaltrials.gov/study/NCT05268289. Accessed May 2024.
21. Novartis. Novartis receives FDA approval for Fabhalta®(iptacopan), offering superior hemoglobin improvement in the absence of transfusions as the first oral monotherapy for adults with PNH. Available from:https://www.novartis.com/news/media-releases/novartis-receives-fda-approval-fabhalta-iptacopan-offering-superior-hemoglobin-improvement-absence-transfusions-first-oral-monotherapy-adults-pnh. Accessed May 2024.
22. Novartis. Novartis Fabhalta® (iptacopan) receives positive CHMP opinion as first oral monotherapy for adult patients with paroxysmal nocturnal hemoglobinuria (PNH). Available from:https://www.novartis.com/news/media-releases/novartis-fabhalta-iptacopan-receives-positive-chmp-opinion-first-oral-monotherapy-adult-patients-paroxysmal-nocturnal-hemoglobinuria-pnh. Accessed May 2024.
23. Medjeral-Thomas NR, O'Shaughnessy MM, O'Regan JA, et al. C3 Glomerulopathy: Clinicopathologic Features and Predictors of Outcome.Clin J Am Soc Nephrol. 2014;9(1):46-53. doi:10.2215/CJN.04700513
24. Ravindran A, Fervenza FC, Smith RJH, Sethi S. C3 Glomerulopathy Associated with Monoclonal Ig is a Distinct Subtype.Kidney Int. 2018;94(1):178-186. doi:10.1016/j.kint.2018.01.037
25. Caravaca-Fontán F, Lucientes L, Cavero T, Praga M. Update on C3 Glomerulopathy: A Complement-Mediated Disease.Nephron. 2020;144(6):272-280. doi:10.1159/000507254
26. Servais A, Noël LH, Roumenina LT, et al. Acquired and Genetic Complement Abnormalities Play a Critical Role in Dense Deposit Disease and Other C3 Glomerulopathies.Kidney Int. 2012;82(4):454-464. doi:10.1038/ki.2012.63
27. Zand L, Lorenz EC, Cosio FG, et al. Clinical Findings, Pathology, and Outcomes of C3GN after Kidney Transplantation.J Am Soc Nephrol. 2014;25(5):1110-1117. doi:10.1681/ASN.2013070715
28. Regunathan-Shenk R, Avasare RS, Ahn W, et al. Kidney Transplantation in C3 Glomerulopathy: A Case Series.Am J Kidney Dis. 2019;73(3):316-323. doi:10.1053/j.ajkd.2018.09.002
29. Caravaca-Fontán F, Polanco N, Villacorta B, et al. Recurrence of Immune Complex and Complement-Mediated Membranoproliferative Glomerulonephritis in Kidney Transplantation.Nephrol Dial Transplant. 2023;38(1):222-235. doi:10.1093/ndt/gfac148.




