Introducción
El infliximab-INN o CT-P13 es el primer biosimilar introducido en el tratamiento de la Enfermedad Inflamatoria Intestinal (EII), en 2013. Las reticencias iniciales a su empleo1 fundamentalmente se debieron a basar su indicación en la EII en la extrapolación de sus resultados en otras indicaciones. Sin embargo, la opinión con respecto a los biosimilares en la EII ha cambiado, tanto en los médicos2 como en los pacientes3, con una aceptación prácticamente general. Esto es debido a la evidencia acumulada a lo largo de estos años sobre su eficacia clínica y seguridad con multitud de series y metanálisis4,5; a lo que se suma la publicación de un ensayo clínico en la EII6. El aspecto más controvertido, que era el cambio del biológico de referencia al biosimilar o switch, también cuenta con numerosas series, metanálisis7 e incluso ensayos clínicos8 que lo avalan. Es cierto que en los ensayos clínicos con cegamiento no hay diferencias entre CT-P13 y el biológico de referencia9; sin embargo, en las series abiertas controladas no siempre sucede así,7 entrando en juego el concepto del efecto nocebo. Este fenómeno nos ha hecho ser conscientes de la importancia de tener cuenta en la decisión de tratamiento las preocupaciones y preferencias del paciente, así como dar una información adecuada en los cambios a biosimilar.

Dr. Fernando Muñoz Núñez
Fuente: Dr. Muñoz Núñez
Las consecuencias de la progresiva introducción de los biosimilares no ha sido sólo la disminución del gasto, sino un aumento de la utilización de estos fármacos10 incluyendo una introducción más precoz, que es cuando mayor utilidad pueden tener11,12. Por otro lado, uno de los inconvenientes que se ha atribuido a la introducción de los biosimilares ha sido la disminución del apoyo a la investigación por las compañías implicadas, por un menor interés económico. La introducción de la formulación subcutánea del infliximab-INN viene a contradecir esta afirmación, aportando nuevas oportunidades al fármaco.
Evidencia de la formulación SC del infliximab-INN en la EII
Los estudios encaminados a la aprobación de una nueva formulación tienen el objetivo principal de demostrar una farmacocinética y farmacodinámica adecuadas, más que demostrar la eficacia de un fármaco que ya lo ha hecho en sus múltiples indicaciones. En este caso, los estudios se han realizado tanto en la EII como en la artritis reumatoide (AR), extrapolándose los resultados para el resto de las indicaciones.
El primer estudio fase I13,14 incluye a 44 pacientes con enfermedad de Crohn (EC) (CDAI entre 220 y 450) que reciben dos dosis de 5 mg/kg de infliximab IV [vía intravenosa] (semanas 0 y 2) y son aleatorizados en la semana 6 en 4 grupos: seguir con la formulación IV cada 8 semanas o bien una de las siguientes 3 dosis SC cada 2 semanas, 120, 180 o 240 mg hasta la semana 54. No se encuentran diferencias entre grupos en ninguno de los parámetros de eficacia analizados (respuesta CDAI-70, remisión clínica y respuesta o remisión endoscópica), aunque es cierto que el estudio no tiene potencia suficiente para detectarlas. Como dato llamativo, los resultados eran numéricamente superiores en los grupos que recibieron la formulación SC.
Más interesantes son los hallazgos farmacocinéticos, ya que todas las formulaciones SC mantienen unos niveles valle claramente por encima de la concentración fijada como objetivo (5 µg/ml) con todas las dosis ensayadas (ej. media de 13,27 µg /ml con 120 mg/2 semanas), no así la administración IV con unos niveles valle medios de 2,3 µg/ml (0,14-8,57; IC95%) (figura 1). Por el contrario, los niveles pico son mucho más elevados con la formulación IV. Los efectos adversos relacionados con el fármaco fueron similares entre grupos, destacando una incidencia del 11,4% de reacciones locales en los grupos de administración SC, siendo todas leves (grado 1 o 2).
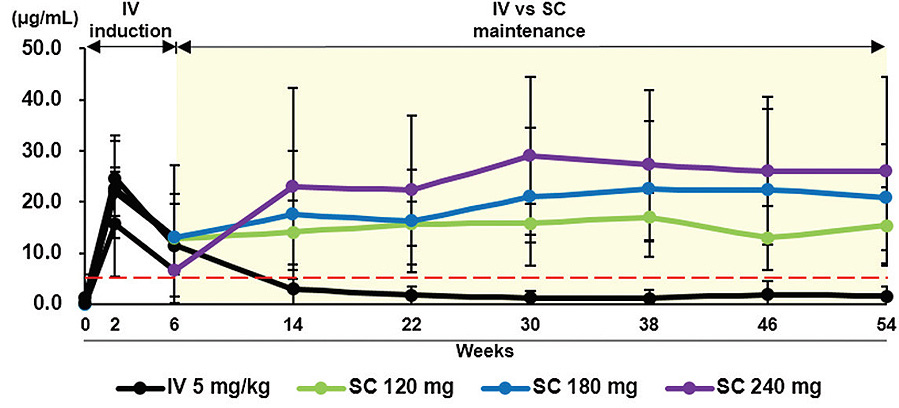
Figura 1: niveles de infliximab en el tiempo en el estudio fase I en EC
Extraída de referencias 13,14
Una vez encontrada la dosis SC más adecuada, se realiza un estudio de no inferioridad en pacientes con colitis ulcerosa (CU) y EC con enfermedad activa15,16. Se aleatoriza a un total de 131 pacientes en dos grupos. El primero con la dosificación IV habitual de 5 µg/kg cada 8 semanas y el segundo con la formulación SC, adaptando la dosis al peso, 120 mg si <80 Kg o bien 240 si ≥ 80 Kg. Las dos primeras dosis de inducción, como es habitual, fueron IV realizando la aleatorización en la semana 6. Los pacientes de ambos grupos recibían los correspondientes placebos, SC en el grupo IV e IV en el grupo SC. A partir de la semana 30 los pacientes que habían recibido infliximab IV pasaban a la dosificación SC, escalando la dosis a 240 mg/2 semanas en caso de pérdida de respuesta a partir de este punto. Las tasas de remisión combinadas (CU+EC) fueron similares en ambos grupos en la semana 30 (66,7% en el grupo SC y 54,7% en el IV; p=0,1620), así como la curación mucosa en la semana 22 (48,1 en SC y 41% en IV) definida por los criterios habituales (Mayo de 0 o 1 y SES-CD≤2).
La seguridad fue similar en ambos grupos, salvo por la mayor frecuencia de reacciones locales en el grupo SC (16,7% vs 3,1%), todas ellas leves (grados 1 o 2). El objetivo fundamental del estudio era comparar la farmacocinética de ambas dosificaciones, siendo los resultados similares al estudio fase I. La biodisponibilidad de la formulación SC era del 60% con una exposición más constante que la del grupo IV, siendo los niveles valle de la semana 22 mayores en el grupo SC (20,9 µg/ml vs 1,8 µg/ml). No había diferencias significativas de inmunogenicidad entre ambas dosificaciones, aunque numéricamente los anticuerpos anti-infliximab fueron más frecuentes en el grupo IV (53,8% vs 37,9%).
En la semana 54, tras el cambio a la dosificación SC del grupo IV, se mantuvieron las tasas de respuesta y remisión clínicas y los niveles de fármaco aumentaron hasta igualarse a los del grupo de formulación SC. En definitiva, no se encuentran diferencias de eficacia, aunque los niveles conseguidos son uniformemente más altos a lo largo del estudio con la formulación SC y la inmunogenicidad tiende a ser menor. Esto contrasta con la mayor probabilidad de inmunogenicidad con la administración subcutánea de los fármacos biológicos17; en este caso, probablemente el mantenimiento de unos niveles estables elevados contrarreste este hecho.
Evidencia de la formulación SC en la artritis reumatoide
El estudio fase I en AR incluye 50 pacientes en 4 grupos: dosificación IV habitual (3 mg/kg/8 semanas tras la inducción), y SC 120 mg/2 semanas, 120 mg/4 semanas y 180 mg/4 semanas, todas ellas tras dos dosis IV en las semanas 0 y 2. No hay diferencias de eficacia entre grupos como era de esperar y, quizás, lo más interesante es que la dosificación SC consigue unos niveles valle por encima del nivel objetivo (1 µg/ml) en todos los grupos; no así la IV.
El mayor estudio publicado hasta la fecha18 incluye a 357 pacientes con AR aleatorizados a recibir 3 mg/kg IV cada 8 semanas tras la inducción o bien 120 mg SC/2 semanas, durante 30 semanas, posteriormente en el grupo de infliximab IV se cambia a dosificación SC. Ambos grupos reciben, también, los correspondientes placebos. El intervalo de confianza queda por encima del nivel pre-especificado de no inferioridad; por lo tanto, la administración SC, al menos, no es inferior a la IV. Hay que señalar que los resultados son similares entre grupos hasta la semana 22; sin embargo, en la semana 30, la eficacia del grupo SC es mayor con los diferentes índices empleados (ACR, EULAR, CDAI, SDAI, DAS28-PCR y DAS28-ESR) (figura 2). Posteriormente, una vez cambiada la dosificación IV a la SC, no se encuentran diferencias en la semana 54.
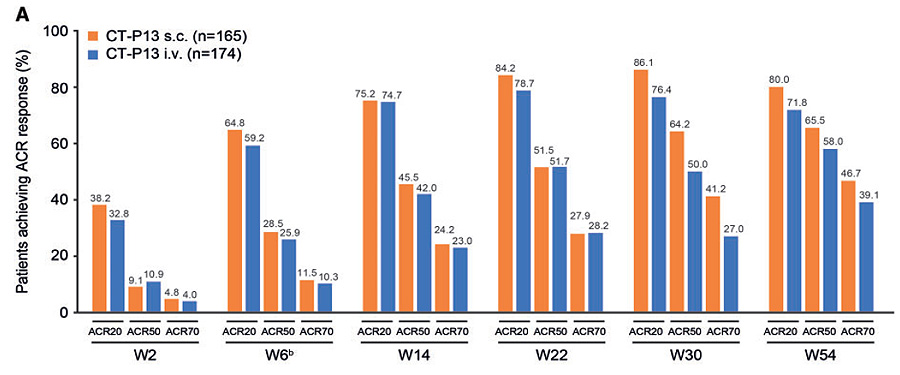
Figura 2: respuesta clínica según criterios ACR20, ACR50 y ACR70 en el estudio fase I/III en AR
Extraída de referencia 18
No hay diferencias en efectos adversos entre grupos, incluyendo las reacciones locales (17,9% SC vs 12,6% IV). Farmacocinéticamente, los hallazgos son similares a los de los estudios ya descritos, con niveles valle más elevados en el grupo SC y con niveles pico más altos en el IV. En este caso, no se encuentran diferencias significativas respecto a la inmunogenicidad (67,9% SC vs 73,7% IV).
Un reciente metanálisis19 en red que compara el infliximab SC con la formulación IV y con otros fármacos como el adalimumab y el etanercept, encuentra diferencias numéricas no significativas del SC (alguna significativa como DAS28-ESR y DAS28-PCR en semanas 30 y 54 frente al IFX -infliximab- IV) sobre el resto de los fármacos, aunque son resultados poco concluyentes dadas las limitaciones de este tipo de estudios.
¿Qué aporta la formulación SC?
En primer lugar, la administración SC de un fármaco permite una mayor independencia del paciente con un menor número de visitas al hospital, lo que es especialmente destacable durante la pandemia de COVID-19. Por otro lado, también supone un menor gasto en recursos sanitarios (hospital de día), o al menos contribuye a la descongestión de estas unidades. Más controvertido es si los pacientes prefieren mayoritariamente una formulación SC o IV, puesto que hay estudios en un sentido20 y en otro21. Probablemente dependerá de quién lo pregunte y a quién se pregunte. Por ejemplo, pacientes de mayor edad con una mayor dependencia optan mayoritariamente por la IV por la presencia del médico en el hospital de día. Por otro lado, pacientes con vida laboral activa sin problemas para la auto-administración del fármaco prefieren la SC22. La gran ventaja de disponer de formulación IV y SC de un mismo producto es que esta disyuntiva no es un problema, optando por la formulación que mejor se adapte a las características del paciente sin tener que cambiar de fármaco. Esto es especialmente importante, dado que el cambio de un fármaco anti-TNF a otro motivado por la vía de administración puede conllevar pérdida de eficacia23.
El hecho de que los niveles valle con la formulación SC sean consistentemente más elevados que la administración IV permite que, en hospitales donde no se realiza determinación de niveles de fármaco, haya un mayor margen de seguridad, en la medida que unos niveles bajos se han relacionado con inmunogenicidad y por tanto con una mayor probabilidad de pérdida de respuesta24. Es cierto que los datos con respecto a la inmunogenicidad son insuficientes para afirmar con rotundidad que la probabilidad de desarrollo de anticuerpos frente al fármaco es menor con la administración SC; sin embargo, y al menos en los estudios en EII, los datos apuntan en esa dirección. Probablemente, estudios con un mayor número de pacientes y sobre todo con un mayor seguimiento serían necesarios para aclarar definitivamente este punto.
Por último, la gran ventaja de disponer de dos formas de administración es la flexibilidad que proporciona para utilizar una u otra en función de las necesidades del paciente o de la enfermedad en cada momento. Así, en un brote grave optaremos por la administración IV por sus mayores niveles pico hasta el control de la enfermedad y, a partir de ese momento (que será o no en la semana 6 en función de la situación del paciente), podremos cambiar a la SC si las características o preferencias del paciente así lo aconsejan. También puede suceder lo contrario, de forma que en un paciente en tratamiento con infliximab SC y pérdida de respuesta con niveles bajos nos pueda interesar pasar a la administración IV transitoriamente para un control más rápido de la actividad. De momento, tenemos evidencia del paso de la IV a la SC en el estudio fase I/III con buenos resultados, aunque no del paso de la SC a la IV; si bien en este caso, lo aconsejable sería guiarse con la determinación de niveles del fármaco, puesto que a las dosis habituales, los niveles de IV son más bajos que con la SC.
Conclusiones
La aprobación reciente del infliximab SC por la EMA (Agencia Europea del Medicamento) aporta una opción más de tratamiento para adaptarnos a las necesidades y preferencias de los pacientes, aportando además un mejor perfil farmacocinético a las dosis aconsejadas que probablemente condicione una menor probabilidad de inmunogenicidad.
Bibliografía
1. Danese S, Fiorino G, Michetti P. Viewpoint: knowledge and viewpoints on biosimilar monoclonal antibodies among members of the European Crohn's and Colitis Organization. J Crohns Colitis 2014; 8 (11): 1548-1550.
2. Danese S, Fiorino G, Michetti P. Changes in Biosimilar Knowledge among European Crohn's Colitis Organization [ECCO] Members: An Updated Survey. J Crohns Colitis 2016; 10 (11): 1362-1365.
3. Macaluso FS, Leone S, Previtali E et al. Biosimilars: The viewpoint of Italian patients with inflammatory bowel disease. Dig Liver Dis 2020; 52 (11): 1304-1309.
4. Ebada MA, Elmatboly AM, Ali AS et al. An updated systematic review and meta-analysis about the safety and efficacy of infliximab biosimilar, CT-P13, for patients with inflammatory bowel disease. Int J Colorectal Dis 2019; 34 (10): 1633-1652.
5. Komaki Y, Yamada A, Komaki F et al. Systematic review with meta-analysis: the efficacy and safety of CT-P13, a biosimilar of anti-tumour necrosis factor-α agent (infliximab), in inflammatory bowel diseases. Aliment Pharmacol Ther 2017; 45 (8): 1043-1057.
6. Ye BD, Pesegova M, Alexeeva O et al. Efficacy and safety of biosimilar CT-P13 compared with originator infliximab in patients with active Crohn's disease: an international, randomised, double-blind, phase 3 non-inferiority study. Lancet 2019; 393 (10182): 1699-1707.
7. Chaparro M, Garre A, Guerra Veloz MF et al. Effectiveness and safety of the switch from Remicade to CT-P13 in patients with inflammatory bowel disease. J Crohns Colitis 2019; 13 (11): 1380-1386.
8. Jørgensen KK, Olsen IC, Goll GL et al. Switching from originator infliximab to biosimilar CT-P13 compared with maintained treatment with originator infliximab (NOR-SWITCH): a 52-week, randomised, double-blind, non-inferiority trial. The Lancet 2017.
9. Odinet JS, Day CE, Cruz JL et al. The Biosimilar Nocebo Effect? A Systematic Review of Double-Blinded Versus Open-Label Studies. J Manag Care Spec Pharm 2018; 24 (10): 952-959.
10. Jensen TB, Bartels D, Saedder EA et al. The Danish model for the quick and safe implementation of infliximab and etanercept biosimilars. Eur J Clin Pharmacol 2020; 76 (1): 35-40.
11. Hamdeh S, Aziz M, Altayar O et al. Early vs Late Use of Anti-TNFa Therapy in Adult Patients With Crohn Disease: A Systematic Review and Meta-Analysis. Inflamm Bowel Dis 2020.
12. Beilman CL, Kirwin E, Ma C et al. Early Initiation of Tumor Necrosis Factor Antagonist-Based Therapy for Patients With Crohn's Disease Reduces Costs Compared With Late Initiation. Clin Gastroenterol Hepatol 2019; 17 (8): 1515-1524 e1514.
13. Reinisch W, Jang BI, Borzan V et al. DOP62 A novel formulation of CT-P13 (infliximab biosimilar) for subcutaneous administration: 1-year result from a Phase I open-label randomised controlled trial in patients with active Crohn’s disease. Journal of Crohn's and Colitis 2019; 13 (Supplement_1): S066-S067.
14. Schreiber S, Jang BI, Borzan V et al. Tu2018 - Novel Formulation of CT-P13 (Infliximab Biosimilar) for Subcutaneous Administration: Initial Results from a Phase I Open-Label Randomized Controlled Trial in Patients with Active Crohn's Disease. Gastroenterology 2018; 154 (6): S-1371.
15. Ben-Horin S, Leszczyszyn J, Dudkowiak R et al. OP24 A novel subcutaneous infliximab (CT-P13): 1-year results including switching results from intravenous infliximab (CT-P13) in patients with active Crohn’s disease and ulcerative colitis. Journal of Crohn's and Colitis 2020; 14 (Supplement_1): S021-S022.
16. Schreiber S, Leszczyszyn J, Dudkowiak R et al. Lb02 Noninferiority of novel subcutaneous infliximab (ct-p13) to intravenous infliximab (ct-p13) in patients with active crohn’s disease and ulcerative colitis: week 30 results from a multicentre, randomised controlled pivotal trial. United European gastroenterology journal 2019; 7: 1411-1425.
17. Hamuro L, Kijanka G, Kinderman F et al. Perspectives on Subcutaneous Route of Administration as an Immunogenicity Risk Factor for Therapeutic Proteins. J Pharm Sci 2017; 106 (10): 2946-2954.
18. Westhovens R, Wiland P, Zawadzki M et al. Efficacy, pharmacokinetics and safety of subcutaneous versus intravenous CT-P13 in rheumatoid arthritis: a randomized phase I/III trial. Rheumatology (Oxford) 2020.
19. Caporali R, Allanore Y, Alten R et al. Efficacy and safety of subcutaneous infliximab versus adalimumab, etanercept and intravenous infliximab in patients with rheumatoid arthritis: a systematic literature review and meta-analysis. Expert Rev Clin Immunol 2020: 1-15.
20. Sylwestrzak G, Liu J, Stephenson JJ et al. Considering patient preferences when selecting anti-tumor necrosis factor therapeutic options. Am Health Drug Benefits 2014; 7 (2): 71-81.
21. Allen PB, Lindsay H, Tham TC. How do patients with inflammatory bowel disease want their biological therapy administered? BMC Gastroenterol 2010; 10: 1.
22. Chilton F, Collett RA. Treatment choices, preferences and decision-making by patients with rheumatoid arthritis. Musculoskeletal Care 2008; 6 (1): 1-14.
23. Van Assche G, Vermeire S, Ballet V et al. Switch to adalimumab in patients with Crohn's disease controlled by maintenance infliximab: prospective randomised SWITCH trial. Gut 2012; 61 (2): 229-234.
24. Brandse JF, Mould D, Smeekes O et al. A Real-life Population Pharmacokinetic Study Reveals Factors Associated with Clearance and Immunogenicity of Infliximab in Inflammatory Bowel Disease. Inflamm Bowel Dis 2017; 23 (4): 650-660.




