Dras. Isabel Vera Mendoza e Irene González-Partida
Desde su aprobación en 1998, infliximab intravenoso (IFX-IV) ha sido una de las terapias más ampliamente utilizadas en el manejo de enfermedades inflamatorias inmunomediadas (IMIDs), como la enfermedad de Crohn (EC), la colitis ulcerosa (CU) [Enfermedad Inflamatoria Intestinal (EII)], la artritis reumatoide, la espondilitis anquilosante y la psoriasis. Su eficacia ha sido validada en múltiples ensayos clínicos y en décadas de experiencia en vida real. Sin embargo, su administración intravenosa periódica supone una carga significativa en el sistema sanitario, para los profesionales y para los pacientes1.
La necesidad de infusión hospitalaria y la logística asociada (desplazamientos, permisos laborales, coordinación con enfermería) representan barreras relevantes, especialmente en pacientes jóvenes y activos. Además, la formulación intravenosa está sujeta a una farmacocinética variable, con niveles valle que pueden fluctuar de forma significativa entre infusión e infusión, lo que puede comprometer la eficacia, favorecer la aparición de inmunogenicidad y condicionar el uso de inmunosupresores concomitantes2.

La Dra. Irene González-Partida (a la izq. de la imagen) y la Dra. Isabel Vera Mendoza
Fuente: Dras. González-Partida y Vera Mendoza
En este contexto, el desarrollo de infliximab subcutáneo (IFX-SC) representa un avance clínico y estratégico. IFX-SC es una formulación considerada biobetter del biosimilar CT-P13, que mantiene la misma estructura molecular que IFX-IV, pero con una formulación adaptada a la administración subcutánea. Esta modalidad permite una autoadministración quincenal, aporta niveles séricos más estables, mejora el control de la enfermedad y facilita estrategias más personalizadas como la monitorización terapéutica proactiva2,3.
Desde su aprobación por la Agencia Europea del Medicamento en 2020, IFX-SC ha ampliado sus indicaciones a todas las aprobadas previamente para IFX-IV. Su implementación ha sido acelerada en algunos países europeos como Reino Unido, Francia y España, con datos emergentes muy sólidos provenientes tanto de ensayos clínicos pivotales4 como de estudios observacionales de vida real5.
Este artículo tiene como objetivo analizar las oportunidades específicas que aporta IFX-SC en la práctica real. Para ello, se revisará la evidencia disponible a través de varios puntos clave: inmunogenicidad y monoterapia, persistencia del tratamiento, tolerancia y aceptabilidad, y el uso de IFX-SC en escenarios complejos.
1. Inmunogenicidad y uso en monoterapia
La inmunogenicidad es una de las principales causas de pérdida secundaria de respuesta en tratamientos biológicos, hecho que particularmente afecta al IFX-IV. La generación de anticuerpos anti-infliximab (ADA) puede reducir la concentración del fármaco activo, neutralizar su efecto y desencadenar reacciones infusionales, a veces graves. Tradicionalmente, el uso de inmunomoduladores (IMM) concomitantes ha sido recomendado para reducir este riesgo. Sin embargo, el perfil farmacocinético más estable y sostenido de IFX-SC permite mantener niveles valle más altos y menos fluctuantes, lo que puede contribuir a una menor inmnunogenidad. Esta diferencia es clave y abre la puerta a la monoterapia en los pacientes en tratamiento con IFX-SC1.
En el análisis post-hoc de LIBERTY-CD presentado en la ECCO de 2025, se analizó el impacto de los ADA sobre la persistencia y eficacia clínica en pacientes tratados exclusivamente con IFX-SC durante 104 semanas. Sorprendentemente, la presencia de ADA no afectó significativamente la remisión clínica ni la continuidad del tratamiento, salvo en pacientes con títulos muy elevados (>1000 U/mL), donde se observó además menor tasa de remisión endoscópica6. Este hallazgo sugiere que, en el contexto de niveles valle estables, el impacto de la inmunogenicidad puede ser irrelevante.
En vida real, varios estudios han revisado también este aspecto; en la cohorte de switch de Liverpool, sólo 14 (7,7%) de los pacientes desarrollaron ADA, de los cuales 9 (64,3%) recibían comboterapia y sólo 2 se vieron obligados a suspender el tratamiento por este motivo7. En el estudio de Cerna et al., que incluía pacientes multirrefractarios, más del 58% de los pacientes con ADA positivos al momento del cambio negativizaron los anticuerpos tras 6 meses de tratamiento con IFX-SC, lo cual se asoció a una mejora significativa de los niveles y de los parámetros clínicos y bioquímicos8.
Fitzgerald et al., presentaron recientemente una cohorte de 115 pacientes que realizaron switch a IFX-SC. De ellos, 36 pacientes presentaban ADA y 12 los negativizaron tras 6 meses. Además, otro dato interesante que evaluaron fue la repercusión el alelo HLADQA1*05. De los 18 pacientes a los que les retiraron los IMM, ninguno positivizó ADA independientemente de la presencia de HLADQA1*059. En el estudio de Husman et al., se incluyó una cohorte de pacientes con pérdida secundaria de respuesta al tratamiento IV confirmada por niveles bajos y ADA positivos. Tras iniciar IFX-SC a dosis ajustada (hasta 240 mg/2 semanas), el 90% de los pacientes que completaron el seguimiento negativizó los ADA a los 12 meses con recuperación de niveles valle y respuesta clínica mantenida10. En la versión extendida del estudio REMSWITCH, sólo el 3,4% de los pacientes desarrollaron ADA tras 18 meses de seguimiento11. Por último, en la cohorte española de switch de Huguet et al., de los 60 pacientes incluidos, sólo se detectaron ADA en uno de los pacientes tras 6 meses de seguimiento12.
2. Persistencia al tratamiento
La persistencia terapéutica, definida como la duración del tratamiento sin interrupciones ni cambios por ineficacia o efectos adversos, es un parámetro útil para valorar la eficacia y seguridad de una terapia biológica. En el caso de IFX-SC, la persistencia se ha mostrado consistentemente elevada en múltiples contextos clínicos, reflejando no sólo eficacia mantenida, sino también buena tolerancia, satisfacción del paciente y facilidad de uso2.
En el estudio nacional coreano de seguimiento a 2 años, se evaluó la persistencia terapéutica de IFX-SC tras switch, en una cohorte multicéntrica de pacientes con EC. A las 98 semanas, la tasa de persistencia fue del 91,3%13. En la serie francesa publicada por Mathieu et al., de 426 pacientes con EII en remisión clínica al momento del cambio a IFX-SC, la persistencia al tratamiento fue del 95,3% a los 12 meses. Las tasas fueron similares entre pacientes en mono o comboterapia14 (Figura 1).
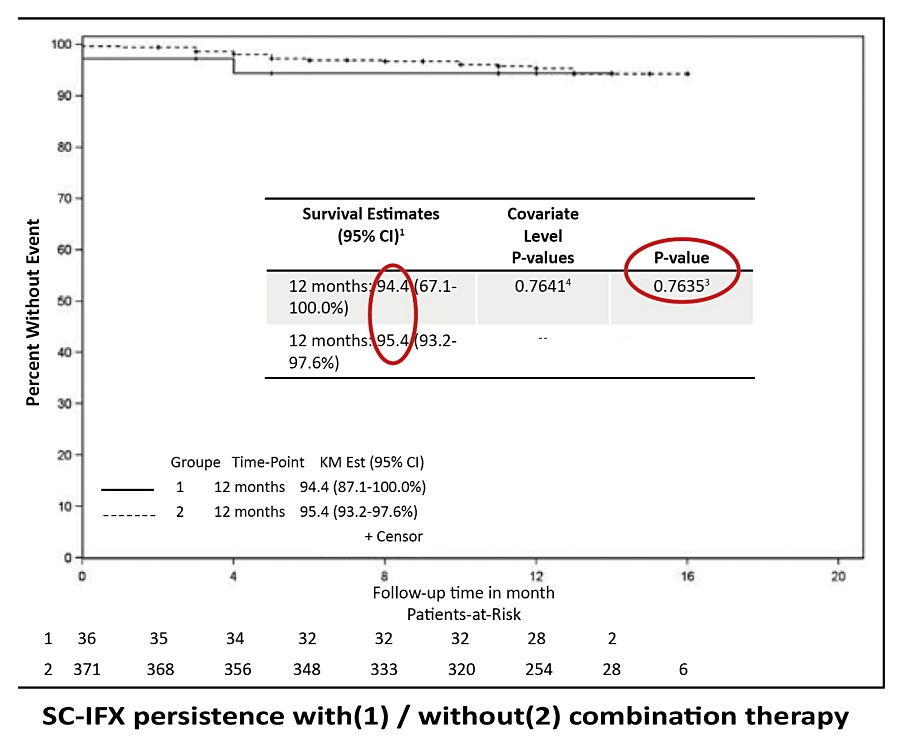
Figura 1. Persistencia en monoterapia versus comboterapia.
Extraída de referencia 14
Datos similares se observaron en las cohortes española y británica, con una persistencia a los 12 meses del 92 y 92,3%, respectivamente7,15. En el estudio Riposte se compararon 3 cohortes de pacientes; pacientes tratados con IFX-IV, pacientes que inician tratamiento con IFX-SC y pacientes en los que se realiza switch de IV a SC. En este caso, los pacientes con EC que realizaron switch a SC presentaron tasas de persistencia > 90%, significativamente superior a los dos grupos restantes, y en el caso de la CU, tanto los pacientes del grupo de SC como los del grupo de switch presentaron una persistencia del 80% y 90%, respectivamente, siendo ambas significativamente superiores al grupo de IV16.
Tras una media de seguimiento de 18 meses, en el estudio REMSWITCH-LT, sólo siete pacientes (5,3%) suspendieron el tratamiento, sin encontrarse diferencias entre las diferentes dosis basales de IFX-IV11. En otro estudio coreano, en el que 220 pacientes iniciaron IFX-SC, la persistencia fue del 88% y del 96% al año en pacientes con CU y EC, respectivamente17. Existen datos también de persistencia en cohortes complejas: multirrefractaria y con antecedentes de fallo inmunogénico a IFX-IV con tasas de 53% a 6 meses y 50% a 12 meses, respectivamente8,10. Además de en EII, existen datos de persistencia en otras indicaciones de IFX-SC como la espondilitis anquilosante, la artritis reumatoide o la artritis psoriásica; en la cohorte griega de 344 pacientes con IMID, el 96,5% de los pacientes continuaron con el tratamiento tras una media de 8 meses de seguimiento18.
Los estudios disponibles coinciden en que la remisión clínica al inicio del switch y ausencia de inmunogenicidad previa se asocian a una mayor probabilidad de persistencia con IFX-SC. IFX-SC presenta una de las tasas de persistencia más altas entre las terapias anti-TNF disponibles, tanto en pacientes naïve como en aquellos previamente tratados con IFX-IV. Su buena tolerancia, eficacia sostenida y perfil farmacocinético estable permiten una continuidad del tratamiento clínicamente relevante. Esta característica lo posiciona como una opción sólida a largo plazo para el manejo de IMIDs.

Autor/a: rogerphoto
Fuente: depositphotos.com
3. Tolerancia y aceptación de infliximab subcutáneo
Estos dos conceptos son determinantes para el éxito de un tratamiento a largo plazo. La pérdida de adherencia puede conducir a recaídas clínicas, aumento de la inmunogenicidad y progresión de la enfermedad. El tratamiento con IFX-IV implica acudir al hospital al menos cada 8 semanas para infusiones que requieren programación, control previo y administración supervisada. Esta logística es especialmente compleja para pacientes jóvenes, activos laboralmente o que viven lejos del hospital. A esto se suma el impacto indirecto: ausencias laborales, permisos médicos, costes de desplazamiento y saturación de recursos hospitalarios. La administración subcutánea de IFX-SC permite una mayor autonomía, flexibilidad horaria y evita la dependencia del hospital19.
En el estudio multicéntrico de Liverpool, la satisfacción de los pacientes con IFX-SC fue alta; el 78% de los encuestados prefirieron IFX-SC, el 89% estuvieron de acuerdo en que se sentían igual o mejor, y el 84% estuvieron de acuerdo en que IFX-SC controló bien su enfermedad y síntomas7. En el REMSWITCH-LT, en una escala de aceptabilidad la media fue de 8,8/1011.
En cuanto a efectos adversos, no se han reportado nuevos eventos que vayan más allá del perfil de seguridad bien caracterizado del IFX-IV, conocido por décadas de uso. La tasa combinada de efectos adversos (EA) en un metaanálisis fue del 5,7%, con una tasa de EA graves del 0,2%, tratándose, la mayoría, de reacciones leves relacionadas con la inyección. En cuanto a infecciones, la COVID-19 fue la infección más frecuente en los estudios, la cual fue común en el grupo IV y SC5. Por otro lado, un estudio belga de switch reportó 3 reactivaciones de virus herpes simple, y otro coreano 2 reactivaciones de virus herpes zóster20,21.
4. Infliximab subcutáneo en escenarios complejos
Existen escenarios complejos como la enfermedad perianal, los pacientes intensificados y los pacientes con sobrepeso en los que el IFX-SC puede ser una alternativa también eficaz como en el resto de los pacientes.
4.1 Enfermedad perianal
En cuanto a la enfermedad perianal, todavía no tenemos datos disponibles de los ensayos pivotales, mientras que en los estudios en vida real los datos son escasos. Sin embargo, con la evidencia actual parece que IFX-SC podría ser una alternativa óptima en estos pacientes principalmente por dos razones: IFX-SC duplica e incluso triplica los niveles en sangre del fármaco y, además, la administración frecuente permite hacer un manejo proactivo más estrecho. En el metaanálisis de switch publicado recientemente, sólo se incluyeron cuatro estudios con un seguimiento a 6 meses, sin encontrarse pérdida significativa de remisión clínica5. En la cohorte multirrefractaria checa, 13 de los 32 pacientes presentaban enfermedad perianal y, de ellos, 9 (69,2%) experimentaron mejoría o incluso cierre de la fístula8.
4.2 Pacientes intensificados
En el tratamiento con IFX-SC de pacientes intensificados existe cierta heterogeneidad en los resultados de los estudios. En la cohorte más a largo plazo analizada, los pacientes en tratamiento basal con dosis de 10mg/kg/6 semanas y 10mg/kg/4semanas presentaron tasas de recaída del 35,3% y 86,7%, respectivamente, con un éxito de rescate del 82% con intensificación a 240mg/2 semanas o 120mg/semanal. En este estudio se propone un algoritmo en el que los pacientes con dosis previas de 10mg/kg/6 semanas deben iniciar dosis de 120mg/2 semanas, pero con monitorización de niveles y calprotectina a las 8 semanas, y los de 10mg/kg/4 semanas deben iniciar directamente dosis de IFX-SC intensificada11.

Autor/a: NewAfrica
Fuente: depositphotos.com
En otras cohortes con un seguimiento menor y sin distinción entre las diferentes dosis de intensificación, no se encontraron diferencias en las tasas de recaída12,15, y en cuanto a niveles de fármaco, los pacientes con dosis basales intensificadas tuvieron niveles significativamente más bajos en la semana 12 y 24, pero no en la semana 5215. A diferencia de la mayoría de estudios en los que los pacientes pasan a 120mg/2 semanas independientemente de la dosis basal, en el estudio de Liverpool aproximadamente la mitad (23/50) de los pacientes intensificados pasaron a dosis de 120mg semanal, y los 27 restantes a dosis estándar. No se encontraron diferencias en la persistencia del tratamiento, niveles de calprotectina o IFX, únicamente los niveles de PCR fueron más bajos en el grupo de 120mg semanal7. A la vista de estos resultados, el manejo de los pacientes intensificados todavía es incierto. En el futuro, el ensayo clínico DISCUS-IBD, que investiga si el cambio de IFX-IV intensificado a IFX-SC es igual de efectivo para mantener la remisión en pacientes adultos con EII, probablemente nos aclare este escenario22.
4.3 Pacientes con sobrepeso
Otra cuestión relevante es la dosis que se debe administrar a los pacientes con sobrepeso, ya que el IFX-IV debe ajustarse al peso y quizás esto también sea necesario en la versión subcutánea. De nuevo existen datos controvertidos respecto a esta cuestión. El modelo virtual farmacocinético basado en fisiología propuesto por un grupo de estudio portugués indica que los pacientes con un peso mayor de 120kg deberían recibir dosis de 240mg/2 semanas23. Otro estudio de similares características pero con pacientes reales del ensayo Fase I CT-P13 1.6, reconoce que los pacientes con un peso superior a 120kg tienen una menor exposición simulada al fármaco, ya que a mayor peso, mayor aumento del aclaramiento del fármaco; sin embargo, afirman que la dosis estándar proporciona concentraciones adecuadas24.
Al igual que en modelos teóricos, en vida real también existen resultados dispares; en el análisis post hoc del REMSWITCH, el Índice de Masa Corporal (IMC) no se consideró un factor de riesgo de recaída25, y los británicos, en cuyo estudio el IMC medio fue de 27,5, éste tampoco se relacionó con los niveles de IFX7. Por otro lado, en otros dos estudios sí se relacionaron los niveles de IFX en sangre con el IMC15,26; además, el 82% de los pacientes que precisaron intensificación de la dosis SC tenían un IMC > 2515.
Un consenso de expertos ha definido biobetter como una molécula modificada de un biológico ya aprobado que mejora los resultados clínicos y/o la farmacología del fármaco. Los estudios y la experiencia en vida real con IFX-SC han demostrado que logra concentraciones séricas más altas y estables que la versión IV, manteniendo consistentemente niveles por encima del objetivo terapéutico, y esta mejora farmacocinética sustenta su descripción como biobetter. Además, aunque el consenso especificó que un perfil de seguridad mejorado o una mayor aceptabilidad por parte del paciente no eran suficientes por sí solos para definir un biobetter, IFX-SC también ofrece la ventaja de la conveniencia de la autoadministración en casa, la reducción de visitas a centros de infusión, y potencialmente una menor inmunogenicidad, lo que contribuye a su valor clínico general y a la satisfacción del paciente3. Sin duda, IFX-SC es una alternativa mejorada con fortalezas y oportunidades, pero también con desafíos y amenazas por resolver (Figura 2).
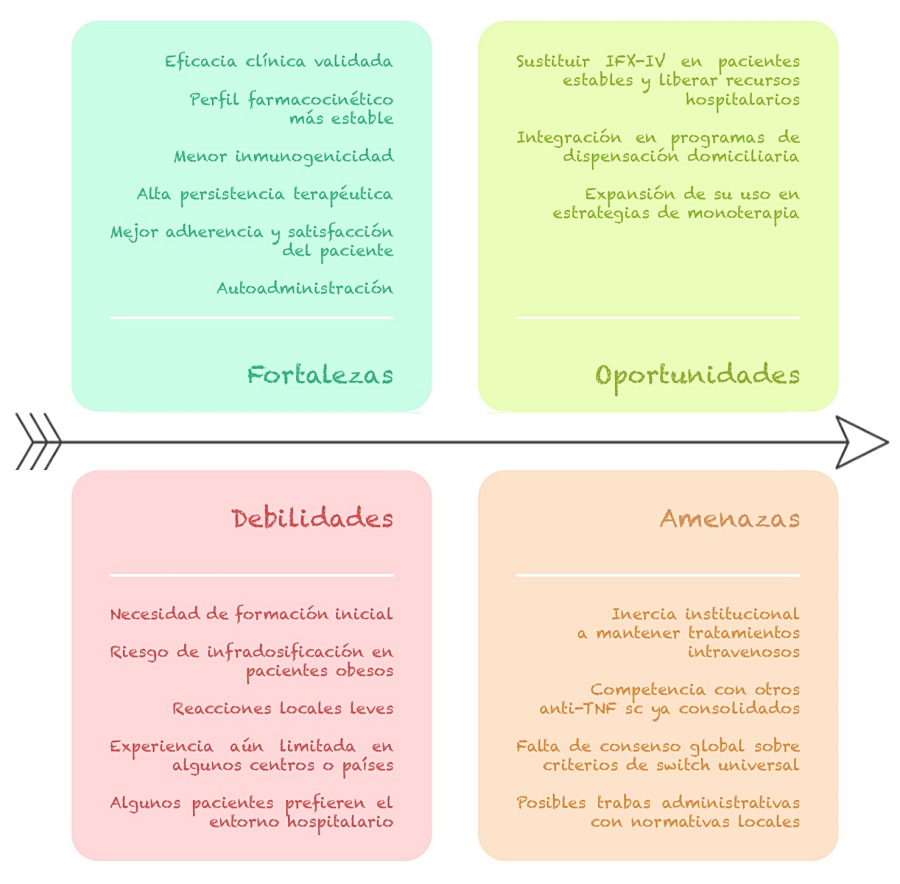
Figura 2.
Elaboración propia
A pesar de estos indicios, todavía no hay respuestas evidentes a todos estos escenarios expuestos. Para poder dar luz a estas cuestiones, desde el Hospital Universitario Puerta de Hierro hemos lanzado el estudio SPIN, un estudio multicéntrico prospectivo en pacientes que inicien este tratamiento cuyo objetivo primario es comparar la persistencia de IFX-SC versus IFX-IV. También ayudará a dilucidar aspectos como la monoterapia, el papel del HLADQA1*05 o si el IMC tiene influencia en la eficacia o en los niveles de fármaco.
Conclusiones
• IFX-SC es una alternativa eficaz y segura a la formulación intravenosa.
• Su perfil farmacocinético más estable se traduce en menores tasas de inmunogenicidad y mayor persistencia terapéutica.
• IFX-SC ha demostrado mantener la remisión clínica incluso en pacientes previamente intensificados o con inmunogenicidad.
• Permite una estrategia de monoterapia en pacientes seleccionados con niveles óptimos.
• Su tolerabilidad es excelente, con baja incidencia de efectos adversos.
• El switch desde IFX-IV ha demostrado ser seguro, eficaz y ampliamente aceptado.
• En conjunto, IFX-SC representa un biobetter con ventajas clínicas y logísticas, alineado con los principios de sostenibilidad y personalización del tratamiento.
Bibliografía
1. Parigi TL, D’Amico F, Peyrin-Biroulet L, Danese S. Evolution of infliximab biosimilar in inflammatory bowel disease: from intravenous to subcutaneous CT-P13. Expert Opin Biol Ther [Internet]. 2021;21(1):37–46.
2. Smith PJ, Fumery M, Leong RW, Novak K, Dignass A. Real-world experience with subcutaneous infliximab: broadening treatment strategies for inflammatory bowel disease. Expert Rev Clin Immunol [Internet]. 2023;19(9):1143–56.
3. D’Amico F, Solitano V, Aletaha D, Hart A, Magro F, Selmi C, et al. Biobetters in patients with immune-mediated inflammatory disorders: An international Delphi consensus. Autoimmun Rev [Internet]. 2021;20(7):102849.
4. Hanauer SB, Sands BE, Schreiber S, Danese S, Kłopocka M, Kierkuś J, et al. Subcutaneous Infliximab (CT-P13 SC) as Maintenance Therapy for Inflammatory Bowel Disease: Two Randomized Phase 3 Trials (LIBERTY). Gastroenterology. 2024;167(5):919–33.
5. Chetwood JD, Tran Y, Subramanian S, Smith PJ, Iborra M, Buisson A, et al. Intravenous Versus Subcutaneous Infliximab in Inflammatory Bowel Disease: A Systematic Review and Meta-analysis. J Crohn’s Colitis. 2024;18(9):1440–9.
6. Sands BE, Colombel JF, Rubin DT, Schreiber S, Siegel CA, Yarur A, Danese S, Kang A, Kim DH ,Lee YN, Hanauer SB. P0638 Impact of immunogenicity on 2-year clinical outcomes in patients with moderate-to-severe Crohn’s disease treated with subcutaneous infliximab: A post hoc analysis of the Phase 3 LIBERTY-CD study. J Crohn’s Colitis. 2025;19(Supplement_1):i1254–5.5.
7. Smith PJ, Critchley L, Storey D, Gregg B, Stenson J, Kneebone A, et al. Efficacy and Safety of Elective Switching from Intravenous to Subcutaneous Infliximab [CT-P13]: A Multicentre Cohort Study. J Crohn’s Colitis. 2022;16(9):1436–46.
8. Cerna K, Duricova D, Lukas M, Kolar M, Machkova N, Hruba V, et al. Subcutaneous Infliximab in Refractory Crohn’s Disease Patients: A Possible Biobetter? Crohn’s Colitis 360. 2023;5(4):1–7.
9. Fitzgerald AL,McBride J, Robertson H, Turnbull J,Talbot A, Whitehead E, Sebastian S. N11 Switching from intravenous to subcutaneous infliximab enhances trough levels and can facilitate de-escalation of concomitant immunomodulation, irrespective of the HLA DQA1*05 status: a prospective real-world study. J Crohn’s Colitis. 2025;19(Supplement_1):i2458.
10. Husman J, Černá K, Matthes K, Gilger M, Arsova M, Schmidt A. Subcutaneous infliximab in Crohn’s disease patients with previous immunogenic failure of intravenous infliximab. Int J Colorectal Dis [Internet]. 2024; Available from: https://doi.org/10.1007/s00384-024-04727-3
11. Buisson A, Nachury M, Bazoge M, Yzet C, Wils P, Dodel M, et al. Long-term effectiveness and acceptability of switching from intravenous to subcutaneous infliximab in patients with inflammatory bowel disease treated with intensified doses: The REMSWITCH-LT study. Aliment Pharmacol Ther. 2024;59(4):526–34.
12. Huguet JM, García-Lorenzo V, Martí L, Paredes JM, Ramírez JJ, Pastor M, et al. Subcutaneous Infliximab [CT-P13], a True Biologic 2.0. Real Clinical Practice Multicentre Study. Biomedicines. 2022;10(9):1–11.
13. Kim K, Hong SN, Kang SB, Lee KM, Koo JS, Jung Y, et al. P513 Clinical efficacy and durability of subcutaneous infliximab in patients with inflammatory bowel disease after switching from intravenous in a Korean multicenter prospective cohort study. J Crohn’s Colitis. 2024;18(Supplement_1):i1014–6.
14. Mathieu N, Heluwaert F, Riviere P, et al. P903. Persistence, efficacy and tolerance of subcutaneous Infliximab after switch from intravenous infliximab in IBD patients in remission: one-year results from a multicenter prospective cohort. J Crohn’s Colitis. 2024;18(Supplement_1):i1645.
15. Iborra M, Caballol B, Garrido A, Huguet JM, Mesonero F, Ponferrada Á, et al. Subcutaneous Infliximab Cutoff Points in Patients With Inflammatory Bowel Disease: Data From the ENEIDA Registry. J Crohn’s Colitis. 2024;(August):1–12.
16. Kirchgesner J, Quiles N, Foulley L, Habauzit C, Benkhalifa S, Prati C. P0586 Nationwide population-based cohort study on the use and persistence of infliximab (IV and SC) in France: the Riposte IBD study. J Crohn’s Colitis. 2025;19(Supplement_1):i1168-9.
17. Kim K, Hong SNH, Kang SBK, Lee KM, Koo JSK, Jung Y, et al. P761 Clinical efficacy and durability of subcutaneous infliximab in patients with moderate-to-severe inflammatory bowel disease : a real-world data from a Korean multicentre prospective cohort study. J Crohn’s Colitis. 2024;18(Supplement_1):i1420–2.
18. Viazis N, Karamanakos A, Mousourakis K, Christidou A, Fousekis F, Mpakogiannis K, et al. Switching from intravenous to subcutaneous infliximab in patients with immune mediated diseases in clinical remission. Front Med (Lausanne). 2025 May 16;12:1583401.
19. Schreiber S, Ben-Horin S, Alten R, Westhovens R, Peyrin-Biroulet L, Danese S, et al. Perspectives on Subcutaneous Infliximab for Rheumatic Diseases and Inflammatory Bowel Disease: Before, During, and After the COVID-19 Era. Adv Ther [Internet]. 2022 Jun;39(6):2342–64.
20. Cornelis L, De Jonckere E, Bossuyt J, Vanpoucke H, Desomer L, De Wulf D, et al. Switching intravenous to subcutaneous infliximab was safe and successful during 1-year follow up in Ulcerative Colitis and Crohn patients – a Belgian single center experience. Acta Gastroenterol Belg. 2025;88(1):18–22.
21. Hong SN, Song JH, Kim SJ, Park YH, Choi CW, Kim JE, et al. One-Year Clinical Outcomes of Subcutaneous Infliximab Maintenance Therapy Compared With Intravenous Infliximab Maintenance Therapy in Patients With Inflammatory Bowel Disease: A Prospective Cohort Study. Inflamm Bowel Dis. 2024;30(4):517–28.
22. Little RD, McKenzie J, Srinivasan A, Hilley P, Gilmore RB, Chee D, et al. Switching from Dose-Intensified intravenous to SubCutaneoUS infliximab in Inflammatory Bowel Disease (DISCUS-IBD): protocol for a multicentre randomised controlled trial. BMJ Open [Internet]. 2024 Jul 20;14(7):e081787.
23. Petric Z, Gonçalves J, Paixão P. Infliximab in Inflammatory Bowel Disease: Leveraging Physiologically Based Pharmacokinetic Modeling in the Clinical Context. Biomedicines. 2024;12(9):1974.
24. Hanzel J, Bukkems LH, Gecse KB, D’Haens GR, Mathôt RAA. Population pharmacokinetics of subcutaneous infliximab CT-P13 in Crohn’s disease and ulcerative colitis. Aliment Pharmacol Ther [Internet]. 2021 Nov;54(10):1309–19.
25. Buisson A, Nachury M, Pereira B, Fumery M. Switching From Intravenous to Subcutaneous Infliximab is Safe and Feasible in Patients With Inflammatory Bowel Disease Suffering From Obesity: A Post Hoc Analysis of the REMSWITCH Study. Clin Gastroenterol Hepatol. 2024;22(5):1127-1129.e2.
26. Temido MJ, Silva A, Lópes S, Ferreira AM, Mendes S, Ferreira M, et al. From Intravenous to Subcutaneous Infliximab: the Same but Different? Real-World Evidence from a Tertiary Center. Acta Gastroenterológica Latinoam. 2024;54(1):56–54.




