Drs. José María Paredes Arquiola y Eduardo Moreno-Osset
Introducción
Infliximab fue el primer fármaco biológico aprobado para el tratamiento de la Enfermedad Inflamatoria Intestinal (EII) hace ya 20 años; se trata de un anticuerpo monoclonal IgG1 anti-TNF, con una vida media de 14 días y de administración intravenosa con una pauta de inducción en las semanas 0, 2 y 6 y posteriormente cada 8 semanas1. Su eficacia en el tratamiento de la EII está recogida en múltiples estudios: desde los ensayos clínicos iniciales; estudios observacionales de práctica clínica posteriores; y metaanálisis2. Debido a ello infliximab, al igual que el resto de fármacos anti-TNF, es prescrito con frecuencia para el tratamiento de la EII convirtiéndolo en un componente importante de los costes de la atención a los pacientes con EII3.
Por otro lado, esta eficacia de los agentes anti-TNF no es completa; un 30% de los pacientes con EII no responden durante la fase de inducción y hasta un 20% anual de los pacientes que sí han respondido a la inducción pierden la respuesta posteriomente4,5. La falta de respuesta a los agentes anti-TNF, sobre todo la pérdida de la respuesta, se relaciona con los mecanismos de inmunogenicidad y con el elevado aclaramiento no inmunogénico de estos agentes; estos mecanismos provocan que la concentración sérica sea baja o indetectable6. Se considera fracaso farmacocinético del anti-TNF cuando los niveles séricos de fármaco son bajos o ausentes, y no se evidencian anticuerpos (Ac) frente al fármaco; este fenómeno se atribuye a un aclaramiento acelerado no inmune del fármaco en los tejidos o en la circulación sistémica. En el fracaso farmacodinámico, los niveles séricos de fármaco son normales y tampoco se detectan Ac frente al mismo; en este caso, el fracaso terapéutico se atribuye a la existencia de una vía inflamatoria no relacionada con el factor de necrosis tumoral alfa. Por último, en el fallo inmunogénico la presencia de títulos elevados de Ac frente al anti-TNF se asocia a niveles séricos del fármaco bajos o ausentes; la aparición de estos Ac se ha evidenciado incluso después de la primera infusión del fármaco7.

(de izq. a dcha): Drs. Eduardo Moreno-Osset y José María Paredes Arquiola
Fuente: Drs. Moreno-Osset y Paredes Arquiola
Por todo ello, en nuestra experiencia, dos de los hechos recientes que han conseguido mejorar el empleo de infliximab en la práctica clínica han sido la aparición de infliximab biosimilar, que ha permitido reducir los costes y aumentar la accesibilidad al fármaco, y la aplicación en la práctica diaria de la determinación de sus niveles séricos y de la presencia de anticuerpos frente a dicho fármaco, en lo que se ha denominado monitorización terapéutica del fármaco.
Infliximab biosimilar
La expiración de la patente de infliximab permitió la aparición en 2015 del primer biosimilar de esta molécula. Un fármaco biosimilar se define por la Organización Mundial de la Salud como un producto bioterapéutico que es similar en términos de calidad, seguridad y eficacia a un producto bioterapéutico, ya autorizado, de referencia8. Los fármacos biosimilares no son réplicas exactas de la molécula original debido a que, por sus complejas técnicas de manufacturación, tienen pequeñas diferencias estructurales y funcionales respecto a la molécula original9. Los requisitos para ser aprobado un fármaco biosimilar por las autoridades regulatorias incluyen: estudios de caracterización fisicoquímica y biológica, evaluación farmacocinética, farmacodinámica y clínica9. Una vez aprobados se obtiene la autorización en todas las indicaciones del fármaco original, en lo que se ha definido como extrapolación10.
El CT-P13 ha sido el primer biosimilar aprobado por la Agencia Europea del Medicamento para emplearse en todas las indicaciones de infliximab original, tras la extrapolación de los resultados de ensayos clínicos realizados en patología reumatológica11,12. Sin embargo, las diferencias entre la patología articular y la EII (diferencias patogénicas; distintas dosis empleadas entre la patología articular y la EII; y el frecuente empleo de metotrexato combinado con infliximab en las enfermedades reumatológicas) hizo que las sociedades científicas mostraran inicialmente ciertas dudas sobre la extrapolación de las indicaciones de infliximab en la EII13. Han sido los estudios de práctica clínica, tras la comercialización del fármaco biosimilar, los que han proporcionado una visión más profunda sobre la eficacia y seguridad del empleo del infliximab biosimilar en la EII10 y lo que ha llevado a un cambio en la opinión de las sociedades científicas a favor del empleo de infliximab biosimilar tanto en pacientes naive como en switch, ya que consideran que cambiar el medicamento original por un biosimilar es aceptable14.
Después de 5 años de uso de CT-P13 son muchos los estudios que garantizan la eficacia y seguridad del fármaco. Diferentes metaanálisis aúnan los resultados de CT-P13 en la EII15,16. En la tabla 1 se resumen los resultados de los principales estudios realizados, en adultos, con infliximab biosimilar CT-P13 en la EII17-27. Nos gustaría destacar, por su relevancia, los datos del estudio NORSWITCH, realizado en Noruega28. Se trata de un estudio fase IV, randomizado doble ciego, de grupos paralelos; es el estudio más numeroso que valora el intercambio de infliximab original a CT-P1328. Los pacientes son randomizados 1:1 a continuar el tratamiento con infliximab original o cambiar al biosimilar. El estudio incluye 482 pacientes con diversas patologías inmunes (artritis reumatoide, espondiloartropatía, artritis psoriásica, psoriasis en placas y EII), de los cuales 155 presentan enfermedad de Crohn (EC) y 93 colitis ulcerosa (CU). No se evidenciaron diferencias entre ambos grupos respecto al empeoramiento de la enfermedad (26% en el grupo original y 30% en el biosimilar) tras el cambio, ni en la aparición de anticuerpos frente al fármaco (7% original y 8% biosimilar). Aunque, este trabajo no presenta el suficiente poder estadístico como para valorar las distintas enfermedades de forma individual. La reciente actualización de este estudio centrada de forma exclusiva en EII, con un seguimiento a más largo plazo, muestra tasas de remisión equivalentes entre los grupos de tratamiento con infliximab original y biosimilar29.
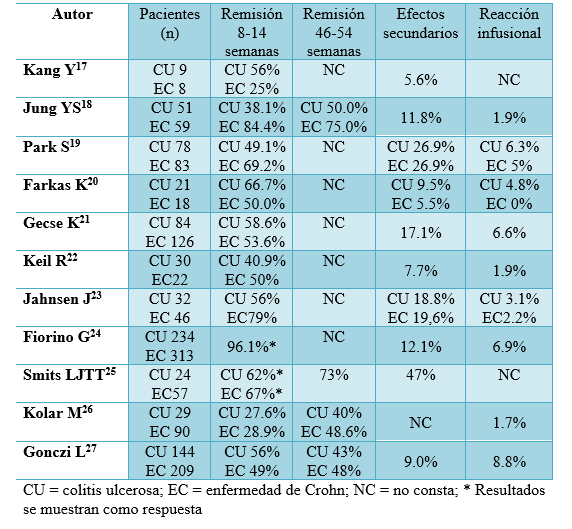
Tabla 1. Principales estudios clínicos de infliximab biosimilar (CT-P13) en la Enfermedad Inflamatoria Intestinal
Modificado de: 17-27
En nuestro centro, hemos participado en un estudio prospectivo, observacional, multicéntrico de práctica clínica real, actualmente publicado como abstract28. El objetivo principal fue valorar la eficacia y seguridad de CT-P13 al año de tratamiento, en pacientes tanto sin tratamiento biológico previo como en pacientes con fracaso a tratamiento biológico y cambios de la molécula original a CT-P13. El trabajo incluyó 220 pacientes con EII (40% CU y 60% EC). En este trabajo, solo un 19% de los casos son intercambio de molécula original a CT-P13; y un 25% habían fracasado previamente a algún tratamiento biológico. Al año de iniciar CT-P13, casi en un 40% se alcanzó la remisión y se evidenciaron efectos adversos en 34 pacientes (12.3%). En el trabajo se valoró también la inmunogenicidad del CT-P13 con la determinación de niveles séricos del fármaco y de la presencia de anticuerpos frente al mismo; solo 1 paciente presentó anticuerpos al finalizar el estudio.
Por lo tanto, la evidencia actual apoya la seguridad y eficacia de infliximab biosimilar en pacientes con Enfermedad Inflamatoria Intestinal. Sin embargo, aspectos como su empleo a largo plazo o la aparición de eventos inesperados de eficacia o seguridad que pueden ocurrir después de un cambio en su proceso de fabricación deben vigilarse11. En este último aspecto la monitorización farmacéutica del fármaco puede ser de utilidad.
Monitorización terapéutica de infliximab biosimilar
La monitorización terapéutica de un fármaco, en este caso infliximab, se define como la valoración de la concentración del fármaco y de la presencia de anticuerpos frente al mismo en suero5. Se puede emplear: de forma reactiva, cuando se presente una falta o una pérdida de respuesta al fármaco; o proactiva, en pacientes con respuesta o remisión de la enfermedad tanto durante el periodo de inducción como en la fase de mantenimiento, determinándose los niveles séricos del fármaco y ajustando la posología independientemente de la situación clínica29. Existe una clara correlación positiva entre los niveles séricos del fármaco biológico y unos resultados terapéuticos favorables; sin embargo, las bajas concentraciones séricas del fármaco biológico se asocian al desarrollo de inmunogenicidad y al fracaso del tratamiento29.
El empleo reactivo de la monitorización terapéutica de un fármaco biológico ha mostrado ser coste-efectivo cuando se compara con el ajuste de dosis empírico, y permite racionalizar la actitud ante la falta o la pérdida de respuesta al tratamiento biológico30,31. También, la utilización proactiva de la monitorización terapéutica de un fármaco biológico, con la determinación de los niveles séricos del fármaco en la fase de remisión, puede mejorar la eficacia, el coste-efectividad y la seguridad de los fármacos anti-TNF mediante la implementación de una estrategia de reducir la dosis, alargar los intervalos de tiempo entre las dosis y/o retirar el fármaco inmunosupresor (en los casos de tratamiento combinado) en los pacientes con concentraciones supra-terapéuticas32,33. Aun así, todavía existen varias barreras para aplicar la monitorización terapéutica a la práctica clínica diaria como son: el coste de la determinación de la concentración sérica y los anticuerpos; el tiempo de demora para obtener los resultados; la interpretación de los resultados; o la definición de la concentración óptima del fármaco que depende del objetivo terapéutico, del fenotipo de la EII y del método empleado para su determinación5.
Recientemente, un estudio ha valorado la aplicación de la monitorización terapéutica de infliximab biosimilar CT-P13 en práctica clínica real34. Se trata de un estudio retrospectivo, observacional, de cohortes, multicéntrico realizado en Francia que ha incluido a 364 pacientes con EII tratados con CT-P13. Durante un seguimiento de 54 semanas (protocolo establecido en las semanas 14, 22, 30 y 54) se recogió la actividad clínica de los pacientes, el estado de biomarcadores inflamatorios, los efectos adversos y las determinaciones realizadas de concentración sérica de CT-P13 y anticuerpos frente al mismo. Al final del seguimiento (semana 54), la media de concentración sérica de CT-P13 fue superior entre los pacientes en remisión clínica sin corticoides frente a los pacientes que no consiguieron esta situación (4.8 ± 4.2 µgr/ml frente a 3.2 ±4.3 respectivamente –p =0.001). En 124 pacientes, la monitorización terapéutica de CT-P13 se realizó de forma reactiva y en 209 pacientes se llevó a cabo de forma proactiva. Entre los pacientes del primer grupo fue necesario el ajuste de dosis (optimización) en un 88.7% de los casos, y cuando la monitorización fue proactiva la necesidad de optimización resultó significativamente inferior interesando al 22.5% de los pacientes (p < 0.001). En un 16% de los pacientes se detectaron anticuerpos frente a CT-P13 y se comunicaron reacciones infusionales en 13 pacientes. El trabajo concluye que, aunque la necesidad de optimización del tratamiento es inferior en el grupo que emplea de forma proactiva la monitorización terapéutica, es necesario confirmar este aspecto con nuevos estudios prospectivos.
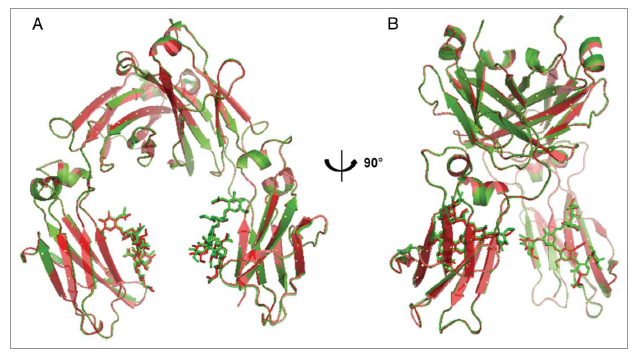
Figura 1. Superposición de las estructuras cristalinas de CT-P13 Fc (verde) y RMP Fc (rojo): (A) vista frontal; (B) vista lateral.
Tomada de: 35
Conclusión
Veinte años después de su aparición, infliximab sigue siendo una opción terapéutica de primera línea en la EII. La aparición de infliximab biosimilar ha permitido reducir costes en nuestro sistema sanitario, aumentar el acceso de los pacientes al tratamiento anti-TNF y promover la investigación, demostrando una eficacia, seguridad e inmunogenicidad comparables a la del fármaco original a corto y a largo plazo.
Bibliografía
1. Billiet T, Rutgeerts P, Ferrante M, et al. Targeting TNF-α for the treatment of inflammatory bowel disease. Expert Opin Biol Ther 2014; 14: 75-101.
2. Papamichales K, Lin S, Moore M, et al. Infliximab in inflimmatory bowel disease. Ther Adv Chronic Dis 2019;10:1-15.
3. Valk ME van der, Mangen M-JJ, Leenders M, et al. Healthcarecosts of inflammatory bowel disease have shifted from hospi-talisation and surgery towards anti-TNF therapy: results from the COIN study. Gut 2014;63:72-9.
4. Oussalah A, Evesque L, Laharie D, et al. A multicenter experience with infliximab for ulcerative colitis: outcomes and predictors of response, optimization, colectomy, and hospitalization. Am J Gastroenterol 2010;105:2617-25.
5. Ma C, Huang V, Fedorak DK, et al. Outpatient ulcerative colitisprimary anti-TNF responders receiving adalimumab or inflix-imab maintenance therapy have similar rates of secondary lossof response. J Clin Gastroenterol 2015;49:675-82.
6. Papamichael K and Cheifetz AS. Use of anti-TNF drug levels to optimise patient management. Frontline Gastroenterol 2016;7:289–300.
7. Ding NS, Hart A, de Cruz P. Systematic review: Predicting and optimising response to anti-TNF therapy in Crohn’s disease algorithm for practical management. Aliment Pharmacol Ther. 2016;43:30-51.
8. World Health Organization, Expert Committee on Biological Standardization. Guidelines on evaluation of similar biotherapeutic products (2009). www.who.int/biologicals/areas/biological_therapeutics/BIOTHERAPEUTICS_FOR_WEB _22APRIL2010.pdf.
9. Bonovas S, Peyrin-Biroulet L, Danese S. Infliximab biosimilar CT-P13 for inflammatory bowel disease. Lancet Gastroenterol Hepatol. 2018 Jun;3:373-375.
10. Farkas K, Molnár T. A review on biosimilar infliximab, CT-P13, in the treatment of inflammatory bowel disease. Immunotherapy. 2018 Feb;10:107-117.
11. Park W, Hrycaj P, Jeka S, et al. A randomised, double-blind, multicentre, parallel-group, prospective study comparing the pharmacokinetics, safety, and efficacy of CT-P13 and innovator infliximab in patients with ankylosing spondylitis: the PLANETAS study. Ann Rheum Dis 2013;72:1605-12.
12. Yoo DH, Hrycaj P, Miranda P, et al. A randomised, double-blind, parallel-group study to demonstrate equivalence in efficacy and safety of CT-P13 compared with innovator infliximab when coadministered with methotrexate in patients with active rheumatoid arthritis: the PLANETRA study. Ann RheumDis 2013;72:1613-20.
13. Danese S, Gomollon F, Governing Board and Operational Board of ECCO. ECCO position statement: the use of biosimilar medicines in the treatment of inflammatory bowel disease (IBD). J. Crohns Colitis 2013;7:586–589.
14. Danese S, Fiorino G, Michetti P. Changes in biosimilar knowledge among European Crohn’s Colitis Organization [ECCO] members: an updated survey. J. Crohns Colitis 2016;10:1362–1365.
15. Albshesh A, Ben-Horin S. CT-P13: a review on a biosimilar to infliximab in the treatment of inflammatory bowel disease, Expert Opin Biol Ther 2019;19:971-978.
16. Bernard E-J, Fedorak RN, Jairath V. Systematic review: non-medical switching of infliximab to CT-P13 in inflammatory bowel disease. Dig Dis Sci 2020 doi: 10.1007/s10620-019-06036-0. Online ahead of print.
17. Kang Y, Moon H, Lee S, Lim Y, Kang H. Clinical experience of the use of CT-P13, a biosimilar to infliximab in patients with inflammatory bowel disease: a case series. Dig. Dis. Sci. 2015;60:951–956.
18. Jung YS, Park DI, Kim YH et al. Efficacy and safety of CT-P13, a biosimilar of infliximab, in patients with inflammatory bowel disease: a retrospective multicenter study. J. Gastroenterol. Hepatol. 2015;30:1705–1712.
19. Park S, Kim Y, Lee J et al. Post-marketing study of biosimilar infliximab (CT-P13) to evaluate its safety and efficacy in Korea. Expert Rev.Gastroenterol. Hepatol. 2015;9:35–44.
20. Farkas K, Rutka M, Balint A et al. Efficacy of the new infliximab biosimilar CT-P13 induction therapy in Crohn’s disease and ulcerative colitis – experiences from a single center. Expert Opin. Biol. Ther. 2015;15:1257–1262.
21. Gecse K, Lovasz B, Farkas K et al. Efficacy and safety of the biosimilar infliximab CT-P13 treatment in inflammatory bowel diseases: a prospective, multicentre, nationwide cohort. J. Crohn’s Colitis 2016;10:133–140.
22. Keil R, Wasserbauer M, Z´adorov´a Z et al. Clinical monitoring: infliximab biosimilar CT-P13 in the treatment of Crohn’s disease and ulcerative colitis. Scand. J. Gastroenterol. 2016:51;1062–1068.
23. Jahnsen J, Jørgensen K. Experience with biosimilar infliximab (RemsimaR) in Norway. Dig. Dis. 35(1–2), 83–90 (2017).
24. Fiorino G, Manetti N, Armuzzi A et al. The PROSIT-BIO cohort: a prospective observational study of patients with inflammatory bowel disease treated with infliximab biosimilar. Inflamm. Bowel Dis. 2017;23:233–243.
25. Smits LJT, Derikx LAAP, de Jong DJ et al. Clinical outcomes following a switch from RemicadeR to the biosimilar CT-P13 in inflammatory bowel disease patients: a prospective observational cohort study. J. Crohns Colitis 2016:10;1287–1293.
26. Kolar M, Duricova D, Bortlik M et al. Infliximab biosimilar (RemsimaTM) in therapy of inflammatory bowel diseases patients: experience from one tertiary inflammatory bowel diseases centre. Dig. Dis. 2017;35:91–100.
27. Gonczi L, Gecse KB, Vegh Z, et al. Long-term efficacy, safety, and immunogenicity of biosimilar infliximab after one year in a prospective nationwide cohort. Inflamm Bowel Dis 2017 ;23 :1908-1915.
28. Jorgensen KK, Olsen IC, Goll GL et al. Switching from originator infliximab to biosimilar CT-P13 compared with maintained treatment with originator infliximab (NOR-SWITCH): a 52-week, randomised, double-blind, non-inferiority trial. Lancet 389(10086), 2304–2316 (2017).
29. Goll GL, Jorgensen KK, Sexton J, et al. Long-term efficacy and safety of biosimilar infliximab (CT-P13) after switching from originator infliximab: open-label extensión of the NOR-SWITCH trial. J Intern Med 2019;258:653-669.
30. Huguet JM, Cortés X, Martí L, et al. Eficacia y seguridad del biosimilar de infliximab (Remsima®) en la enfermedad inflamatoria intestinal en práctica clínica. Resultados a 1 año en pacientes naïve y switch. Gastroenterol Hepatol 2018;41:184.
31. Papamichael K, Cheifetz AS, Melmed GY, et al. Appropriate therapeutic drug monitoring of biologic agents for patients with inflammatory bowel disease. Clin Gastroenterol Hepatol 2019 ;17 :1655-1668.
32. Restellini S, Chao CY, Lakatos PL, et al. Therapeutic drug monitoring guides the management of crohn’s patients with secondary loss of response to adalimumab. Inflamm Bowel Dis 2018;24:1531–1538.
33. Steenholdt C, Brynskov J, Thomsen OØ, et al. Individualised therapy is more cost-effective than dose intensification in patients with Crohn’s disease who lose response to anti-TNF treatment: a randomised, controlled trial. Gut 2014;63:919–927.
34. Petitdidier N, Beaugerie L, Carbonnel F, et al. Real-world use of therapeutic drug monitoring of CT-P13 in patients with inflammatory bowel disease : A 12-month prospective observational cohort study. 2020 [Online ahead of print].
35. Soon Kwan Jung, Kyoung Hoon Lee, Jae Won Jeon, Joon Won Lee, Byoung Oh Kwon, Yeon Jung Kim, et al. Physicochemical characterization of Remsima®. mAbs. 2014; 6(5):1163-1177




